
- •1 Предмет термодинамики, ее методы, задачи место и роль в системе подготовки инженеров
- •2 Термодинамическая система
- •4 Параметры состояния. Уравнения состояния
- •6 Круговой процесс(цикл)
- •7 Газовые смеси, способы задания, вычисление параметров состояния, кажущейся молекулярной массы и газовой постоянной смеси, определение парц давл
- •9 Полная энергия тела(системы), внут энергия,энтальпия, энтропия, свойства
- •11 Второе нач термодинамики
- •13 Цикл Карно и его свойства
- •19 Назначение и конструкция подогревателей пвд и пнд
- •27 Pv диаг вод пара
- •30 Уравнение состояния реальных га-
- •32 Термодинамический анализ раобчих процессов преобразования энергии. Термодинамич кпд
- •34 Циклы паросиловых установок
- •37 Теплопроводность через цилиндрич стенки
- •38 Теплопередача через плоские и цилиндрич стенки коэф теплопередачи
- •39 Расчет тепловой изоляции трубопровода
- •48 Основы теории подобия
9 Полная энергия тела(системы), внут энергия,энтальпия, энтропия, свойства
Полная энергия системы является суммой внешней и внутренней энергии системы. Внешняя энергия системы состоит из кинетической и потенциальной энергий системы как целого. Внутренняя энергия системы – это энергия системы, зависящая только от ее внутреннего состояния и не включающая в себя виды энергии системы как целого.
Внутреннюю энергию системы U можно, в частности, найти, измеряя работу системы в адиабатном процессе (то есть при Q = 0): Аад = — U, что определяет U с точностью до некоторой аддитивной постоянной U0:
U = U + U0
Первое начало термодинамики утверждает, что U является функцией состояния системы, то есть каждое состояние термодинамической системы характеризуется определённым значением U, независимо от того, каким путём система приведена в данное состояние (в то время как значения Q и А зависят от процесса, приведшего к изменению состояния системы). При исследовании термодинамических свойств физической системы первое начало термодинамики обычно применяется совместно со вторым началом термодинамики.
В современной термодинамике второе начало термодинамики изолированных систем формулируется единым и самым общим образом как закон возрастания особой функции состояния системы, которую Клаузиус назвал энтропией (S). Физический смысл энтропии состоит в том, что в случае, когда материальная система находится в полном термодинамическом равновесии, элементарные частицы, из которых состоит эта система, находятся в неуправляемом состоянии и совершают различные случайные хаотические движения. В принципе можно определить общее число этих всевозможных состояний. Параметр, который характеризует общее число этих состояний, и есть энтропия. Q/Т=дельтаS [Дж/К]. S=0 для идеального цикла. S>>0 для реального цикла! Изменение энтропии – отношение теплоты отданной или полученной в изотермическом процессе
В термодинамике важную роль игра-
ет сумма внутренней энергии системы U
и произведения давления системы р на ее
объем V, называемая энтальпией
и обозначаемая Н:
H=U + pV.
Так как входящие в нее величины явля-
ются функциями состояния, то и сама
энтальпия является функцией состояния.
Так же как внутренняя энергия, ра-
бота и теплота, она измеряется в джоу-
лях (|
Энтальпия обладает свойством адди-
тивности. ^Величина
h= u+pv,
называемая удельной энталь-
пией (h = H/M), представляет собой
энтальпию системы, содержащей 1 кг ве-
щества, и измеряется в Дж/kг
Изменение энтальпии в любом про-
цессе определяется только начальным
и конечным состояниями тела и не за-
висит от характера процесса.
10 выражение теплоты и работы через т/д параметры
Внутренняя энергия системы, как было отмечено выше, изменяется в результате взаимодействия системы с внешней средой. Это взаимодействие может быть двояким. Первый способ передачи энергии (обмен энергии в виде тепла) реализуется при непосредственном контакте тел, имеющих различную температуру, путём обмена кинетической энергией между молекулами соприкасающихся тел. При этом энергия передаётся от более нагретого тела к менее нагретому, т.е. от тела, имеющего большую среднюю кинетическую энергию молекул, к телу с меньшей кинетической энергией молекул. Поскольку передача энергии этим способом происходит на молекулярном уровне, без видимого движения тел, то её называют микрофизической формой передачи энергии. Количество энергии, переданной первым способом от одного тела к другому, называют количеством теплоты, или просто теплотой.
Теплота, также, как любая энергия, измеряется в Джоулях (Дж). Принято обозначать произвольное количество теплоты через Q, а удельное (отнесённое к 1 кг) -через q. Подведённая теплота считается положительной, а отведённая - отрицательной. Второй способ передачи энергии связан с наличием силовых полей или внешнего давления. Для передачи энергии этим способом тело должно либо передвигаться в силовом поле, либо изменять свой объём под действием внешнего давления. Иначе говоря, в этом случае передача энергии происходит при условии перемещения всего тела или его части в пространстве. Поэтому второй способ будет макроскопической формой передачи энергии. Этот способ называется передачей энергии в форме работы, а количество переданной энергии в процессе - работой.
Работа также измеряется в Джоулях. Произвольное количество энергии,
переданное в форме работы, обозначают через L, а удельное - l.
В общем случае передача энергии в форме теплоты и в форме работы может происходить одновременно. При этом важно отметить, что в различных термодинамических процессах, в зависимости от условий их протекания, количество теплоты и работы будет также различно.
Следовательно, теплота и работа являются функциями процесса.
Математическая запись .
Если
.
Если
![]() =
=
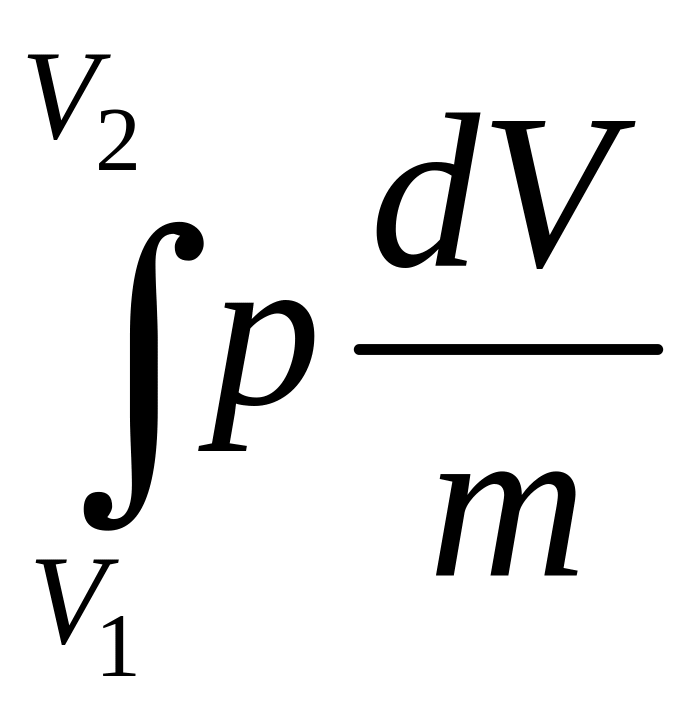
→ l -
удельная работа. Сначало изохорный
-
удельная работа. Сначало изохорный
процесс - 1g2; потом изобарный – 1е2.
Работа «+», если тело розширяется l > 0, dV>0(V2 > V1).
Работа «-», если dV<0, (V2 < V1 ).
lц >0, если прямые цыклы. lц <0, если обратные цыклы.
Теплота
dS=![]() →
δq=TdS. Матем. запись q
→
δq=TdS. Матем. запись q .
.
q > 0, если dS>0 (S2 > S1). q < 0, если dS<0 (S2 < S1).
qц = 0. qц > 0, если прямые цыклы
qц < 0, если обратные цыклы.
