
- •1 Предмет термодинамики, ее методы, задачи место и роль в системе подготовки инженеров
- •2 Термодинамическая система
- •4 Параметры состояния. Уравнения состояния
- •6 Круговой процесс(цикл)
- •7 Газовые смеси, способы задания, вычисление параметров состояния, кажущейся молекулярной массы и газовой постоянной смеси, определение парц давл
- •9 Полная энергия тела(системы), внут энергия,энтальпия, энтропия, свойства
- •11 Второе нач термодинамики
- •13 Цикл Карно и его свойства
- •19 Назначение и конструкция подогревателей пвд и пнд
- •27 Pv диаг вод пара
- •30 Уравнение состояния реальных га-
- •32 Термодинамический анализ раобчих процессов преобразования энергии. Термодинамич кпд
- •34 Циклы паросиловых установок
- •37 Теплопроводность через цилиндрич стенки
- •38 Теплопередача через плоские и цилиндрич стенки коэф теплопередачи
- •39 Расчет тепловой изоляции трубопровода
- •48 Основы теории подобия
6 Круговой процесс(цикл)
Круговой процесс (цикл) в термодинамике, процесс, при котором физическая система (например, пар), претерпев ряд изменений, возвращается в исходное состояние. Термодинамические параметры и характеристические функции состояния системы (температура Т, давление р, объём V, внутренняя энергия U, энтропия S и др.) в конце Круговой процесс вновь принимают первоначальное значение и, следовательно, их изменения при Круговой процесс равны нулю (DU = 0 и т. д.). Все изменения, возникающие в результате Круговой процесс, происходят только в среде, окружающей систему. Система (рабочее тело) на одних участках Круговой процесс производит положительную работу за счёт своей внутренней энергии и количеств теплоты Qn, полученных от внешних источников, а на др. участках Круговой процесс работу над системой совершают внешние силы (часть её идёт на восстановление внутренней энергии системы). Согласно первому началу термодинамики (закону сохранения энергии), произведённая в Круговой процесс системой или над системой работа (А) равна алгебраической сумме количеств теплоты (Q), полученных или отданных на каждом участке Круговой процесс (DU = Q — А = 0,А = Q). Отношение А/Qn (совершённой системой работы к количеству полученной ею теплоты) называется коэффициентом полезного действия (кпд) Круговой процесс. Различают равновесные (точнее, квазиравновесные) Круговой процесс, в которых последовательно проходимые системой состояния близки к равновесным, и неравновесные Круговой процесс, у которых хотя бы один из участков является неравновесным процессом. У равновесных Круговой процесс кпд максимален. На рисунке дано графическое изображение равновесного (обратимого) Карно цикла, имеющего максимальное кпд. Круговой процесс называется прямым, если его результатом является совершение работы над внешними телами и переход определённого количества теплоты от более нагретого тела (нагревателя) к менее нагретому (холодильнику). Круговой процесс, результатом которого является перевод определённого количества теплоты от холодильника к нагревателю за счёт работы внешних сил, называется обратным Круговой процесс или холодильным циклом.
7 Газовые смеси, способы задания, вычисление параметров состояния, кажущейся молекулярной массы и газовой постоянной смеси, определение парц давл
газовые смеси. В качестве примера можно
назвать продукты
сгорания топлива в двигателях
внутреннего сгорания, топках печей и па-
ровых котлов, влажный воздух в сушиль-
ных установках и т. п.
Основным законом, определяющим
поведение газовой смеси, является закон
Дальтона: полное давление смеси иде-
альных газов равно сумме парциальных
давлений всех входящих в нее компо-
нентов:
![]() Парциальное
давление р, —
Парциальное
давление р, —
давление, которое имел бы газ, если бы
он один при той же температуре занимал
весь объем смеси.
Способы задания смеси. Состав га-
зовой смеси может быть задан массовы-
ми, объемными или мольными долями.
Массовой долей называется
отношение массы отдельного компонента
Mi к массе смеси М:
gi= Mi/M.
Массовые доли часто задаются
в процентах. Например, для сухого воз-
духа gN2«77%; gO2«23%.
Объемная доля представляет
собой отношение приведенного объема
газа V, к полному объему смеси V:
ri=Vi/V
Приведенным называется объем,
который занимал бы компонент газа, ес-
ли бы его давление и температура равня-
лись давлению и температуре смеси.
Для вычисления приведенного
объема запишем два уравнения состоя-
ния j-ro компонента:
PiV=MtRiT; pVi = MiRiT.
Первое уравнение относится к состоянию
компонента газа в смеси, когда он имеет
парциальное давление р, и занимает пол-
ный объем смеси, а второе уравнение —
к приведенному состоянию, когда давле-
ние и температура компонента равны,
как и для смеси, р и Т. Из уравнений
следует, что
Иногда бывает удобнее задать со-
став смеси мольными долями. Моль-
ной долей называется отношение
количества молей Ni, рассматриваемого
компонента к общему количеству молей
смеси N.
В соответствии с законом Авогадро
объемы моля любого газа при одинако-
вых р и Т, в частности при температуре
и давлении смеси, в идеально газовом
состоянии одинаковы. Поэтому приве-
денный объем любого компонента может
быть вычислен как произведение объема
моля Vмю на число молей этого компо-
нента, т. е. Vi= VмюNi, а объем смеси — по
формуле V=VмюN Тогда Vi/V = ri =
= Ni/N, и, следовательно, задание смеси
идеальных газов мольными долями рав-
нозначно заданию ее объемными долями.
Газовая постоянная смеси газов
pV = MRcмT, D.45)
где
![]()
что смесь идеальных газов также подчиняется
уравнению Клапейрона.
Кажущаяся молекулярная масса смеси.
![]()
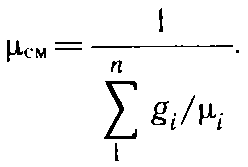
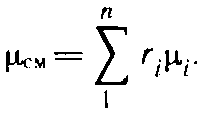
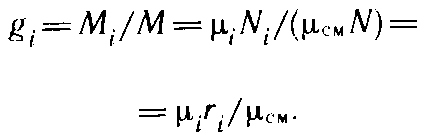
Соотношение между объемными и массо-
выми долями
![]()
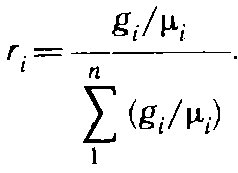
8 Первое нач термодинамики. Сущность, формулировки
Первое начало термодинамики - один из трех основных законов термодинамики, представляющий собой закон сохранения энергии для систем, в которых существенное значение имеют тепловые процессы. Согласно первому началу термодинамики, термодинамическая система (например, пар в тепловой машине) может совершать работу только за счёт своей внутренней энергии или каких-либо внешних источников энергии. Первое начало термодинамики объясняет невозможность существования вечного двигателя 1-го рода, который совершал бы работу, не черпая энергию из какого-либо источника.Сущность первого начала термодинамики заключается в следующем:
При сообщении термодинамической системе некоторого количества теплоты Q в общем случае происходит изменение внутренней энергии системы U и система совершает работу А:
Q = U + A
Уравнение (1.4), выражающее первое начало термодинамики, является определением изменения внутренней энергии системы (U), так как Q и А — независимо измеряемые величины. Внутреннюю энергию системы U можно, в частности, найти, измеряя работу системы в адиабатном процессе (то есть при Q = 0): Аад = — U, что определяет U с точностью до некоторой аддитивной постоянной U0:
U = U + U0
Первое начало термодинамики утверждает, что U является функцией состояния системы, то есть каждое состояние термодинамической системы характеризуется определённым значением U, независимо от того, каким путём система приведена в данное состояние (в то время как значения Q и А зависят от процесса, приведшего к изменению состояния системы). При исследовании термодинамических свойств физической системы первое начало термодинамики обычно применяется совместно со вторым началом термодинамики.
