
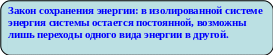
- •Э.Х. Процессами называются процессы взаимного превращения электрической и химической энергий.
- •Водородный электрод
- •Кислородный электрод
- •Форма записи гэ: ZnZnSo4 CuSo4 Cu
- •Изотерма Вант-Гоффа
- •Уравнение Нернста:
- •Изучает скорость и механизм протекания электродных процессов
- •Еконц Еэл/х
- •I пред – предельная плотность тока




Э.Х. Процессами называются процессы взаимного превращения электрической и химической энергий.




-







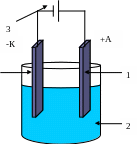
Электрохимическая ячейка Электролизер







![]()

* Используют при выводе всех уравнений, описывающих электрохимические превращения веществ на границе раздела проводников 1-го и 2-го рода (электрода и ионного проводника соответственно).
1–й закон. Массы или количества превращенных веществ при
протекании постоянного тока пропорциональны
количеству прошедшего через электролит
электричества q
m = kq = kIτ
k – электрохимический эквивалент (k = M/nF);
q = Iτ - количество электричества [Ас] или [Кл];
I - сила тока, прошедшего через систему [А];
τ – время протекания процесса, [с] ;
2-й закон. При прохождении через различные электролиты
одного и того же количества электричества массы
веществ, участвующих в электродных реакциях,
пропорциональны молярным массам их эквивалентов.
m(1) / m(2) = MЭ(1) / МЭ(2)
m(1) / MЭ(1) = m(2) / MЭ(2)
Э(1) моль-экв = Э(2) моль-экв.
Объединенный закон:
![]()
- для массы вещества
![]()
- для объема газообразных
веществ
где F – число Фарадея (произведение элементарного
электрического заряда е на число Авогадро NА)
МЭ – молярная масса эквивалента в-ва, [г/моль]
VЭ - объем моль-эквивалента газа [л/моль]
n - число электронов, участвующих в ОВП

c
![]()
Что происходит на границе раздела при погружении Ме в раствор собственной соли?
 Ме
-
из слоя Ме положительно заряженные
Ме
-
из слоя Ме положительно заряженные
ионы Меn+ переходят в раствор
Ме + mН2О Меn+ (Н2О)m+ ne
- в кристаллической решетке Ме
образуется избыток электронов и Ме
заряжается (-), а раствор – (+);
- на границе образуется двойной
электрический слой (ДЭС);
- между Ме и раствором возникает скачок потенциалов, который
называется электродным потенциалом
(или потенциалом электрода) ЕМеn+/Ме
- устанавливается равновесие Ме + mН2О Меn+ (Н2О)m+ne
(или проще Ме Меn+ + ne), которому соответствует
равновесный электродный потенциал: ЕрМеn+/Ме
Величина ЕМеn+/Ме зависит от
- природы электрода;
- состава электролита;
- температуры

В качестве электрода сравнения применяют водородный электрод
![]()
