
- •Вопрос 2 Явления подтверждающие сложность строения атома. Закономерности в атомных спектрах. Формула Бальмера
- •Вопрос 5 Ядерная модель атома (атом Резерфорда). Заряд атома.
- •Вопрос 6 Постулаты Бора, Опыты Франка и Герца, Квантование эллиптических орбит атом бора
- •Атом зоммерфельда
- •Вопрос 6 Опыты Штерна и Герца. Вопрос 16 , 19 Спин электрона.
- •Вопрос 7 Развитие взглядов на природу света. Эффект Комптона
- •Вопрос 10 Волновая функция. Операторы физических величин. Уравнение Шредингера.
- •Вопрос 11 Частица в одномерной потенциальной яме.
- •Вопрос 12 Прохождение частиц через потенциальный барьер (туннельный эффект).
- •Вопрос 14 Результат решения уравнения Шредингера для атома водорода
- •Вопрос 16 Момент импульса и его проекция. Квантовые числа и , Сложение моментов в квантовой механике, Спин-орбитальное взаимодействие и тонкая структура спектральных линий
- •Вопрос 23 Основное состояние многоэлектронного атома. Правило Хунла. Заполнение электронных оболочек атома. Периодическая система элементов
- •Вопрос 25 Рентгеновские спектры. Закон Мозли. Оже-эффект.
- •Вопрос 26 Эффект Зеемана, Эффект Пашена-Бака
- •Вопрос 27 Электронный парамагнитный резонанс (эпр)
Вопрос 2 Явления подтверждающие сложность строения атома. Закономерности в атомных спектрах. Формула Бальмера
Изучение атомных спектров послужило ключом к познанию строения атома. Прежде всего, было замечено, что линии в спектрах атомов располагается не беспорядочно, а группируется в так называемые серии. Отчетливее всего это обнаруживается в спектре атома водорода, изображенном на рис. 1.
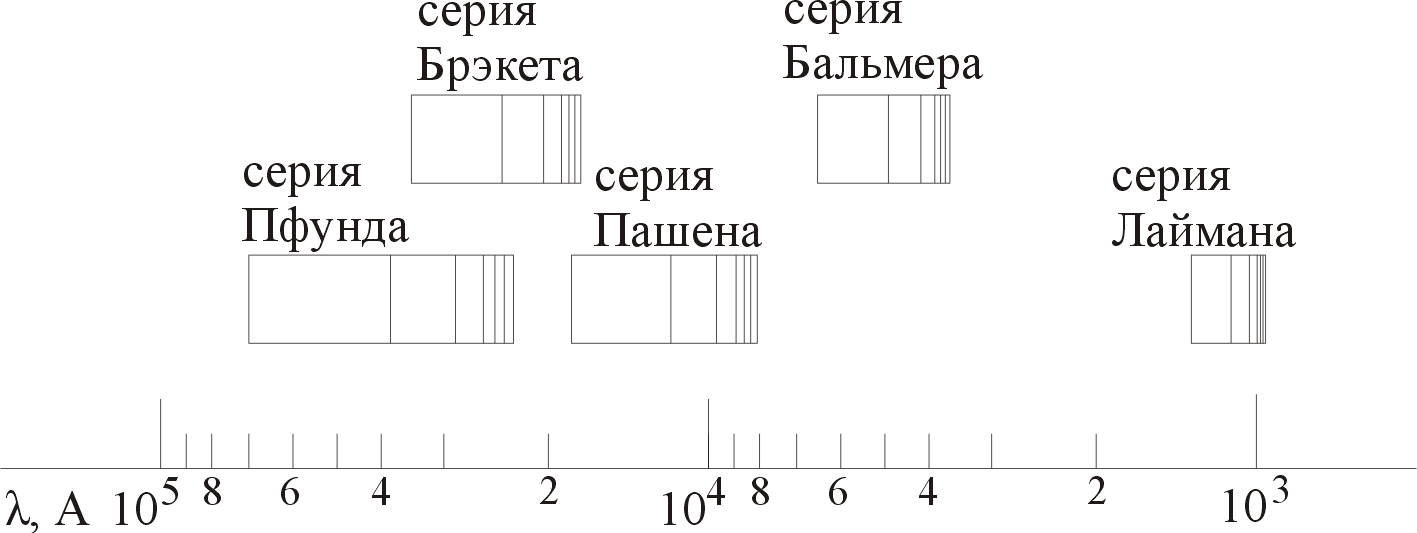
Р и с. 1
Очевидно, что линии располагаются в определенном порядке в виде серий, а расстояние между линиями в каждой серии закономерно убывает по мере перехода от более длинных волн к более коротким. Швейцарский физик Иоганн Бальмер обнаружил (1885 г.), что длины волн линий водорода могут быть точно представлены формулой
![]() (1)
(1)
или, при переходе от длины волны к частоте,
![]() , (2)
, (2)
где R = 109737 см-1 (3)
эмпирическая постоянная, называемая постоянной Ридберга, с скорость света в вакууме.
С формул (1) и (2) можно получить λ или любой линии в любой серии. Так, если положить n2 = 1, а величине n1 прида-
вать значения 2,3,4,... , то получим длины волн (частоты) линий в серии Лаймана:
серия Лаймана: n2 = 1, n1 = 2,3,4 ... (ультрафиолетовая область)
Аналогично, линии остальных серий получаются при следующих значениях n2 и n1:
серия Бальмера: n2 = 2, n1 = 3,4,5 ... (видимая область)
серия Пашена: n2 = 3, n1 = 4,5,б... (инфракрасная область)
серия Брэкета: n2 = 4, n1 = 5,6,7 (инфракрасная область)
серия Пфунда: n2 = 5, n1 = б,7,8 ... (инфракрасная область)
Вопрос 5 Ядерная модель атома (атом Резерфорда). Заряд атома.


Вопрос 6 Постулаты Бора, Опыты Франка и Герца, Квантование эллиптических орбит атом бора
Первая удачная попытка создания модели атома водорода, которая объяснила его наблюдаемый спектр, принадлежит Нильсу Бору (1913 г.). В конечном счете, Бор исходил из трех постулатов, которые можно сформулировать следующим образом:
Атомы могут пребывать только в определенных стационарных состояниях, в которых они не излучают и не поглощают энергии. В этих состояниях атомы обладают энергиями, образующими дискретный ряд:
Е1, Е2, Е3, Е4… (4)
Атомы могут излучать или поглощать энергию лишь при переходе из одного стационарного состояния в другое, причем частоты излучения (поглощения) определяются правилом:
![]() (5)
(5)
В стационарных состояниях электрон движется вокруг ядра по круговым орбитам, для которых момент импульса электрона принимает значения, кратные
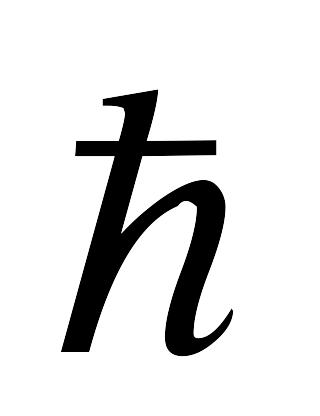 :
:
![]() ,
n
= 1,2,3,4…
(6)
,
n
= 1,2,3,4…
(6)
где h и =h/2 – постоянные Планка.
По выражение самого Бора, "эти допущения находятся в явном противоречии с общепринятым пониманием электродинамики, но представляются необходимыми для экспериментально установленных фактов".
Если
учесть, что момент импульса по определению
![]() или просто N = mVr
для круговых орбит, то, используя третий
постулат, можно, найти радиусы разрешенных
орбит
или просто N = mVr
для круговых орбит, то, используя третий
постулат, можно, найти радиусы разрешенных
орбит
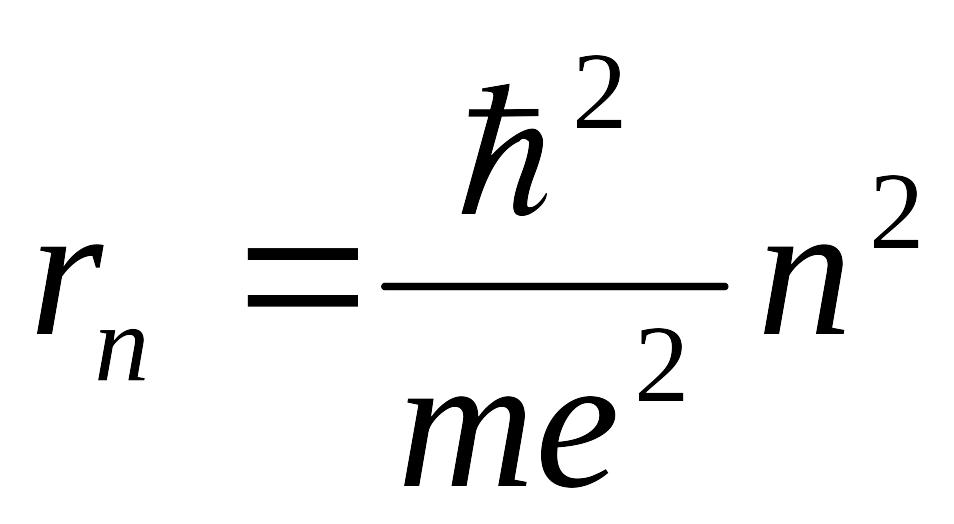 ,
(7)
,
(7)
где m – масса и e – заряд электрона.
Далее, имея в виду, что полная энергия атома как системы ядро-электрон связана с радиусом обращения электрона как E = –е2/2r, можно получить выражение для возможных значений энергий атома в стационарных состояниях:
 (8)
(8)
На рис. 2 графически изображены возможные значения энергии и соответствующие орбиты электронов в атоме водорода.
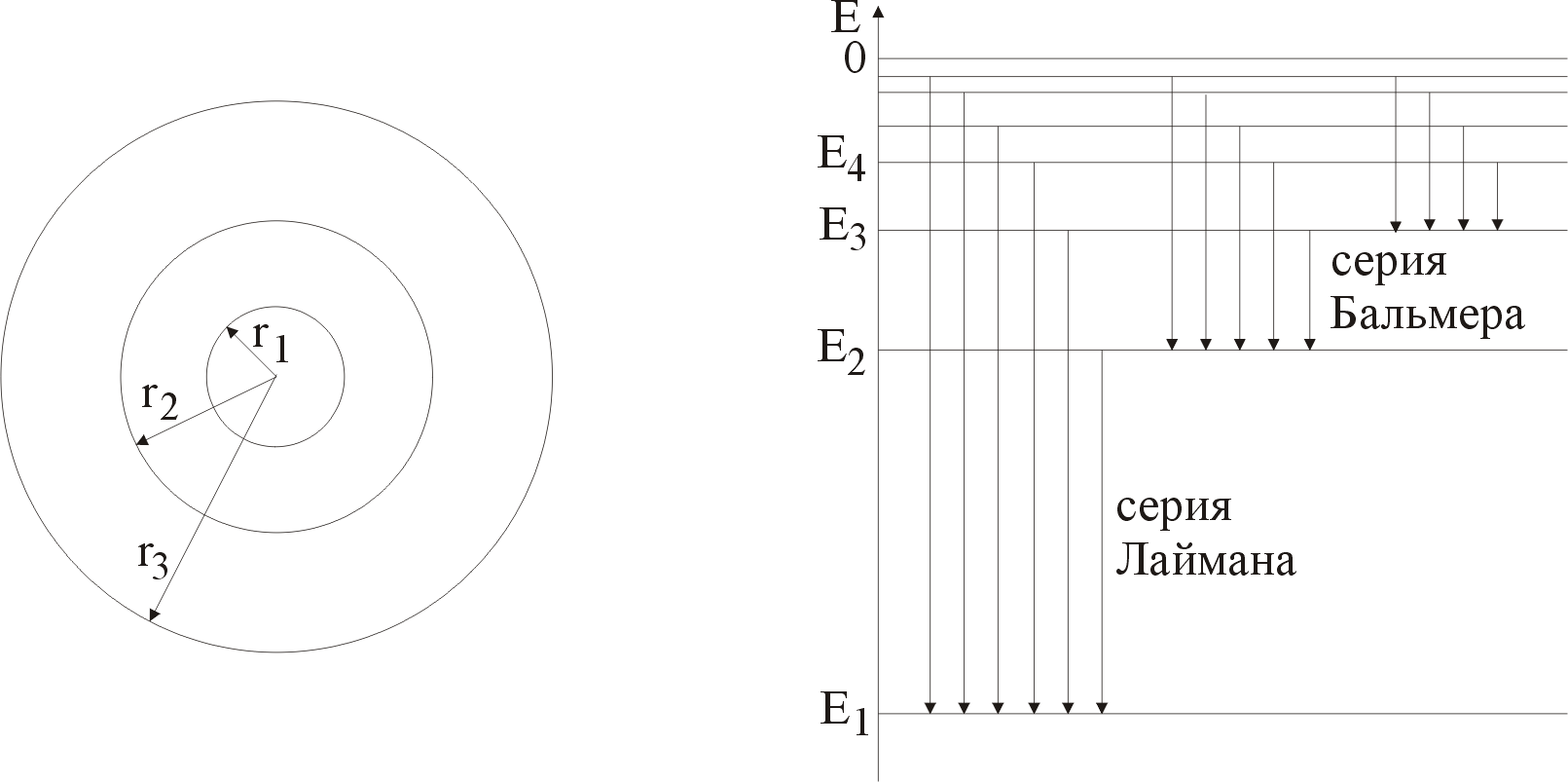
а) б)
Р и с. 2
Основному (невозбужденному) состоянию при n = 1 соответствуют:
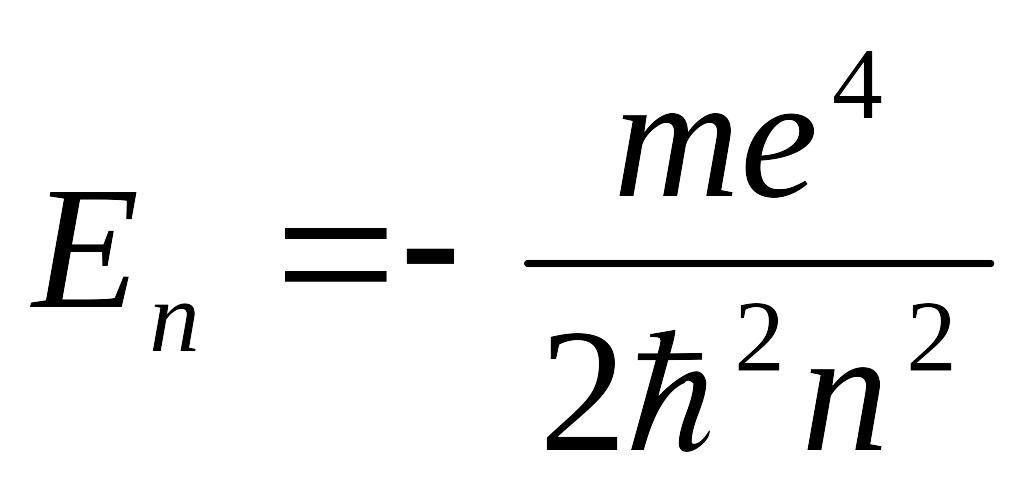 =
–13,6
эВ и
=
–13,6
эВ и 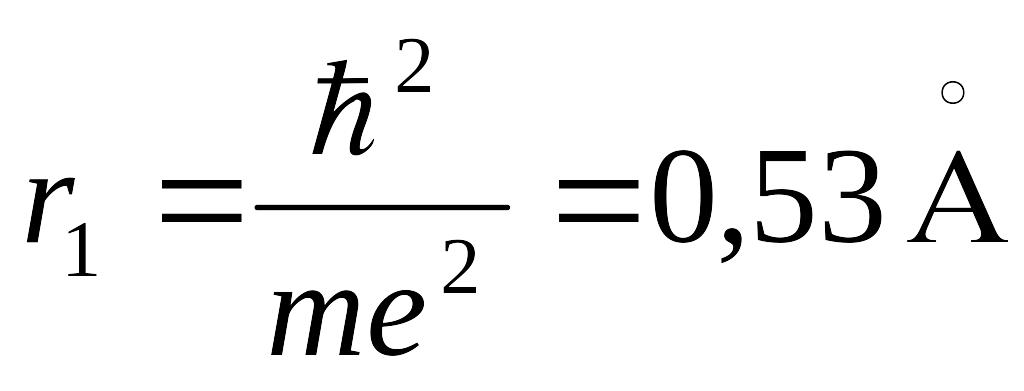
где r1 так называемый первый боровский радиус.
При возбуждении атомы переходят в состояния c большими значениями энергии и затем, при обратных переходах, которые изображены стрелками и сгруппированы определенным образом на рис. 2,б, излучают, согласно правилу частот (5), серии линий, изображенные на рисунке 1.
Аналитически частоты этих линий можно получить, комбинируя (5) и (8)
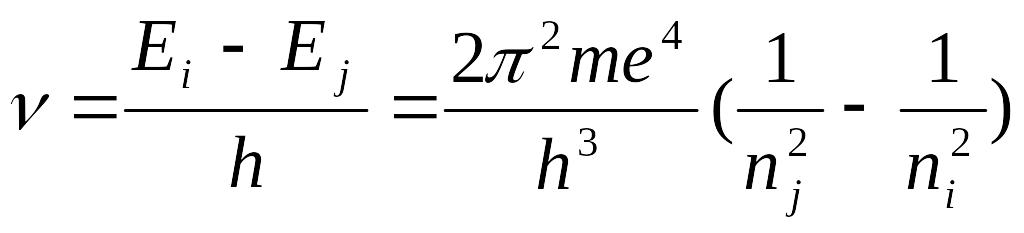 (9)
(9)
С точностью до принятых обозначений (9) соответствует выражению (2), в котором с таким же успехом можно было принять n2 = nj и n1 = ni. Приравнивая коэффициенты перед скобками в (2) и (9), можно выразить постоянную Ридберга через универсальные константы и получить ее значение:
![]() см-1,
см-1,
что поразительно хорошо согласуется с эмпирическим значением (3), Таким образом, выражения (2) и (9) совершенно эквивалентны, что свидетельствует о полном количественном соответствии теории Бора с экспериментом.
Опыты Франка и Герца.

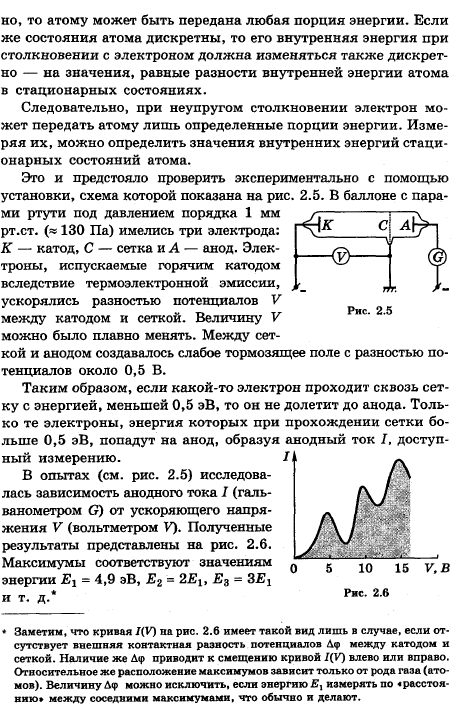
Квантование эллиптических орбит
