- •5. Способы образования ковалентной связи: обменный и донорно-акцепторный. Σ и π-связи, полярность связи.
- •6. Метод валентных связей (мвс). Гибридизация атомных орбиталей и геометрия молекул. Полярность молекул.
- •Полярность молекул
- •Предсказание полярности молекулы
- •Свойства и примеры
- •Полярные молекулы
Полярность молекул
Полярность молекул
Способность молекулы нести положительный и отрицательный заряды. Увеличение электронной плотности в одной части молекулы приводит к тому, что данная часть молекулы несет отрицательный заряд, в то время как другая часть, с пониженной плотностью электронов, — заряд положительный. Области концентрации зарядов в молекуле называются полюсами, а сами молекулы — полярными. Полярная молекула с двумя полюсами (положительным и отрицательным) носит название диполь (от греч. di «два», polos «полюс»). Вещество, образованное полярными молекулами, также является полярным. |
Молекула составлена из одной или более химических связей (ковалентные связи) междумолекулярным orbitals различных атомов. Молекула может быть полярной или в результате полярных связей из-за различий в electronegative как описано выше, или в результате асимметричного расположения неполярных ковалентных связей и несближающихся пар электронов, известных как полноемолекулярное орбитальное.
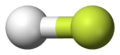
Пример 1. Водородный фторид, ПОЛОВИНА, молекула является полярной на основании полярных ковалентных связей — в ковалентных электронах связи, перемещены к большему количеству electronegative атома фтора.
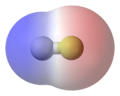
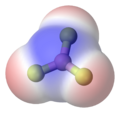
Пример 2. В аммиаке, NH3, молекуле у трех связей N–H есть только небольшая полярность (к большему количеству electronegative атома азота). Однако, у молекулы есть два одиноких электрона в орбитальном, которое указывает на четвертую вершину приблизительного четырёхгранника, (VSEPR). Это орбитальное не участвует в ковалентном соединении; это - электронные богатые, который приводит к мощному диполю через целую молекулу аммиака.
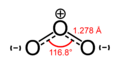
Пример 2.5. В озоне, O3, молекуле две связи O–O неполярны (нет никакого electronegativity различия между атомами того же самого элемента). Однако, распределение других электронов неравно — так как центральный атом должен разделить электроны с двумя другими атомами, но каждый из внешних атомов только должны разделить электроны с одним другим атомом, центральный атом более лишен электронов чем другие (у центрального атома есть формальное обвинение +1, в то время как внешние атомы у каждого есть формальное обвинение −1/2). Так как у молекулы есть геометрия склонности, это приводит к диполю через целую молекулу озона.
Водородный фторид, большеelectronegative атома фторида показывают в желтом |
Водородный фторид, красный, представляет частично отрицательно заряженные области |
Аммиак, два одиноких электронапоказывают в желтом, водородных атомах в белом |
Аммиак, красный, представляет частично отрицательно заряженные области |
Озон |
|
|
|
Подобным образом, молекула может быть неполярной или потому что нет (почти) никакой полярности в связях или из-за симметрического расположения полярных связей.
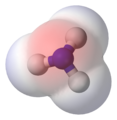
Пример 3. В метане молекула CH4 четыре связи C–H устроены четырёхгранным образом вокруг углеродистого атома. У каждой связи есть полярность (хотя не очень сильный). Однако, связи устроены симметрично, таким образом, в молекуле нет никакого полного диполя.
Пример 4. Бор trifluoride, BF3, у молекулы есть треугольное плоское расположение трех полярных связей в 120o, Это не приводит ни к какому полному диполю в молекуле.
Пример 5. Кислород, O2, у молекулы нет полярности в ковалентной связи из-за равного electronegativity, следовательно в молекуле нет никакой полярности.
Метан, связи устроены симметрично, таким образом, нет никакого полного диполя |
Бор trifluoride, треугольное плоское расположение трех полярных связей не приводит ни к какому полному диполю |