- •5. Способы образования ковалентной связи: обменный и донорно-акцепторный. Σ и π-связи, полярность связи.
- •6. Метод валентных связей (мвс). Гибридизация атомных орбиталей и геометрия молекул. Полярность молекул.
- •Полярность молекул
- •Предсказание полярности молекулы
- •Свойства и примеры
- •Полярные молекулы
6. Метод валентных связей (мвс). Гибридизация атомных орбиталей и геометрия молекул. Полярность молекул.
Метод валентных связей (МВС) иначе называют теорией локализованных электронных пар, поскольку в основе метода лежит предположение, что химическая связь между двумя атомами осуществляется с помощью одной или нескольких электронных пар, которые локализованы преимущественно между ними. В отличие от ММО, в котором простейшая химическая связь может быть как двух-, так и многоцентровой, в МВС она всегда двухэлектронная и обязательно двухцентровая. Число элементарных химических связей, которые способен образовывать атом или ион, равно его валентности. Так же, как и в ММО, в образовании химической связи принимают участие валентные электроны. Волновая функция, описывающая состояние электронов, образующих связь, называется локализованной орбиталью (ЛО).
Отметим, что электроны, описываемые ЛО, в соответствии с принципом Паули должны иметь противоположно направленные спины, то есть в МВС все спины спарены, и все молекулы должны быть диамагнитны. Следовательно, МВС принципиально не может объяснить магнитные свойства молекул.
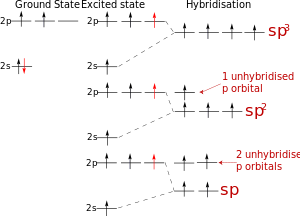
Тем не менее, принцип локализованных связей имеет ряд важных преимуществ, одно из которых – его чрезвычайная наглядность. МВС достаточно хорошо, например, предсказывает валентные возможности атомов и геометрию образующейся молекулы. Последнее обстоятельство связано с так называемой гибридизацией АО. Она была введена для объяснения того факта, что двухэлектронные двухцентровые химические связи, образованные за счет АО в разных энергетических состояниях, имеют одинаковую энергию. Так, Be*(2s11p1), B*(2s12p2), C*(2s12p3) образуют за счет s- и p-орбиталей соответственно две, три и четыре связи, а потому одна из них должна быть прочнее других. Однако опыт показывает, что в BeH2, BCl3, CH4 все связи равноценны. У BeH2 угол связи равен 180°, у BCl3 – 120°, а у CH4 – 109°28'.
![]()
|
Модель 3.4. Гибридизация орбиталей |
Согласно представлению о гибридизации, химические связи образуются смешанными – гибридными орбиталями (ГО), которые представляют собой линейную комбинацию АО данного атома (s- и p-АО Be, B, C), обладают одинаковыми энергией и формой, определенной ориентацией в пространстве (симметрией). Так s- и p-орбитали дают двеsp-ГО, расположенные под углом 180° друг относительно друга.
|
Рисунок 3.16 s-орбиталь + p-орбиталь и две sp-ГО |
В молекуле CH4 гибридные орбитали из четырех АО углерода (одной s и трех p), называются sp3-орбиталями, они полностью эквивалентны энергетически и пространственно направлены к вершинам тетраэдра.
Таким образом, когда один атом образует несколько связей, а его валентные электроны принадлежат разным орбиталям (s и p; s, p и d), для объяснения геометрии молекул в МВС необходимо привлекать теорию гибридизации атомных орбиталей. Основные положения теории следующие:
Введение гибридных орбиталей служит для описания направленных локализованных связей. Гибридные орбитали обеспечивают максимальное перекрывание АО в направлении локализованных σ-связей.
Число гибридных орбиталей равно числу АО, участвующих в гибридизации.
Гибридизуются близкие по энергии валентные АО независимо от того, заполнены они в атоме полностью, наполовину или пусты.
В гибридизации участвуют АО, имеющие общие признаки симметрии.
Согласно табл. 3.3 гибридные орбитали дают молекулы с углами 180°, 120°, 109°28', 90°. Это правильные геометрические фигуры. Такие молекулы образуются, когда все периферические атомы в многоэлектронной молекуле (или ионе) одинаковы и их число совпадает с числом гибридных орбиталей. Однако, если число гибридных орбиталей больше числа связанных атомов, то часть гибридных орбиталей заселена электронными парами, не участвующими в образовании связи, – несвязывающими илинеподеленными электронными парами.
|
||||||||||||||||||||||||||||||
Таблица 3.3 Гибридные орбитали и геометрия молекул |
В качестве примера рассмотрим молекулы NH3 и H2O. Атомы азота и кислорода склонны к sp3-гибридизации. У азота на sp3-ГО, поимо трех связывающих пар электронов, образующих связь с тремя атомами водорода, остается одна несвязывающая пара. Именно она, занимая одну sp3-ГО, искажает угол связи H–N–H до 107,3°. В молекуле H2O таких несвязывающих пар две, и угол H–O–H равен 104,5° (рис. 3.17).
|
Рисунок 3.17 Несвязывающие электронные пары и углы связи в молекулах NH3и H2O в сравнении с молекулой CH4 |
Электроны связывающих и несвязывающих пар по-разному взаимодействуют между собой. Чем сильнее межэлектронное отталкивание, тем больше условная поверхность на сфере, занимаемый электронной парой. Для качественного объяснения экспериментальных фактов обычно считается, что несвязывающие пары занимают больший объем, чем связывающие, а объем связывающих пар тем меньше, чем больше электроотрицательности периферийных атомов (метод Гиллеспи).
Гибридизация орбиталей — гипотетический процесс смешения разных (s, p, d) орбиталей центрального атома многоатомной молекулы с возникновением того же числа орбиталей, эквивалентных по своим характеристикам.
[править]Концепция гибридизации
![]()
Схема гибридизации атомных орбиталей атома углерода
Концепция гибридизации валентных атомных орбиталей была предложена американским химиком Лайнусом Полингом для ответа на вопрос, почему при наличии у центрального атома разных (s, p, d) валентных орбиталей, образованные им связи в многоатомных молекулах с одинаковыми лигандами оказываются эквивалентными по своим энергетическим и пространственным характеристикам.
Представления о гибридизации занимают центральное место в методе валентных связей. Сама гибридизация не является реальным физическим процессом, а только удобной моделью, позволяющей объяснить электронное строение молекул, в частности гипотетические видоизменения атомных орбиталей при образовании ковалентной химической связи, в частности, выравнивание длин химических связей и валентных углов в молекуле.
Концепция гибридизации с успехом была применена для качественного описания простых молекул, но позднее была расширена и для более сложных. В отличие от теории молекулярных орбиталей не является строго количественной, например она не в состоянии предсказать фотоэлектронные спектры даже таких простых молекул как вода. В настоящее время используется в основном вметодических целях и в синтетической органической химии.
В 1954 году Нобелевский комитет удостоил Л.Полинга премии по химии «За изучение природы химической связи и его применение к объяснению строения сложных молекул». Но сам Л.Полинг не был удовлетворён введением σ,π — описания для двойной и тройной связи и сопряжённых систем.
В 1958 году на симпозиуме, посвящённом памяти Кекуле, Л.Полинг развил теорию изогнутой химической связи, учитывающуюкулоновскую электронную корреляцию. По этой теории двойная связь описывалась как комбинация двух изогнутых химических связей, а тройная связь как комбинация трёх изогнутых химических связей.[1]
Этот принцип нашёл отражение в теории отталкивания электронных пар Гиллеспи — Найхолма. Первое и наиболее важное правило которое формулировалось следующим образом:
«Электронные пары принимают такое расположение на валентной оболочке атома, при котором они максимально удалены друг от друга, т.е электронные пары ведут себя так, как если бы они взаимно отталкивались»[2].
Второе правило состоит в том, что «все электронные пары, входящие в валентную электронную оболочку, считаются расположенными на одинаковом расстоянии от ядра».[2]
[править]Виды гибридизации
[править]sp-гибридизация
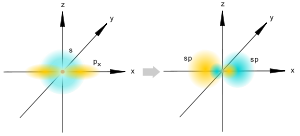
sp-гибридизация
Происходит при смешивании одной s- и одной p-орбиталей. Образуется две равноценные sp-атомные орбитали, расположенные линейно под углом 180 градусов и направленные в разные стороны от ядра атома углерода. Две оставшиеся негибридные p-орбитали располагаются во взаимно перпендикулярных плоскостях и участвуют в образовании π-связей, либо занимаются неподелёнными парами электронов.
[править]sp2-гибридизация
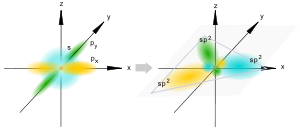
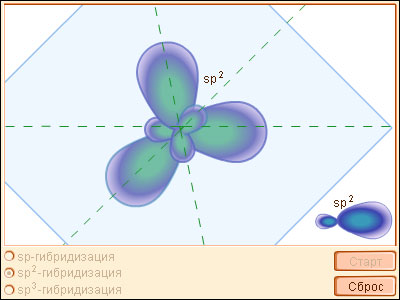
sp2-гибридизация
Происходит при смешивании одной s- и двух p-орбиталей. Образуется три гибридные орбитали с осями, расположенными в однойплоскости и направленными к вершинам треугольника под углом 120 градусов. Негибридная p-атомная орбиталь перпендикулярна плоскости и, как правило, участвует в образовании π-связей
[править]sp3-гибридизация
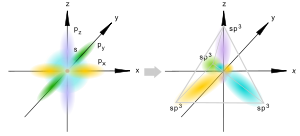
sp3-гибридизация
Происходит при смешивании одной s- и трех p-орбиталей, образуя четыре равноценные по форме и энергии sp3-гибридные орбитали. Могут образовывать четыре σ-связи с другими атомами или заполняться неподеленными парами электронов.
Оси sp3-гибридных орбиталей направлены к вершинам правильного тетраэдра. Тетраэдрический угол между ними равен 109°28', что соответствует наименьшей энергии отталкивания электронов. Так же sp3-орбитали могут образовывать четыре σ-связи с другими атомами или заполняться неподеленными парами электронов.
[править]Гибридизация и геометрия молекул
Представления о гибридизации атомных орбиталей лежат в основе теории отталкивания электронных пар Гиллеспи-Найхолма. Каждому типу гибридизации соответствует строго определённая пространственная ориентация гибридных орбиталей центрального атома, что позволяет её использовать как основу стереохимических представлений в неорганической химии.
В таблице приведены примеры соответствия наиболее распространённых типов гибридизации и геометрической структуры молекул в предположении, что все гибридные орбитали участвуют в образовании химических связей (отсутствуют неподелённые электронные пары)[3].
Тип гибридизации |
Число гибридных орбиталей |
Геометрия |
Структура |
Примеры |
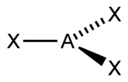
sp |
2 |
Линейная |
|
BeF2, CO2, NO2+ |
sp2 |
3 |
Треугольная |
|
BF3, NO3-, CO32- |
sp3 |
4 |
Тетраэдрическая |
|
CH4, ClO4-, SO42-, NH4+ |
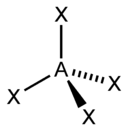
dsp2 |
4 |
Плоскоквадратная |
|
Ni(CO)4, XeF4 |
sp3d |
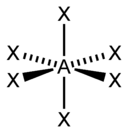
5 |
Гексаэдрическая |
|
PCl5, AsF5 |
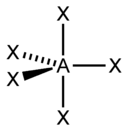
sp3d2 |
6 |
Октаэдрическая |
|
SF6, Fe(CN)63-, CoF63- |
|
|
|
|
|