
- •Классификация основных процессов химических технологий.
- •Гидродинамика.
- •Основное уравнение гидродинамики - уравнение неразрывности потока.
- •Теорема подобия. Гидродинамическое подобие.
- •Теорема о подобии(доказана Кирпичевым).
- •Расчет гидравлического сопротивления трубопровода.
- •- Критерий Грасгоффа
- •Перемещение жидкости.
- •Определение мощности насоса, работающего на всасывании и нагнетании.
- •Многоступенчатаое сжатие.
- •Гидродинамика псевдоразжиженного слоя(кипящего).
- •Зависимость перепада давления от скорости газа.
- •Процессы разделения неоднородных систем.
- •– Это зависимость экстримальная.
- •Теплопередача.
- •– Тепловой поток, – коэффициент теплопередачи, – площадь теплообменника, – разность температур
- •Закон Стефана – Больцмана.
- •Теплопередча за счет конвекции и теплопроводности.
- •Расчет коэффициента теплообмена.
- •Выпаривание.
- •Расчет температуры кипения раствора.
- •Многокорпусные выпарные установки.
- •Основы массопередачи.
- •Уравнение рабочей линии.
- •Материальный баланс :
- •Перенос компонентов жидкости и паре.
- •Теория Данхверста
- •Уравнение массообмена. Закон аддитивности фазовых сопротивлений.
- •Закон аддитивности фазового сопротивления.
Многокорпусные выпарные установки.
В установках соединяются несколько выпарных агрегатов, которые в зависимости от направления подачи греющего пара, а также исходного раствора, могут раелизовать прямоток, противоток или параллельное испарение. В многокорпусных установках вторичный пар с предидущего корпуса используется как греющий для последующего корпуса. Теплосодержание вторичного пара ниже, поэтому выпаривание в последующих корпусах идет при более мягких условиях.
При прямоточном соединении пар при наименьшем теплосодержанием контактирует с наиболее концетрированным раствором, поэтому кипение в этом корпусе происходит при пониженном давлении. В корпуса с наименьшье концентрированным раствором самый горячий греющий пар обеспечивает кипение раствора при повышенном давлении. Из - за этого сгущенный раствор может перетекать из корпуса в корпус самотеком под действием . Это первое преимущество прямотока.
При сгущении термически неустойчивых растворов жесткие условия испарения приводят к их разложению. При прямоточном подключении с повышением концентрации раствора условия испарения становятся мягче, что предотвращает разложение. Это второе приимущество.
П
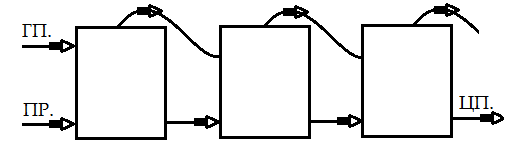 ри
противоточном подключении самый горячий
пар контактирует с самым концентрированным
раствором. Из – за этого достигается
очень высокая степень сгущения. Это
приимущество противотока.
ри
противоточном подключении самый горячий
пар контактирует с самым концентрированным
раствором. Из – за этого достигается
очень высокая степень сгущения. Это
приимущество противотока.
Однако, в последующем корпусе развивается самое высокое давление, поэтому сырье самотеком не идет и требуются перекачивающие насосы. НЕЛЬЗЯ СГУЩАТЬ РАСТВОРЫ ТЕРМОНЕСТОЙКИХ ВЕЩЕСТВ.
Установки с параллельным испарением используется для растворов, из которых в процессе выпаривания выпадают кристаллы вещества. Эти установки иеют собственное питание исходным раствором с собственным сливом продуктом, но греющий пар подсоединяется толлько к первому корпусу, на второй корпус подается вторичный пар в качестве греющего.
Основы массопередачи.
Технические процессы, скорость которых определяется переносом вещества из одной фазы в другую, называются массообменными процессами. Они протекают в массообменных аппаратах. Перенос вещества связан с изменением концетрации его в контактирующих фазах. Перенос может осуществляться из нескольких компонетов. Процесс применяется для разделения газообразных, жидких и твердых смесей. Если масообмен происходит между жидкость и газом, то это абсорбция. При этом жидкость – абсорбент. Если между твердым телом и газообразным – адсорбция. При этом твердое тело – адсорбент. Масообмен между жидкостью и жидкостью – экстракция. Жидкость, в которую переходит целевой продукт называется – экстрагент. Экстракция также быть также может быть при массобмене между твердым веществом и жидкостью, если твердое вещество не кристаллы этой жидкости и не кристаллы растворенного вещества. Если массообменный процесс происходит между жидкостью и кристаллами растворенного вещества, то это кристаллизация из раствора. Если массообменный процесс происходит между жидкостьб и ёё же кристаллами, то это кристаллизиция из расплава. Если массообмен происходит между жидкостью и ёё паром, то это дистиляция.
К массообменным процессам относится так же обмен оинами между солевым раствором и ионно - обменной смолой.
Процесс массообмена включает в себя несколько стадий :
Перенос вещества внутри фазы к границе раздела фаз
Переход вещества через границу раздела фаз
Перенос вещества от граници раздела фаз вглубь другой фазы
Перенос вещесвта внутри фазы осуществляется двумя способами :
Молекулярная диффузия
Конвективное перемещение
Поскольку самый медленный процесс – это молекулярная диффузия, то массообменные процессы в целом называют диффузионными процессами. Массообмен протекает до тех пор, пока между газами не установится термодинамическое равновесие. После его установления массообмен прекращается. Поэтому основной движущей силой процесса массообмена является отклонение составов контактирующих фаз от термодинамического равновесия :

 – химический потенциал.
– химический потенциал.
 отличие химического потенциала в
равновесном состоянии от неравновесного.
ϑ- скорость массопередачи.
отличие химического потенциала в
равновесном состоянии от неравновесного.
ϑ- скорость массопередачи.
Поскольку химический потенциал связан с концентрацией, то скорость массопередачи будет пропорциональна разности текущей и равновесной концентрации.

y- концентрация в жидкой фазе
x- концентрация в паровой фазе.
В противоточных массобменных аппаратах искуственно поддерживают отклонение от равновесия и этим обеспечивают непрерывность процесса массопередачи.
Способы выражения концентрации
Известны массовые доли, объемные доли, причем , объемная доля газов равна мольной доле. Для жидкости объемную долю называют градус крепости. В физической химии распространена мольная доля, которую обозначают x- для жидкой фазы и y-для паровой фазы. Мольная доля - отношение молей данного компонента к суммарному количеству молей всех компонентов смеси. В теории массобмена, помимо мольной доли, используют относительную мольную конценртацию и обозначаю как X и Y. Эта концентрация отражает отношение количества молей одного компонента к количеству молей другого компонента. Например, для 2-х компонентной системы: n1 и n2, тогда


Связь между
 и
и
 :
:





По
теореме Менделеева – Клапейрона
 ,
,

Равновесие между жидкостью и паром.
Пусть смесь состоит
из двух летучих компонентов с концентрацией
и
 ,
при равновесии в паре уде
,
при равновесии в паре уде
 и
и
 .
Будем считать, что смесь идеальная, т.е.
подчиняется закону Рауля во всем
диапазоне концентраций, тогда
.
Будем считать, что смесь идеальная, т.е.
подчиняется закону Рауля во всем
диапазоне концентраций, тогда








-
коэффициент разделения. Видно, что
для идеальных растворов
 по этому уравнению можно определить
значение коэффициента разделения
расчетным путем. При переходе к неидеальным
растворам вместо
по этому уравнению можно определить
значение коэффициента разделения
расчетным путем. При переходе к неидеальным
растворам вместо
 и
и
 используют фугитивность (
используют фугитивность ( );
); .
.

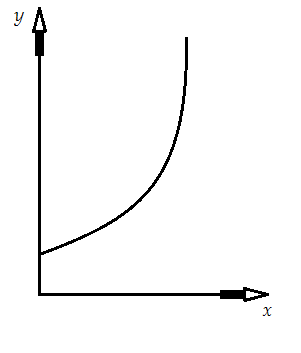


Уравнение показывает зависимость концентрации примеси в паре в зависимости от концентрации его в жидкости. Равновесные диаграммы – графическое представление этой зависимости. В массообменных аппаратах совмещают при расчете равновесную диаграмму с неравновесной, которую реализуют в технологическом аппарате. Отклонение между равновесной диаграммой и не равновесной показывает движущую силу процесса массопередачи. Для вычисления зависимости концентрации компонента в паре от концентрации его в жидкости, в реализуемом аппарате использую уравнение рабочей линии.
