
- •Г. М. Давидан, а. Г. Нелин, л. Н. Олейник, е. Д. Скутин общая химическая технология
- •Предисловие
- •Глава 1 общие понятия о химическом производстве
- •1.1. Химическая технология как наука
- •М акрокинетика
- •1.2. Связь химической технологии с другими науками
- •Химическая технология
- •1.3. История отечественной химической технологии
- •Контрольные вопросы
- •Глава 2 компоненты химического производства
- •2.1. Сырье в химическом производстве
- •Классификация химического сырья
- •2.2. Энергия в химической технологии
- •2.4. Воздух в химической технологии
- •Контрольные вопросы
- •Глава 3 критерии оценки эффективности химического производства
- •3.1. Технико-экономические показатели (тэп)
- •3.2. Структура экономики химического производства
- •Материальный и энергетический баланс химического производства
- •Контрольные вопросы
- •Глава 4 системный подход в изучении химико-технологического процесса
- •4.1. Общие понятия и определения
- •4.2. Химико-технологическая система как объект моделирования
- •4.3. Операторы
- •4.4. Матричное представление моделей
- •4.5. Подсистемы хтс
- •4.6. Связи
- •4.7. Классификация технологических схем
- •4.8. Системный подход к разработке технологии производства
- •4.9. Оптимизация производства
- •Контрольные вопросы
- •Глава 5 общие закономерности химических процессов
- •5.1. Понятие о химическом процессе
- •5.2. Классификация химических реакций
- •5.3. Интенсификация гомогенных процессов
- •5.4. Интенсификация гетерогенных процессов
- •5.5. Интенсификация процессов, основанных на необратимых реакциях
- •5.6. Интенсификация процессов, основанных на обратимых реакциях
- •Контрольные вопросы
- •Глава 6 гетерогенный катализ
- •6.1. Общие положения катализа
- •6.2. Процессы адсорбции и хемосорбции в гетерогенном катализе
- •6.3. Механизм гетерогенных каталитических процессов
- •6.4. Основные требования к гетерогенным катализаторам
- •6.5. Основные структурные параметры гетерогенных катализаторов
- •6.6. Технологические свойства гетерогенных катализаторов
- •6.7. Классификация гетерогенных катализаторов
- •6.8. Состав катализаторов
- •6.9. Приготовление катализаторов
- •Контрольные вопросы
- •Глава 7 гомогенный катализ
- •7.1. Кислотный (основной) катализ
- •7.2. Металлокомплексный катализ
- •7.3. Ферментативный катализ
- •Контрольные вопросы
- •Глава 8 химические реакторы
- •8.1. Принципы классификации химических реакторов
- •8.2. Принципы проектирования химических реакторов
- •8.3. Химические реакторы с идеальной структурой потока в изотермическом режиме
- •8.3.3. Примеры аналитического решения математической модели (8.22) и (8.23) для частных случаев
- •8.4. Сравнение эффективности проточных реакторов идеального смешения и идеального вытеснения
- •8.5. Конструкции реакторов
- •Контрольные вопросы
- •Глава 9 производство серной кислоты
- •9.1. Способы производства серной кислоты
- •9.2. Сырье процесса
- •9.3. Промышленные процессы получения серной кислоты
- •9.4. Пути совершенствования сернокислотного производства
- •Контрольные вопросы
- •Глава 10 производство аммиака
- •10.1. Проблема связанного азота
- •10.2. Получение азота и водорода для синтеза аммиака
- •10.3. Синтез аммиака
- •Контрольные вопросы
- •Глава 11 переработка нефти
- •11.1. Общие сведения о нефти
- •11.2. Классификация нефтей
- •11.3. Состав нефти
- •11.4. Нефтепродукты
- •11.5. Подготовка нефти на нефтепромыслах
- •11.6. Первичная переработка нефти
- •11.7. Пиролиз
- •11.8. Коксование
- •11.9. Каталитический крекинг
- •11.10. Каталитический риформинг
- •11.11. Гидроочистка
- •11.12. Производство нефтяных масел
- •Контрольные вопросы
- •Глава 12 переработка каменного угля
- •12.1. Показатели качества каменных углей
- •12.2. Классификация углей
- •12.3. Коксование каменных углей
- •Коксование
- •Тушение
- •Разгонка
- •12.4. Состав прямого коксового газа и его разделение
- •12.5. Переработка сырого бензола
- •12.6. Переработка каменноугольной смолы
- •12.7. Газификация твердого топлива. Процесс Фишера – Тропша
- •Контрольные вопросы
- •Глава 13 производство стирола
- •13.1. Получение этилбензола
- •13.2. Производство стирола дегидрированием этилбензола
- •13.3. Технологическая схема производства стирола дегидрированием этилбензола
- •Контрольные вопросы
- •Глава 14 производство этанола
- •Контрольные вопросы
- •Библиографический список
- •Содержание
- •Глава 12. Переработка каменного угля 231
- •Глава 13. Производство стирола 246
- •Глава 14. Производство этанола 252
10.3. Синтез аммиака
Обратимая реакция синтеза аммиака идет с выделением тепла и двойным уменьшением объема:
N 2 + 3H2 2NH3 – Н. (10.18)
В реальных условиях процесса (Т = 500 оС, Р = 30 МПа)
Н = –55,8 кДж/моль.
Константа равновесия этой реакции
Кр/
=
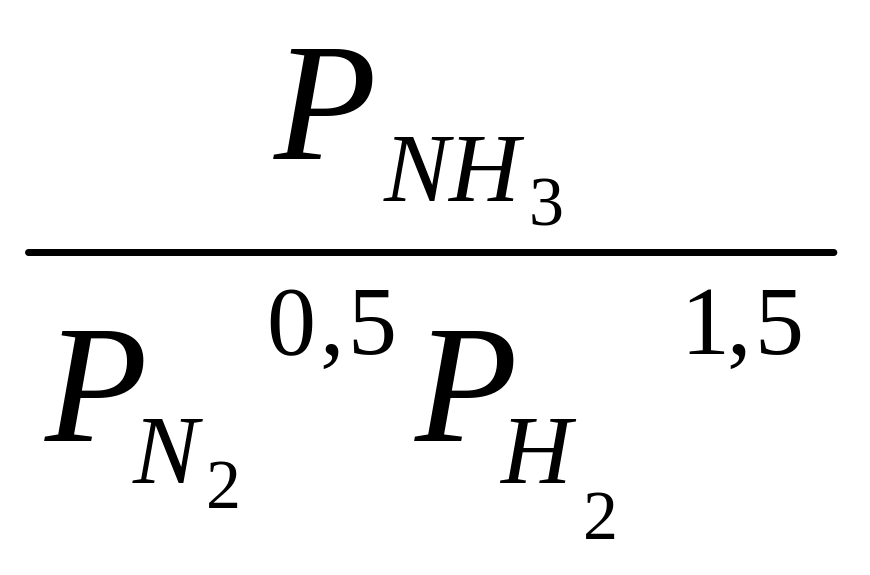 .
(10.19)
.
(10.19)
Зависимость константы равновесия от температуры описывается следующим эмпирическим уравнением:
lg(1/Kp)
= –
![]() + 2,4943lgT
+
+ 2,4943lgT
+
![]() T
– 1,8564 · 10–7
·
T2
– J.
(10.20)
T
– 1,8564 · 10–7
·
T2
– J.
(10.20)
Коэффициенты и J в этом уравнении зависят от давления и возрастают с его повышением (табл. 10.1).
Таблица 10.1
Зависимость коэффициентов и J от давления
Давление, МПа |
104 |
J |
10 |
1,256 |
2,113 |
30 |
1,256 |
2,206 |
60 |
10,856 |
3,059 |
100 |
26,833 |
4,473 |
Доля аммиака в равновесной газовой смеси возрастает с ростом давления и понижением температуры (табл. 10.2).
Таблица 10.2
Зависимость доли аммиака в газовой смеси от параметров процесса
Температура, оС |
Доля аммиака в газовой смеси, % об. |
|
при 30 МПа |
при 100 МПа |
|
200 |
89,9 |
98,3 |
300 |
71,0 |
92,5 |
400 |
47,0 |
79,8 |
500 |
26,4 |
57,5 |
600 |
13,3 |
31,4 |
700 |
7,3 |
12,8 |
Из таблицы 10.2 следует, что даже при 100 МПа достаточно высокий выход NH3 может быть достигнут при температуре менее 400 оС. Но при этой температуре мала скорость процесса и велико время достижения равновесия.
Промышленный синтез аммиака удалось осуществить при температуре 450–500 оС и высоком давлении с участием катализаторов и цикличностью процесса. Эта реакция катализируется металлами Fe, W, Re, Rh, Os, Pt, U.
Наиболее активны Os и U, но они очень дороги и высокочувствительны к ядам. Кроме того, уран радиоактивен. В российской азотной промышленности применяют катализатор ГИАП (Государственный институт азотной промышленности) состава [Fe + Al2O3 + K2O + CaO + SiO2]. В этой каталитической системе железо является главным компонентом композиции, оксид алюминия и диоксид кремния имеют функцию носителей-промоторов, оксиды калия и кальция – только промоторов.
К атализатор готовят плавлением в кислородной среде смеси оксидов Fe3O4, K2O, CaO и SiO2 с последующим восстановлением водородом или азотоводородной смесью магнетита (Fe3O4) до металла. Промоторы создают высокоразвитую поверхность катализатора, препятствуют его рекристаллизации и повышают активность основного компонента катализатора – железа. Железный катализатор быстро и необратимо отравляется сернистыми соединениями, образуя сульфиды. СО и СО2 отравляют железо обратимо, т.е. его можно в этом случае восстановить.
Более поздняя композиция (ГИАП-16) имеет следующий состав, % масс.: NiO – 25; Al2O3 – 57; СаО – 10; MgO – 8.
Процесс синтеза аммиака включает следующие стадии:
– диффузию Н2 и N2 к поверхности катализатора;
– проникновение Н2 и N2 в поры катализатора;
– активированную адсорбцию (химическую) Н2 и N2 поверхностью катализатора;
– химическую реакцию с последовательным образованием имида NH=, амида NH2 – и, наконец, аммиака NH3;
– десорбцию NH3 из пор катализатора к поверхности;
– десорбцию NH3 с поверхности катализатора в реакционный объем;
– удаление NH3 из реакционной зоны.
Лимитирующей стадией синтеза аммиака на железном катализаторе является третья стадия – активированная адсорбция азота поверхностью катализатора. Скорость реакции описывается уравнением Темкина – Пыжова:
U
= U1
– U2
=
![]() =
=
 ,
(10.20)
,
(10.20)
где k1,
k2
– константы скорости прямой и обратной
реакций, соответственно; рN![]() ;
pH
;
pNH
– парциальные
давления азота, водорода и аммиака
соответственно;
– коэффициент, зависящий от давления;
– для железного катализатора равен
0,5.
;
pH
;
pNH
– парциальные
давления азота, водорода и аммиака
соответственно;
– коэффициент, зависящий от давления;
– для железного катализатора равен
0,5.
Энергия активации прямой реакции равна в условиях процесса 170 кДж/моль.
При температурах 400–500 оС максимальная степень превращения в процессе составляет 20 %, а обычно – 14–17 %. Поэтому синтез аммиака реа-лизован по циклической схеме, по которой непревращенное сырье рециркулируют в исходное. Благодаря этому приему, почти отсутствуют вредные выбросы в атмосферу.
Исследования по оптимизации параметров технологического процесса синтеза аммиака позволили установить следующие их значения:
температура – 450–550 оС;
давление – 30–32 МПа;
объемная скорость подачи сырья – (3–4) · 104 м3/(м3·ч);
объемный
состав азотоводородной смеси –
стехиометрический (V![]() :V
:V![]() = = 1:3).
= = 1:3).
Технологическая схема процесса представлена на рисунке 10.2.
 циркуляционный
газ NH3 (газ)
циркуляционный
газ NH3 (газ)
АВС


 8 3
8 3










 6
6
 2 5
2 5
1
п ар вода


 4 4 NH3 (ж.)
4 4 NH3 (ж.)

7
Рис. 10.2. Технологическая схема процесса синтеза аммиака
На рисунке 10.2 обозначено: 1 – колонна синтеза; 2 – холодильник-конденсатор; 3 – смеситель (инжектор) свежей АВС и циркуляционной смеси; 4 – конденсационная колонна; 5 – газоотделитель; 6 – испаритель жидкого аммиака; 7 – теплообменник (котел-утилизатор); 8 – турбокомпрессор.
Процесс синтеза аммиака осуществляется следующим образом.
Циркуляционный газ турбокомпрессором 8 подается на смешение со свежей азотоводородной смесью в смеситель 3 и далее в конденсационную колонну 4, где из циркуляционного газа конденсируется часть аммиака, а остальное количество рециркулирует в реактор-колонну 1. Выходящий из колонны газ, содержащий до 20 % аммиака, направляется в водяной холодиль-ник-конденсатор 2, а затем в газоотделитель 5, где из него выделяют жидкий аммиак. Несконденсированный газ компримируют турбокомпрессором 8, смешивают со свежей азотоводородной смесью и направляют в конденсационную колонну 4, а затем в испаритель жидкого аммиака 6, где при температуре -20 оС также конденсируется большая часть аммиака.
Промышленность выпускает аммиак первого сорта с концентрацией NH3 99,9 %, второго сорта с концентрацией 99,6 % и аммиачную воду с долей NH3 25 %. Аммиак первого сорта используют в качестве хладоагента в холодильных агрегатах и удобрений, второго сорта – в производстве азотной кислоты.
