
- •Строение атома
- •Квантовые постулаты нильса бора
- •Методы наблюдения и регистрации элементарных частиц
- •Естественная радиоактивность
- •Виды радиоактивного распада
- •Закон радиоактивного распада
- •Ядерные силы
- •Энергия связи атомных ядер
- •1. Расчет дефекта масс
- •Ядерные реакции
- •Ядерная реакция на нейтронах
- •Искусственные превращения ядер
- •Деление ядер урана
- •Цепная ядерная реакция
- •Ядерный реактор
- •Атомная бомба
- •Термоядерная реакция ( иначе термоядерный синтез)
- •Термоядерная бомба
Закон радиоактивного распада
Используя закон радиоактивного распада, можно определить число нераспавшихся атомов какого-то количества радиоактивного вещества в любой момент времени:
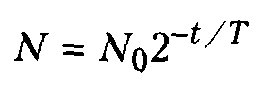
![]()
Время, за которое распадается половина первоначального числа радиоактивных ядер, называется периодом полураспада (Т). Чем меньше период полураспада, тем меньше живут атомы, тем быстрее происходит распад. Для разных химических элементов величина периода полураспада различна : от миллионных долей секунд (например, полоний)до миллиардов лет (например, уран).
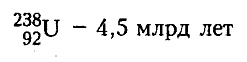 ......
......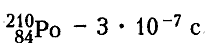 Период
полураспада - это постоянная величина
для данного химического элемента, и ее
невозможно изменить.
Период полураспада
определяет скорость радиоактивного
распада.
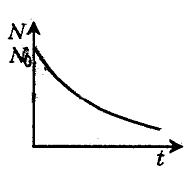
Число не распавшихся
радиоактивных ядер убывает со временем
по экспоненте.
Период
полураспада - это постоянная величина
для данного химического элемента, и ее
невозможно изменить.
Период полураспада
определяет скорость радиоактивного
распада.
Число не распавшихся
радиоактивных ядер убывает со временем
по экспоненте.
 За
любой интервал времени распадается
одна и та же доля имеющихся атомов, т.е
с течением времени скорость распада не
меняется.
За
любой интервал времени распадается
одна и та же доля имеющихся атомов, т.е
с течением времени скорость распада не
меняется.
Радиоактивные атомы "не стареют". Распад любого атомного ядра - это "несчастный случай". Время существования отдельных атомов может колебаться от долей секунды до миллиардов лет вне зависимости от времени периода полураспада. Для радиоактивных ядер принято определять среднее время жизни.
Закон радиоактивного распада – статистический закон и справедлив в среднем для большого числа частиц.
Ядерные силы
В
состав ядра входят протоны и нейтроны.
Между одинаково заряженные протонами
действуют электростатические силы
отталкивания, однако ядро не "разлетается"
на отдельные частицы. Между протонами
и нейтронами внутри ядра действуют
ядерные силы - силы притяжения, намного
превосходящие электростатические.
Ядерные силы по величине в 100 раз
превосходят электростатические и
называются сильным взаимодействием.
Ядерные
силы проявляются лишь на расстояниях
внутри ядра, поэтому считаются
короткодействующими, в то время как
электростатические силы -
дальнодействующими.
Энергия
взаимодействия нуклонов велика; она
называется внутриядерной, или ядерной.
Протоны и нейтроны, входящие в состав
любого ядра, не являются неделимыми
элементарными частицами, а состоят из
кварков.
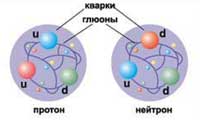 Кварки,
в свою очередь, взаимодействуют друг с
другом, непрерывно обмениваясь глюонами
- переносчиками истинно сильного
взаимодействия (оно в тысяче раз сильнее
того, которое действует между протонами
и нейтронами в ядре). В результате протоны
и нейтроны оказываются очень сильно
связанными системами, которые невозможно
разбить на составные части.
Кварки,
в свою очередь, взаимодействуют друг с
другом, непрерывно обмениваясь глюонами
- переносчиками истинно сильного
взаимодействия (оно в тысяче раз сильнее
того, которое действует между протонами
и нейтронами в ядре). В результате протоны
и нейтроны оказываются очень сильно
связанными системами, которые невозможно
разбить на составные части.
СТРОЕНИЕ ЯДРА АТОМА
В
1932г. после открытия протона и нейтрона
учеными Д.Д. Иваненко (СССР) и В. Гейзенберг
(Германия) была выдвинута
протонно-нейтронная модель ядра
атома.
 Согласно
этой модели:
- ядра
всех химических элементов состоят из
нуклонов:
протонов и нейтронов
- заряд ядра
обусловлен только протонами
- число
протонов в ядре равно порядковому номеру
элемента
- число нейтронов равно
разности между массовым числом и числом
протонов (N=A-Z)
Условное
обозначение ядра атома
химического элемента:
Согласно
этой модели:
- ядра
всех химических элементов состоят из
нуклонов:
протонов и нейтронов
- заряд ядра
обусловлен только протонами
- число
протонов в ядре равно порядковому номеру
элемента
- число нейтронов равно
разности между массовым числом и числом
протонов (N=A-Z)
Условное
обозначение ядра атома
химического элемента:
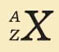 X
– символ химического элемента
А
– массовое
число, которое
показывает :
- массу ядра в целых
атомных единицах массы (а.е.м.)
(1а.е.м. = 1/12 массы атома углерода)
-
число нуклонов в ядре
- (A = N + Z)
, где N – число нейтронов в ядре атома
Z
– зарядовое
число, которое
показывает:
- заряд ядра в элементарных
электрических зарядах (э.э.з.)
( 1э.э.з.
= заряду электрона = 1,6 х 10 -19 Кл)
- число
протонов
- число электронов в атоме
-
порядковый номер в таблице Менделеева
Масса
ядра всегда
меньше суммы
масс покоя свободных протонов и нейтронов,
его составляющих.
Это объясняется
тем, что протоны и нейтроны в ядре очень
сильно притягиваются друг к другу. Чтобы
разъединить их требуется затратить
большую работу. Поэтому полная энергия
покоя ядра не равна энергии покоя
составляющих его частиц. Она меньше на
величину работы по преодолению ядерных
сил притяжения.
Разность между массой
ядра и суммой масс протонов и нейтронов
называется дефектом
масс.
X
– символ химического элемента
А
– массовое
число, которое
показывает :
- массу ядра в целых
атомных единицах массы (а.е.м.)
(1а.е.м. = 1/12 массы атома углерода)
-
число нуклонов в ядре
- (A = N + Z)
, где N – число нейтронов в ядре атома
Z
– зарядовое
число, которое
показывает:
- заряд ядра в элементарных
электрических зарядах (э.э.з.)
( 1э.э.з.
= заряду электрона = 1,6 х 10 -19 Кл)
- число
протонов
- число электронов в атоме
-
порядковый номер в таблице Менделеева
Масса
ядра всегда
меньше суммы
масс покоя свободных протонов и нейтронов,
его составляющих.
Это объясняется
тем, что протоны и нейтроны в ядре очень
сильно притягиваются друг к другу. Чтобы
разъединить их требуется затратить
большую работу. Поэтому полная энергия
покоя ядра не равна энергии покоя
составляющих его частиц. Она меньше на
величину работы по преодолению ядерных
сил притяжения.
Разность между массой
ядра и суммой масс протонов и нейтронов
называется дефектом
масс.
ИЗОТОПЫ
В природе встречаются атомные ядра одного и того же химического элемента с одинаковыми зарядами (число Z), но с различными массовыми числами (число А). Английский ученый Ф.Содди предложил назвать такие ядра изотопами. Все изотопы одного и того же химического элемента стоят в одной клетке таблицы Менделеева. Так как заряды ядра изотопов одного химического элемента одинаковы, они имеют одинаковое строение электронных оболочек, и следовательно, обладают одинаковыми химическими свойствами. Из-за разного числа нейтронов ядра различных изотопов одного и того же химического элемента обладают разными массами и могут отличаться по физическим свойствам, например, по способности к радиоактивному распаду. Изотопы могут быть не только у радиоактивных веществ. Исследования показали, что изотопы имеются у всех химических элементов. Так у кислорода - 3 стабильных изотопа, у свинца - 10, у урана - 8 (и все они нестабильны). В природе изотопы перемешаны: например, в 1 г вещества могут присутствовать одновременно атомы этого элемента с разной массой ядра, т.е. различные изотопы. У изотопов массовые числа представляют собой целые числа. А в таблице Менделеева массовое число химического элемента является дробным, т.к. это среднеарифметическое значение массовых чисел всех изотопов данного химического элемента.
