
Лекция № 4 Методы спектрального анализа
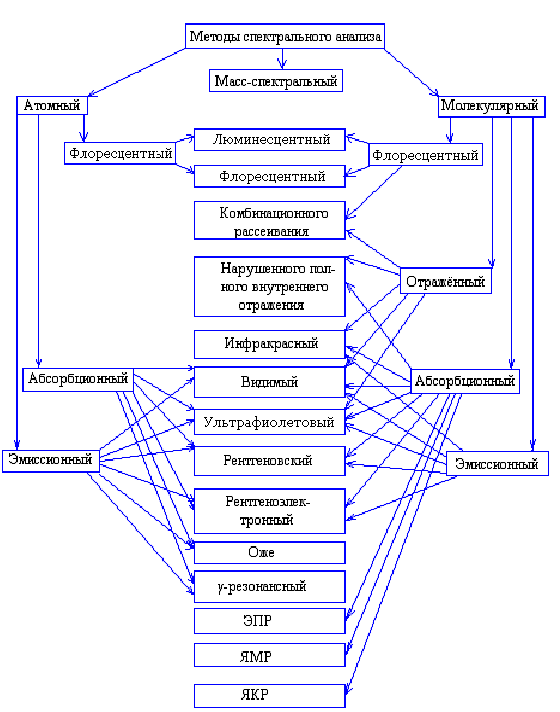
Основы методов спектрального анализа и их классификация
Спектральные методы анализа –это совокупность методов определения состава вещества, основанные на исследовании их спектров испускания, поглощения, отражения и люминесценции.
Атомный спектральный анализ определяет элементарный состав вещества по атомным спектрам испускания и поглощения электромагнитного излучения.
Молекулярный спектральный анализ показывает состав вещества на молекулярном уровне по молекулярным спектрам поглощения, люминесценции и комбинационного рассеяния.
Абсорбционный спектральный анализ позволяет изучать состав веществ по молекулярным или атомным спектрам, возникающим в результате электронных переходов за счёт поглощения квантов электромагнитного излучения источника.
Эмиссионный спектральный анализ позволяет изучить состав вещества по спектрам испускания атомов, ионов и молекул, возбуждаемым источниками электромагнитного излучения.
2. Классификация оптических методов анализа
Суть метода основывается на взаимодействии вещества со средой, а в качестве среды имеют электромагнитные волны оптического диапазона. В результате взаимодействия происходит изменение свойств веществ, вступивших в реакцию.
Применяется два общих способа измерения:
1) На глаз
2) Инструментальный метод
Электромагнитное излучение |
Ультрофиолетовый |
Визуальный (видимый) |
Инфракрасный |
λ=100 - 100000нм |
100 - 360 |
380 - 760 |
760 - 100000 |
Все оптические методы используют специальные приборы
источник излучения;
фокусирующее устройство;
селектор (преобразователь)
кювета с изучаемым веществом;
детектор излучения (глаз, фотоэлемент, фотоэлектронный умножитель);
блок усиления сигнала;
регистрирующий или показывающий прибор (самописец).
Источники излучения:
пламя горелки;
вольтова дуга;
лампа накаливания(320-10000);
натриевые лампы (λ=585 нм);
водородные и дейтеривые лампы (180-320);
для тепловых волн используются глобары – спрессованный карбид кремния SiС (от 1 мкм и выше);
для диапазона ультрафиолетового используются ртутно-кварцевые лампы (200-500 нм).
Регистратор и анализатор
микроамперметр
вольтметр
самописцы
компьютеры с анализаторами
Характеристика чувствительности.
- при фотометрии 1·10-6 г
- при флюрометрии 1·10-10г
- при полярографии 1·10-8 г
- при эмиссионном спектральном анализе 1·10-10г.
3 Молекулярно-абсорбционные методы
Молекулярно-абсорбционные методы основаны на измерении поглощения молекулами (или ионами) веществ электромагнитного излучения оптического диапазона.
В зависимости от области оптического диапазона, способа измерений, ширины полосы измеряемого излучения различают следующие молекулярно-абсорбционные методы:
колориметрию – сравнение окраски анализируемого и стандартного раствора вещества визуальным способом; фотоколориметрию – измерение интенсивности светового потока, прошедшего через раствор вещества (или вещества в твердой или газовой фазе) фотоэлектрическим способом; спектрофотометрию – измерение интенсивности монохроматического (определенной длины волны) светового потока, прошедшего через раствор вещества, фотоэлектрическими способами. В зависимости от длины волны различают спектрофотометрию в ультрафиолетовой (УФ), видимой (В) и инфракрасной (ИК) области спектра.
Суть этих методов:
Любое вещество способно поглощать электромагнитное излучение определенной длины волны в одной из областей спектра. Растворы веществ, поглощающих в одном из участков видимой области спектра, окрашены. Длина волны поглощаемого цвета у различных веществ отличается и зависит от их структуры. Это создает дополнительные возможности для их обнаружения.
Второй важной характеристикой растворов
цветных веществ является количество
поглощённого светового излучения,
которое зависит от количества вещества
в растворе. Если, например, каждая
молекула вещества поглощает квант
света, очевидно, количество поглощенных
квантов зависит от количества молекул.
Поглощенное световое излучение оценивают
относительной величиной – поглощением
А (оптической плотностью), представляющем
собой логарифм отношения интенсивностей
световых потоков входящего
![]() в кювету с раствором вещества и выходящего
в кювету с раствором вещества и выходящего
![]() из нее. Употребляют и другую величину
– пропускание, или фактор пропускания,
из нее. Употребляют и другую величину
– пропускание, или фактор пропускания,
![]() :
:
![]()
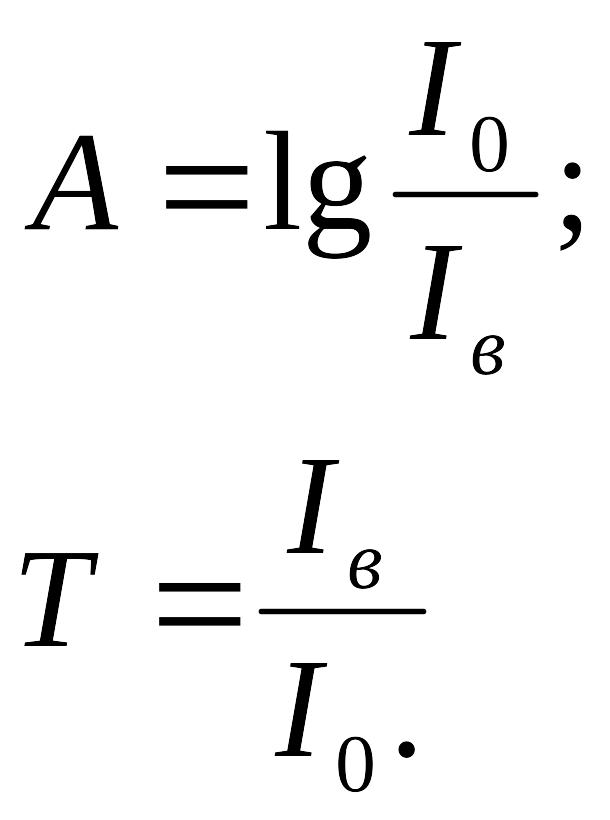
П. Бугер (1729) и И. Ламберт (1760) установили
взаимосвязь поглощения с толщиной слоя
раствора. А. Бер (1852) выявил зависимость
поглощения от концентрации вещества.
Указанные зависимости легли в основу
закона светопоглощения, названного
законом Бугера-Ламберта-Бера *, –
интенсивность поглощения света
растворами вещества пропорциональна
их концентрации
![]() и толщине поглощающего слоя
и толщине поглощающего слоя
![]() .
Или «Растворы одного и того же окрашенного
вещества при одинаковой концентрации
вещества и толщине слоя раствора
поглощают равное количество световой
энергии (светопоглощение таких растворов
одинаковое)».
.
Или «Растворы одного и того же окрашенного
вещества при одинаковой концентрации
вещества и толщине слоя раствора
поглощают равное количество световой
энергии (светопоглощение таких растворов
одинаковое)».
![]() (2)
(2)
I – интенсивность света
I0 – интенсивность исходного источника
ε – коэффициент поглощения
l – толщина слоя раствора
c – концентрация вещества
Удобнее выражать этот закон в таком виде:
![]() ,
,
где A (D) – оптическая плотность раствора.
Коэффициент пропорциональности k
представляет собой поглощение
раствора при его концентрации и толщине,
равных единице, и является характерным
для вещества. Если концентрация
раствора выражена в моль/дм3, то
k – показатель поглощения
раствора, содержащего 1 моль/дм3
вещества, при толщине слоя, равной 1 см.
В этом случае показатель поглощения
называют молярным поглощением или
молярным показателем поглощения и
обозначают
![]() .
При обозначении концентрации раствора
в процентах поглощение раствора
называют удельным поглощением или
удельным показателем поглощения
.
При обозначении концентрации раствора
в процентах поглощение раствора
называют удельным поглощением или
удельным показателем поглощения
![]() .
.
Закон Бугера-Ламберта-Бера справедлив только для строго монохроматического излучения. При графическом выражении зависимость поглощения от концентрации (при прочих постоянных условиях) имеет вид прямой линии, выходящей из начала осей координат. В аналитической практике при проведении фотометрических измерений необходимо проверять соблюдение закона Бугера-Ламберта-Бера. Если закон Бугера-Ламберта-Бера соблюдается, то графическое изображение зависимости поглощения от концентрации имеет вид прямой линии. В случае отклонений прямолинейная зависимость искажается. Закон Бугера-Ламберта-Бера может не соблюдаться в следующих случаях:
1. При сдвигах химического равновесия в системе под влиянием температуры, ионной силы, рН и др. Сдвиги химического равновесия вызывают соответствующее изменение концентрации поглощающей формы вещества. Наиболее частой причиной сдвигов химического равновесия является увеличение разрушения малоустойчивых комплексов при разбавлении растворов.
2. При использовании полихроматического излучения (в фотоколориметре), так как закон Бугера-Ламберта-Бера справедлив только для строго монохроматического излучения. Поэтому закон Бугера-Ламберта-Бера в основном используют при расчетах в спектрофотометрическом анализе, где фотометрирование проводится в монохроматическом свете.
3. При изменении показателя преломления поглощаемой среды. Показатель преломления меняется при значительных изменениях концентрации определяемого компонента. Это явление наблюдается в случае фотометрических определений концентрированных растворов веществ, имеющих малое молярное поглощение.
4. Вследствие появления приборной ошибки, чаще всего вызываемой нелинейностью зависимости тока фотоэлементов от интенсивности светового потока при малых (менее 0,1) и очень больших (больше 1,5) значениях поглощения раствора.
При проверке подчиненности закону Бугера-Ламберта-Бера выбирают диапазон концентраций определяемого вещества, в котором зависимость поглощение — концентрация носит линейный характер.
Фотометрическому определению подвергают вещества, которые обладают функциональными группами, поглощающими в той или иной области спектра. Если же вещества не имеют хромофорных групп, то в этом случае проводят химическую реакцию, в результате которой получают окрашенный продукт, подвергающийся фотометрическому определению. Такие реакции называют фотометрическими. Если продукт реакции растворим в воде, фотометрируют водные растворы. В случае хорошей растворимости в воде (и для целей очистки от примесей) применяют экстракционно-фотометрический анализ. Определяемое вещество или его комплекс экстрагируют подходящим органическим растворителем и затем полученный раствор фотометрируют.
