
- •Специфика органической химии
- •Теория гибридизации
- •Типы гибридных орбиталей
- •Первое валентное состояние атома углерода Гибридизация sp3
- •Мезомерный эффект (эффект сопряжения) [±m]
- •Понятие сопряжения
- •Эффекты сопряжения
- •Правило Морковникова
- •Донорно-акцепторные связи. Семиполярные связи
- •Водородная связь
- •Названия ненасыщенных и ароматических углеводородов
- •Номенклатура гетероциклических соединений
- •Номенклатура июпак для производных различных классов органических соединений
- •Изомерия органических соединений
- •Структурная изомерия
- •Изомерия положения
- •Геометрическая изомерия (зеркальная, цис- транс- изомерия)
- •Оптическая изомерия
- •Устройство поляриметра
- •Диастереомеры
- •Номенклатура стереоизомеров
- •Номенклатура Кана, Ингольда, Прелога (кип)
- •Номенклатура стереоизомеров Потапова в.М., Терентьева а.П. И сотрудников
- •2(Ρ),3-диоксипропаналь
- •3(Ρ),4-дихлорпентен-4-аль
- •Классификация органических реакций и реагентов
- •По способу разрыва (образования) химических связей.
- •Классификация реакций по типу превращений в органических веществах
- •Свободные радикалы
- •Понятие о граничных структурах
- •Алканы (парафины)
- •Физические свойства
- •Промышленная переработка алканов (нефти)
- •Некоторые лабораторные способы получения алканов
- •Нитрование алканов
- •Строение малых циклов (циклопропан, циклобутан)
- •Некоторые закономерности реакции отщепления
- •Дегидратация спиртов (отщепление воды)
- •Дегалогенирование дигалогенпроизводных
- •Восстановление алкинов (ацетиленов)
- •Расщепление четвертичных аммонийных солей по Гофману
- •Присоединение галогенов
- •Строение диенов
- •Химические свойства диенов
- •Реакции присоединения
- •Механизм реакции [ae] для сопряженных диенов
- •Некоторые аспекты применения сопряженных диенов
- •Алкины (ацетилены)
- •Способы получения ацетилена
- •Некоторые способы получения гомологов ацетилена
- •Общая характеристика реакционной способности ацетиленов
- •Физические свойства ацетилена
- •Химические свойства
- •Реакции присоединения
- •Реакции нуклеофильного присоединения к ацетиленам
- •Некоторые свойства виниловых эфиров
- •Ароматические углеводороды
- •Признаки ароматичности
- •Направление реакций ароматических соединений
- •II стадия:
- •Мнемоническое правилосмещения электронной плотности под действием заместителя в ядре
- •Нуклеофильное замещение в ароматических системах (snAr)
- •Механизм реакции snAr
- •Галогенпроизводные углеводородов
- •Методы получения галогенпроизводных
- •Замещение водорода на галоген в условиях радикальных процессов (прямое галогенирование алканов)
- •Галогенирование непредельных углеводородов
- •Получение галогенпроизводных из непредельных углеводородов
- •Общая характеристика реакционной способности галогенпроизводных
- •Важнейшие реакции галогенпроизводных
- •Образование металлорганических соединений
- •Содержание
Специфика органической химии
Органическая химиячасть общей химии, тесно связанная с неорганической, физической и биологической химией общими квантово-механическими представлениями о строении молекул, закономерностями протекания реакций и природой химических соединений.
База органической химии гибридные формы атома углерода, на основе которых построены многочисленные классы органических веществ.
Специфика углеводородов и их производных заключена в своеобразных свойствах атома углерода, в его элементарной структуре. Углерод расположен в 4 группе периодической системы, и в возбужденном состоянии вступает в химические взаимодействия, не имея ни свободных электронов, ни вакантных низкоэнергетических орбиталей, поэтому в соединениях углерода (4-х валентных) возникает стабильное электронное состояние, без свободного химического сродства, с высокой прочностью ковалентных связей. Эти особенности гибридизованного углерода отражают возможность образования длинных углерод-углеродных цепей, и заложены в явлении изомерии. Атом углерода в отличие от многих других атомов способен к образованию π-связей различного характера:
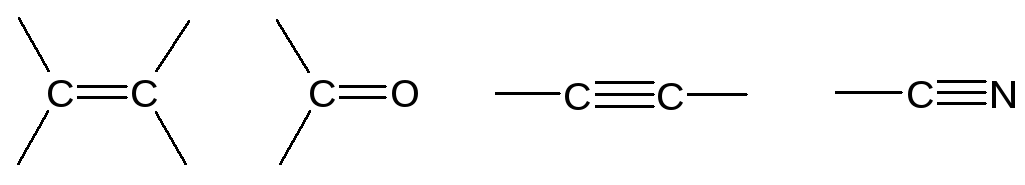
Углероды, соединенные кратными (двойными или тройными) связями обладают более высокой реакционной способностью, чем алканы или циклоалканы (насыщенные углеводороды).
Неразрывная связь органической химии с неорганической проявляется у функциональных производных углеводородов СnHmФp, где Ффункция: любой атом периодической системы(кроме С и Н) или любая группировка органической, неорганической природы –COOH,SO2OH,Hal,Me, С=О и т.д.
Теория гибридизации
Типы гибридных орбиталей
С +6 1s22s22p2
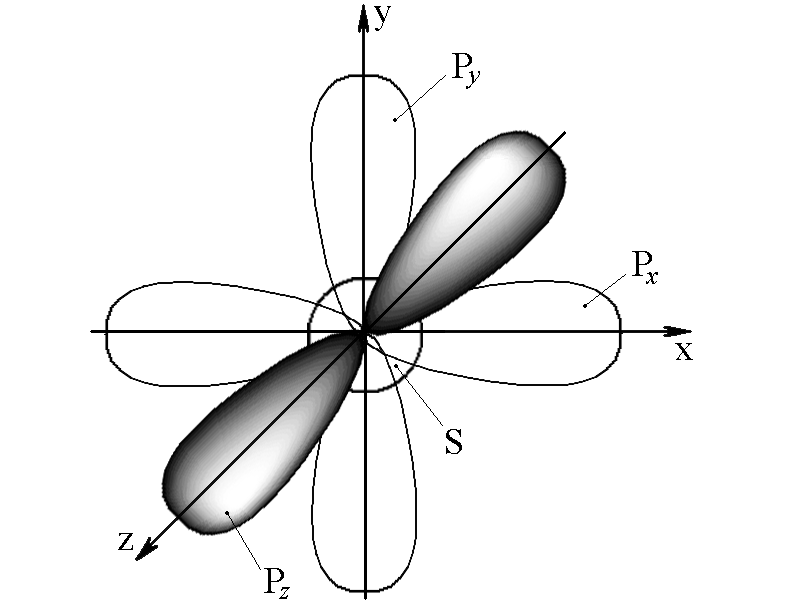
Исходя из электронной структуры возбужденного атома, можно предположить, что метан CH4имеет три сигма-связи (σ-связи), образованныеp-орбиталями и одну, образованнуюs-орбиталью, следовательно, орбитали не должны быть равноценны по энергии.
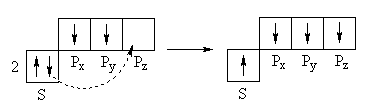
На самом деле, как показали исследования, молекула CH4имеет 4 равноценные σ-связи. Это можно объяснить выравниванием энергии всех орбиталей атома С, т.е. смешением и перераспределением их энергий в процессе образования связей. Таким образом, суть гибридизациив смешении орбиталей.
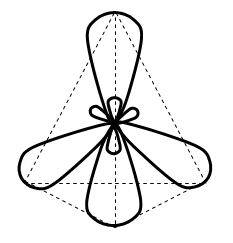
Первое валентное состояние атома углерода Гибридизация sp3
1s+PX+PY+PZ→ 4sp3
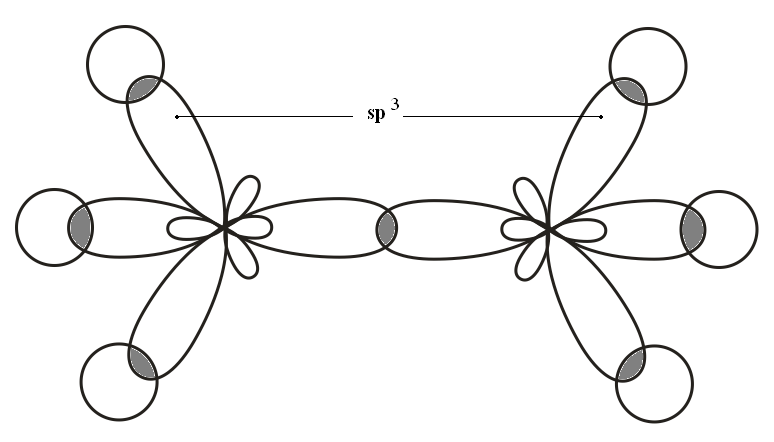 Молекула
этана (C2H6)
Молекула
этана (C2H6)
Второе валентное состояние атома углерода Гибридидизация sp2
1s + PX + PY + PZ → 3sp2 + PZ
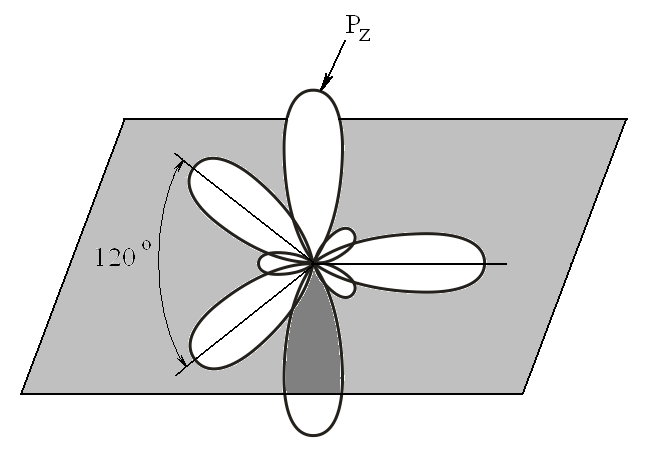

π-связь, боковое перекрывание
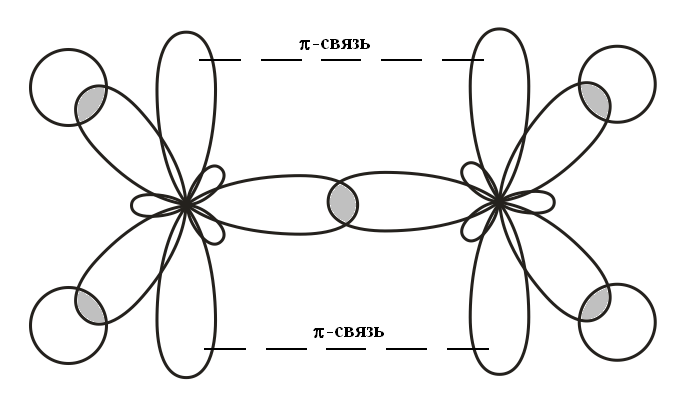 Молекула
этилена (C2H4)
Молекула
этилена (C2H4)
Третье валентное состояние атома углерода Гибридизация sp
1s + PX + PY + PZ → 2sp + PY + PZ
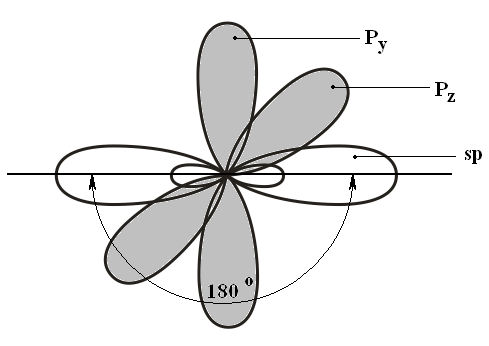
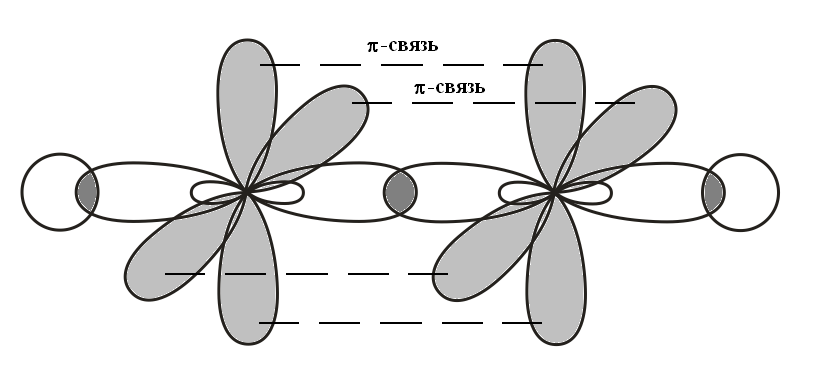 Молекула
ацетилена (Н–С≡С–Н)
Молекула
ацетилена (Н–С≡С–Н)

Структурная формула (бутен-2-аль)
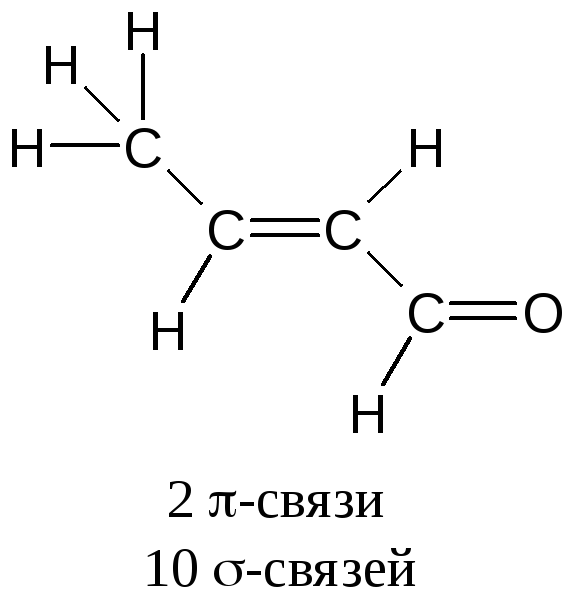
Типы связей в органической химии
Подавляющее большинство связей органических соединений построены ковалентно с обобществлением пары электронов.
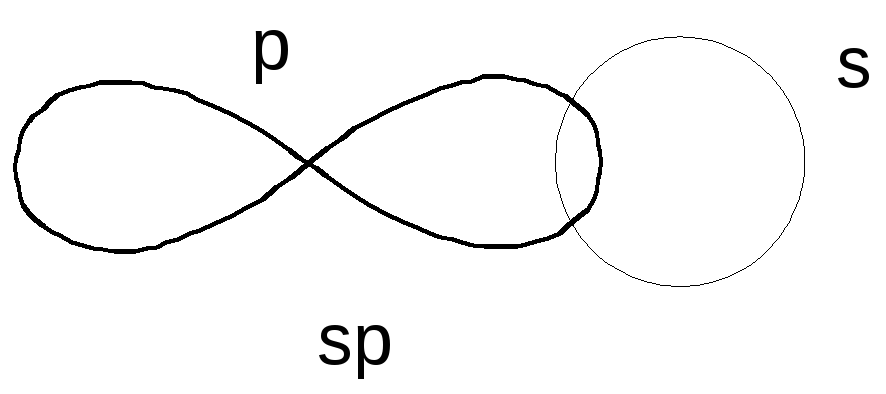
p s s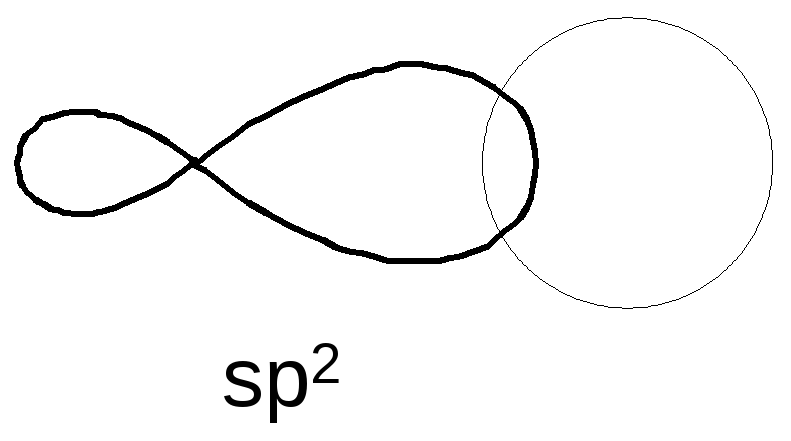
Ковалентные связи
В солях органических кислот и спиртов связи О-металл имеют ионный характер:
![]()
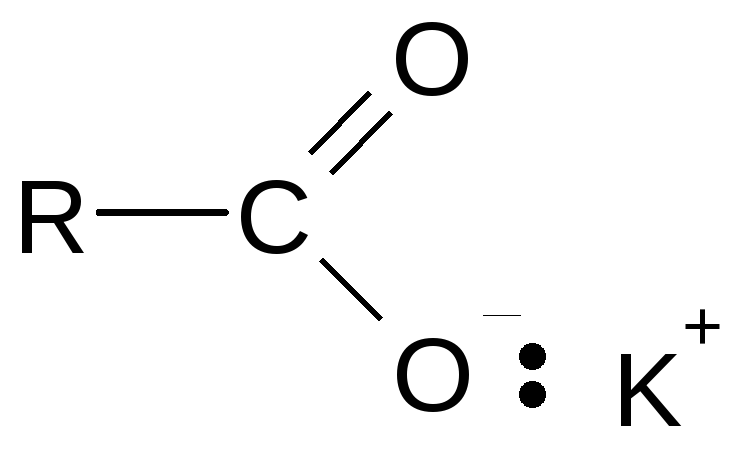
В то же время ковалентная связь при углероде зачастую имеет полярный характер.
Например,

Смещение электронной плотности по ковалентным связям характеризуется двумя основными параметрами:
индукционный (индуктивный) эффект [±I];
мезомерный эффект (эффект сопряжения) [±M].
Все электронные эффекты рассматриваются относительно малополярной связи
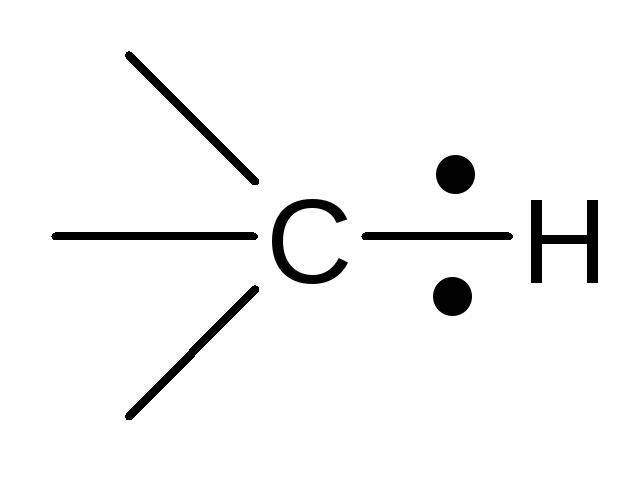
Индукционный эффект (σ-эффект) [I]
Направлен к более электроотрицательному атому на σ-связи, например:
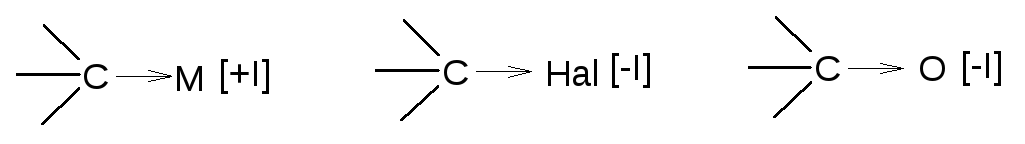
Все электронные эффекты рассматриваются,как правило, относительно атома углерода. Если атом или группа атомов подают электронную плотность, то эффект считается положительным или донорным [+I], если наоборот, то отрицательным или акцепторным [-I].
Формально полярность C–Hсвязи принимается за 0. Природа индукционного эффекта связей всех других атомов с углеродом рассматривается относительноC-Hсвязи. Полярность связи в органическом соединении определяет его строение и реакционную способность, соответственно увеличивая или уменьшая ее.
Чем более полярна связь, тем более она реакционоспособна(и тем более активна молекула в целом).
Так, алканы, имеющие малополярные и неполярные связи (H–Cи С–C), малоактивны или неактивны, и наоборот, галогенпроизводные в значительной степени реакционноспособнее многих классов соединений благодаря сильно полярной связи С–Hal[-I].
