
Міністерство
освіти і науки, молоді та спорту України Прикарпатський
національний університет ім. Василя
Стефаника Інститут
природничих наук Кафедра
неорганічної та фізичної хімії
Підготувала:
Студентка
групи Х-21
Жирун
Любов
Перевірив:
Доц.Татарчук
Т.Р.
2012р.
Кристалохімія В та його сполук
|
План
Отримання кристалів бору.
Історія вивчення будови боратів.
Фізичні властивості кристалів бору.
Політропні модифікації бору і боридів.
Атоми бору при поверхневих шарах алмаза.
Структура металічного бориду.
Кристалічні структури боридів.
Отримання
кристалів бору
Французький хімік Сент-Клер-Девілль
разом з німецьким хіміком Велером
почали отримувати аморфний бор В, при
взаємодії оксиду бору
 з металевим алюмінієм АІ. Вони змішали
два цих порошкоподібних речовини і
стали нагрівати отриману суміш у
тиглі.При дуже високій температурі
пройшла реакція
з металевим алюмінієм АІ. Вони змішали
два цих порошкоподібних речовини і
стали нагрівати отриману суміш у
тиглі.При дуже високій температурі
пройшла реакція
+
2А1 = 2В +
 .
.
Коли реакція закінчилася і тигель охолов, хіміки висипали його вміст на порцелянову плитку. Вони побачили білий порошок оксиду алюмінію і шматочок металевого алюмінію. Коричневого порошку аморфного бору не було. Це хіміків спантеличило. Тоді Велер запропонував розчинити шматочок алюмінію в хлороводневій кислоті НС1:
2А1 (В) + 6НС1 =2АІСІ3 + 2В + ЗН2. Після закінчення реакції вони побачили на дні судини чорні блискучі кристали бору. Так був знайдений один з методів отримання кристалічного бору - хімічно інертного матеріалу, не взаємодіючого з кислотами. Один час кристалічний бор отримували сплавленням аморфного бору з алюмінієм наступною дією на сплав соляної кислоти. Потім виявилося, що отриманий таким чином бор завжди містить домішки алюмінію, мабуть, у вигляді його бориду АІВ12. Кристалічний бор по твердості займає серед усіх простих речовин друге місце після алмазу.
Історія вивчення будови боратів
Історія вивчення будови боратів багато в чому нагадує відповідну історію для силікатів але з різницею у часі приблизно на 25 - 30 років. Так, у 1947 р. А. В. Миколаїв у спеціальній монографії, присвяченій для природних боратів, розглядав їх як солі гіпотетичних поліборних кислот. (Для силікатів аналогічна концепція розвивалася до 20-х років нашого століття). Структурні формули цих кислот виводяться з використанням уявлення про ланцюжках з атомів бору в трикутній координації. Ідея Вант-Гоффа про чотирикоординовані атоми бору, на жаль, була майже забута. Слід зазначити, що жодна з передбачених А. В. Ніколаєвим структурних формул не підтвердилася при структурному аналізі боратів. У кристалах лейцита спостерігається аномальне двопереломлення.В основу кристалохімічної систематики боратів доцільно покласти дві ознаки:
1) будова основної структурної одиниці - борокисневихо полійонних ;
2)
спосіб поєднання цих одиниць (ізольовані
полііонени, ланцюжки, шари і т. д.).
Особливістю боратів, на відміну,
наприклад, від силікатів або фосфатів,
є велика різноманітність кінцевих
радикалів - полііонени, тому їх систематика
є найбільш важливою, і ми зупинимося
тут головним чином на ній. Ця ідея
розвинена в роботах Тенні-сона (1963 р.) і
Г. Б. Бокия і В. Б. Кравченко (1966 р.). Клас
боратів, як і силікатів, ми ділимо на
загони: острівні, ланцюжкові, шаруваті
і каркасні. Перший з них, найбільш багатий
представниками, в свою чергу може бути
підрозділі на підряди:некільцеві,
однокільцеві, двох-кільцеві, трьох-кільцеві,
чотирьох-кільцеві та борати зі змішаними
полійонними .Крім того, в рамках кожного
підряду можна розрізняти кисневі,
гідроксильні та змішані полііонени, а
також мономери від димерів і більш
складних полімерів. Якщо мономери
полімеризуються в одному, двох або трьох
вимірах до нескінченності, то утворюються
відповідні їм вищеназвані структури.
Атом бору в бораті може мати трикутну
і тетраедричну координацію, тому в разі
сполуки бору з киснем виходять відповідно
молекули складу
 -
й
-
й
 (див.
рис. 334, а і б). У разі заміни кисневого
іона на гідроксильний радикал виходять
аналогічнімолекули, але з іншим зарядом
. Змішана молекула покищо відома тільки
одна -
(див.
рис. 334, а і б). У разі заміни кисневого
іона на гідроксильний радикал виходять
аналогічнімолекули, але з іншим зарядом
. Змішана молекула покищо відома тільки
одна - .
Відомі димерні сполуки молекул
.
Відомі димерні сполуки молекул
 =
= і О2ВОВООН
=
і О2ВОВООН
=
 Аналогічний димер для повністю
гідроксильнї сполуки з тетраедричним
бором(рис. 334, г).
Аналогічний димер для повністю
гідроксильнї сполуки з тетраедричним
бором(рис. 334, г).
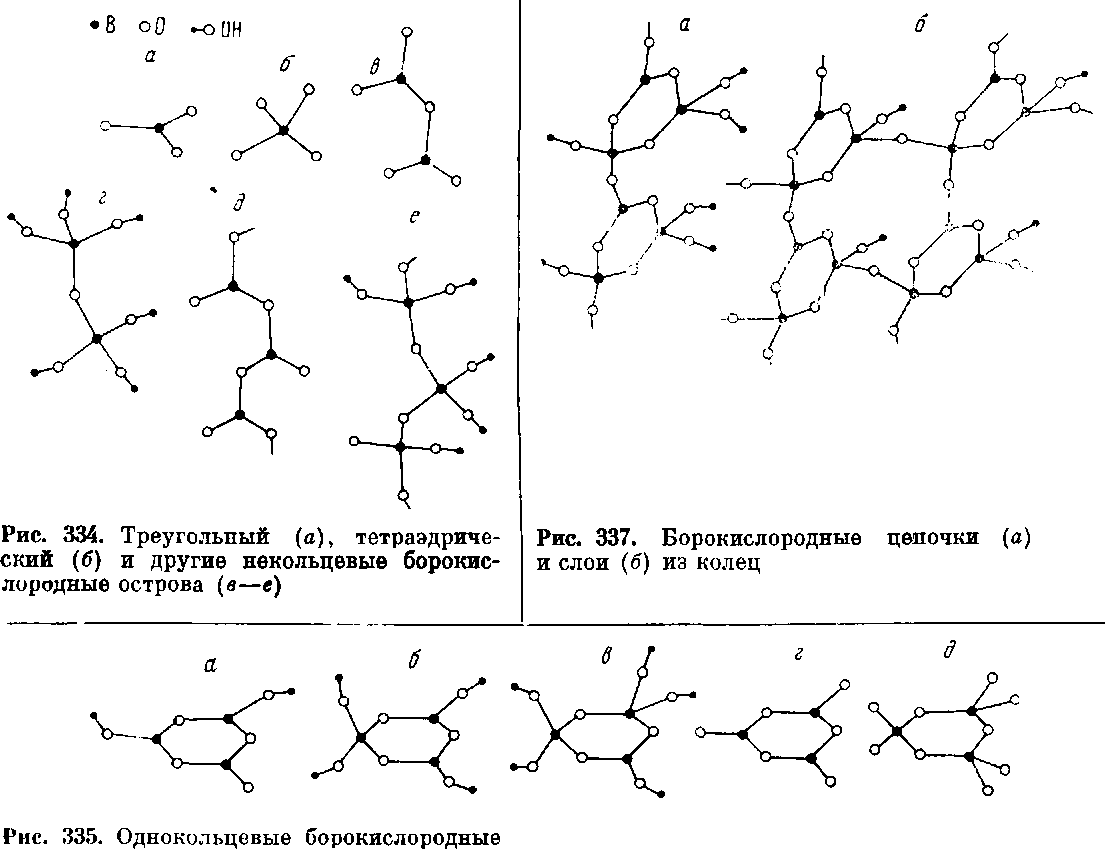
Утворення ланцюжків з «трикутних» і «тетраедричних» атомів бору, що виходять при подальшій конденсації мономерів, ілюструє рис. 334,5 і е. Вельми різноманітні кільцеві радикали.
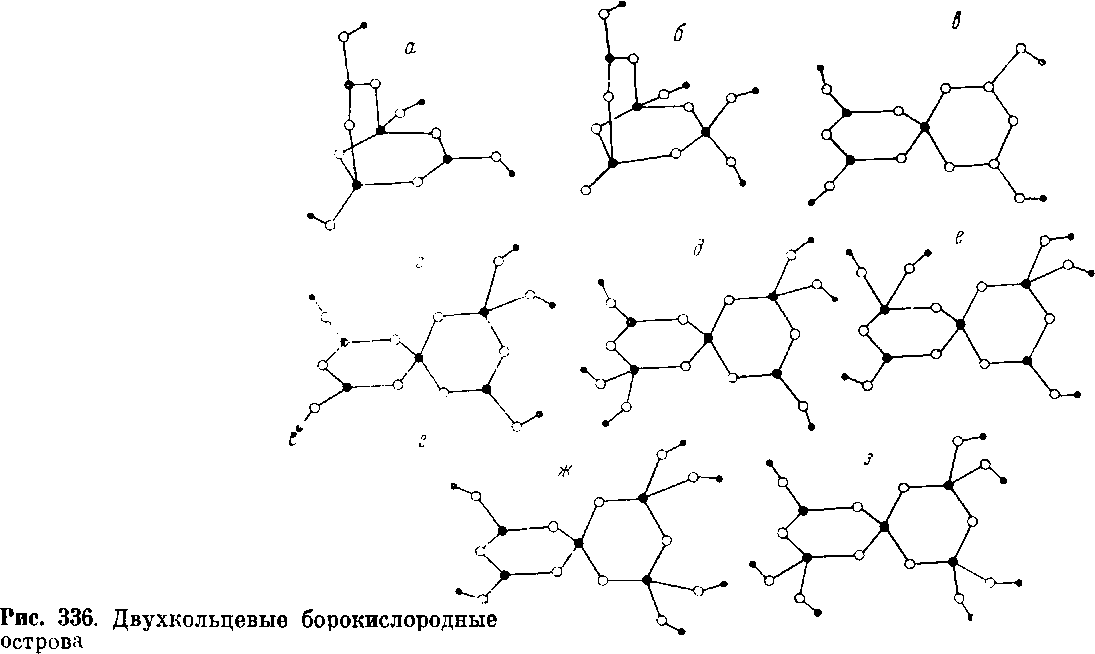
Однокільцеві радикали зібрані на рис. 335, а-д. Двохкільцеві радикали показані на рис. 336, а-з. Окремі кільця вже серед двохкільцевих радикалів можуть з'єднуватися один з одним через загальну вершину (рис. 336, в - з) і через загальне ребро (а і б). У більш складних радикалах спостерігається з'єднання кілець не тільки через загальний атом бору, але й через загальний атом кисню (див. табл. 51). Подальша конденсація кільцевих радикалів призводить до утворення ланцюжків, шарів (рис. 337) і каркасів.А. Ф. Горбов (1960 р.) і В. Б. Кравченко (1963 р.) показали зміну полііонів в структурах боратів, що утворюються з розчинів з різним ставленням компонентів і з різним рН. В результаті такого підходу вдалося простежити деякі генетичні взаємини між боратами.
