
- •Розділ 2. Дослідження системи крові
- •2.1. Загальний аналіз крові
- •2.1.1. Гематологічні дослідження
- •2.1.2. Загальний клінічний аналіз крові
- •2.2. Система еритрону
- •2.2.1. Дослідження морфології та функції еритроцитів
- •2.2.2. Морфологічна ідентифікація та кількісний аналіз ретикулоцитів периферичної крові
- •2.2.3. Гетерогенна система гемоглобіну
- •2.2.3.1. Визначення концентрації гемоглобіну
- •Метод к. Зінгера
- •2.2.4. Серологічні дослідження крові
- •2.2.4.3. Визначення групи крові та резус-фактора людини за допомогою тест-реагентів «Цоліклон»
- •2.2.5. Диференціальна діагностика анемій та гемоглобінопатій
- •2.3. Лейкоцити – гетерогенна група клітин периферичної крові
- •2.3.1. Виділення та дослідження функціонального стану лейкоцитів
- •2.3.2. Дослідження апоптозу лейкоцитів периферичної крові
- •2.4. Дослідження системи гемостазу
- •2.4.1. Дослідження ролі тромбоцитів у процесі гемостазу
- •2.5. Дослідження клітин кісткового мозку
- •2.5.1. Виділення та дослідження морфології клітин кісткового мозку
- •2.5.2. Цитохімічні дослідження клітин кісткового мозку
- •2.6. Визначення імунологічних показників крові
- •Розділ 2. Дослідження системи крові Організація роботи на практикумі “Дослідження системи крові”
- •2.1. Загальний аналіз крові
- •3. Гомеостатична функція.
- •2.1.1. Гематологічні дослідження
- •2.1.1.1. Техніка проколу шкіри пальця та взяття крові для клініко-біохімічних аналізів
- •2.1.1.2. Визначення гематокритної величини
- •Уніфікований мікрометод визначення гематокриту (загального об’єму еритроцитів, модифікація і. Тодорова)
- •2.1.1.3. Визначення концентрації глюкози в крові глюкозооксидазним методом
- •Визначення концентрації глюкози в сироватці крові
- •2.1.1.4. Глюкозотолерантний тест
- •2.1.1.5. Визначення загального вмісту білків сироватки крові
- •Алгоритм побудови калібрувального графіка для визначення загального білка сироватки крові
- •Алгоритм побудови калібрувального графіка для визначення загального білка сироватки крові
- •2.1.1.6. Електрофорез білків сироватки крові на папері
- •2.1.1.7. Електрофорез білків сироватки крові в агаровому гелі
- •2.1.2. Загальний клінічний аналіз крові
- •Лейкоцитарний росток. Лейкоцити периферичної крові поділяються на гранулоцити (нейтрофіли, еозинофіли, базофіли) і агранулоцити (лімфоцити, моноцити) (рис. 2.13).
- •2.1.2.1. Визначення швидкості осідання еритроцитів (шое)
- •2.1.2.2. Визначення концентрації гемоглобіну
- •Хід роботи
- •Різні розмірності вираження концентрації гемоглобіну
- •2.1.2.3. Визначення кількості еритроцитів в 1 л крові
- •2.1.2.4. Розрахунок середнього вмісту гемоглобіну в еритроциті
- •2.1.2.5. Розрахунок кольорового показника крові
- •2.1.2.6. Визначення кількості лейкоцитів в 1 л крові
- •2.1.2.7. Визначення кількості тромбоцитів в 1 л крові
- •2.1.2.8. Техніка виготовлення мазків крові
- •2.1.2.9. Підрахунок лейкоцитарної формули периферичної крові
- •2.2. Система еритрону
- •2.2.1. Дослідження морфології та функції еритроцитів
- •2.2.1.1. Підрахунок кількості еритроцитів меланжерним методом
- •2.2.1.2. Визначення глікогену еритроцитів цитохімічним методом
- •2.2.1.3. Визначення осмотичної резистентності еритроцитів
- •2.2.1.4. Визначення резистентності еритроцитів до кислотного гемолітика
- •Кінетика гемолізу еритроцитів
- •2.2.1.5. Виявлення базофільної зернистості еритроцитів
- •2.2.1.6. Безапаратне фракціонування еритроцитів крові у градієнті густини сахарози
- •2.2.2. Морфологічна ідентифікація та кількісний аналіз ретикулоцитів периферичної крові
- •2.2.2.1. Визначення кількості ретикулоцитів
- •1. Фарбування ретикулоцитів блискучим крезиловим синім безпосередньо на предметному склі.
- •2. Фарбування ретикулоцитів у пробірках.
- •2.2.2.2. Визначення швидкості дозрівання та добової продукції ретикулоцитів
- •2.2.3. Гетерогенна система гемоглобіну
- •2.2.3.1. Визначення концентрації гемоглобіну
- •Хід роботи
- •Хід роботи
- •2.2.3.2. Визначення гемоглобіну у фіксованих препаратах
- •2.2.3.3. Забарвлення тотальних препаратів на гемоглобін солянокислим бензидином
- •2.2.3.4. Визначення вмісту лужностійкого гемоглобіну
- •Метод к. Зінгера
- •2.2.3.5. Кількісне визначення термолабільного гемоглобіну
- •2.2.3.6. Визначення вмісту глікозильованого гемоглобіну
- •2.2.3.7. Визначення фетального гемоглобіну на мазках крові
- •2.2.4. Серологічні дослідження крові
- •2.2.4.3. Визначення групи крові та резус-фактора людини за допомогою тест-реагентів «Цоліклон»
Алгоритм побудови калібрувального графіка для визначення загального білка сироватки крові
Номер пробірки |
Стандартний розчин білка, мл |
0,9 % NaCl, мл |
Вміст білка в пробі, мг |
1 |
0,1 |
0,6 |
0,050 |
2 |
0,2 |
0,8 |
0,100 |
3 |
0,4 |
0,6 |
0,200 |
4 |
0,6 |
0,4 |
0,300 |
5 |
1,0 |
– |
0,500 |
Проводять аналіз та фотометрують (див. хід роботи, п. 1). З одержаних даних оптичної густини будують графік, відкладаючи на осі абсцис коцентрацію білка, а на осі ординат – відповідні їм екстинкції, одержані під час фотометрування білкових проб. Проби фотометрують проти “сліпої” проби, де замість розчину білка беруть 1 мл дистильованої води (рис. 2.9).

Рис. 2.9. Калібрувальна крива для визначення концентрації білка за методом Лоурі
Спрощений метод Лоурі. Модифікація Петерсона
Реактиви
1. Тартрат-карбонат купруму (ТКК). Повільно перемішуючи, до розчину сульфату-тартрату купруму додають 20 % розчин натрій карбонату для отримання кінцевого розчину: 0,1 % CuSO4×5H2O + 0,2 % калій тартрату +10 % натрій карбонату. Розчин стабільний протягом двох місяців при +20 °C.
2. NaOH – 0,8 M розчин.
3. Натрій додецилсульфат (НДС, виробництва Sigma-Aldich або Pierce) – 10 % розчин.
4. Реагент Фоліна (2 моль/л).
Реагенти
1. Натрій дезоксихолат (ДОХ) – 0,15 % розчин.
2. Трихлороцтова кислота (ТХО) – 72 % розчин.
3. Альбумін сироватки крові бика (БСА) – розчин (0,5 мг/мл). Термін зберігання п’ять діб (при +4 °C).
4. Реагент А. Змішують однакові об’єми вихідних розчинів ТКК, NaOH, НДС і води (можна зберігати впродовж двох тижнів при +20 °С).
5. Реагент Б. Реагент Фоліна розводять водою у пропорції 1:5.
Хід роботи
Розводять водою 5–10 мкг білка до кінцевого об’єму 1,0 мл. До отриманих розчинів додають 0,1 мл 0,15 % ДОХ і залишають на 10 хв при +20 °С. Після цього вносять 0,1 мл 72 % ТХО, перемішують і центрифугують упродовж 15 хв при 3 000 g. Рідину від осаду відділяють шляхом декантації (процедурою осадження можна знехтувати, якщо немає домішок або якщо у процесі вимірювання їхня наявність врахована). До осаду білка додають 1 мл води та 1 мл реагенту А. Перемішують до розчинення і залишають на 10 хв при +30 °С. Після 10 хв інкубації до проб додають 0,5 мл реагенту В і швидко перемішують. Через 30 хв вимірюють екстинкцію розчину при λ = 750 нм. Зменшення інтенсивності забарвлення в часі становить 1–2 % за годину при +20 °С. Залежність поглинання від концентрації білка в логарифмічних координатах є лінійною. Метод осадження білка ТХО з розчину в дезоксихолаті можна застосовувати до розчинних і мембранних білків. Білок у кількості 1–10 мкг визначають за цією методикою зі зменшенням об’ємів усіх реагентів уп’ятеро.
2.1.1.6. Електрофорез білків сироватки крові на папері
Суміш білків розділяють на спеціальних типах хроматографічного паперу, який просочують буферними розчинами, у приладах для електрофорезу. Білки розділяють за напруги до 500 В. Схема одного з можливих приладів для низьковольтного електрофорезу показана на рис. 2.10.
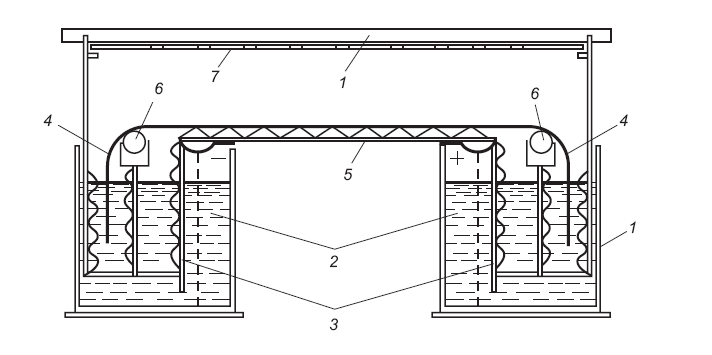
Рис. 2.10. Схема приладу для низьковольтного електрофорезу на папері:
1 – плексигласова ванночка та кришка; 2 – два електродні відділи; 3 – поздовжні перетинки в електродних відділах; 4 – кінці паперових смужок; 5 – горизонтальна пластинка з шипами; 6 – палички між горизонтальною пластинкою і зовнішніми електродними відділами; 7 – плексигласова пластинк а з великими круглими отворами
Камера для електрофорезу складається з плексигласової ванночки та кришки (1). У ванночці наявні два електродні відділи (2), кожний з яких додатково розділений поздовжньою перетинкою (3) ще на два відділи, з’єднані між собою. У внутрішні відділи опускають електроди, а у зовнішні – кінці паперових смужок (4). Основна частина паперу розташована на горизонтальній пластинці з шипами (5). Між горизонтальною пластинкою і зовнішніми електродними відділами розміщені палички (6), через які перекидають паперові смужки і які виконують функцію підтримувальних опор. Під верхньою кришкою камери розміщена плексигласова пластинка з великими круглими отворами (7), на яку зверху кладуть змочений у дистильованій воді та складений у чотири–п’ять разів фільтрувальний папір. Цей папір сприяє збільшенню герметичності камери і, як наслідок, зменшує випаровування рідини з електрофореграм під час електрофорезу.
Цим методом сироватку крові можна розділити на п’ять–дев’ять фракцій і визначити відносний вміст білка в кожній з них. Розділення проводять у буферному розчині (рН 8,6–8,9) з градієнтом потенціалу 3–5 В/см (120–350 В для смужок довжиною 40–45 см) за кімнатної температури. Сила струму не повинна перевищувати 0,1–0,3 мА на кожний поперечний сантиметр паперової смужки. Збільшення сили струму в понад два рази неприпустиме, оскільки відбувається надмірне нагрівання та значне випаровування буферного розчину і, як наслідок, пригорання паперу.
Реактиви
1. Буферний розчин. Можна використовувати:
• веронал-мединаловий буфер (рН 8,6): у 300 мл дистильованої води розчиняють 10,32 г мединалу (натрієва сіль вероналу), додають 1,84 г вероналу, нагрівають з перемішуванням на водяній бані до розчинення і доводять дистильованою водою до 1 л;
• веронал-ацетатний буфер (рН 8,6): у 300 мл дистильованої води розчиняють 4,3 г вероналу, додають 10,95 г натрій гідроксиду і 3,24 г натрій оцтовокислого. До розчину доливають 30 мл 0,1 М розчину НСl і доводять дистильованою водою до 1 л;
• трис-буфер (рН 8,9): в 1 л дистильованої води розчиняють 60,5 г трису, 6 г етилендіамінтетраоцтової і 4,6 г борної кислоти.
2. Розчини для зафарбовування електрофореграм:
• кислий синьо-чорний барвник (аналогічний амідовому червоному 10Б) – 0,2 г у суміші: 100 мл оцтової кислоти (льодяної) та 900 мл метилового спирту;
• бромфеноловий синій – 0,5 г, сулема – 10 г, оцтова кислота (льодяна) – 20 мл, дистильована вода – 980 мл;
• бромфеноловий синій – 0,1 г, ZnSO4×7H2O – 50 г, оцтова кислота (льодяна) – 50 мл, дистильована вода – 900 мл.
3. Розчини для відмивання електрофореграми від фарби, яка не зв’язалася з білками, та фіксація барвника на білках:
• оцтова кислота – 2 % розчин;
• оцтовокислий натрій – 2 % розчин, приготовлений на 10 % розчині оцтової кислоти.
4. Розчини для елюювання зафарбованих продуктів з електрофореграми:
• для видалення бромфенолового синього – 0,01 М розчин NaOH;
• для видалення кислого синьо-чорного барвника – 0,1 М розчин NaOH.
5. Папір хроматографічний: FN 4, FN 5, ватман 3, ватман 3ММ та ін.
Хід роботи
Отримання сироватки крові. Кров обробляють за такою методикою: 2–3 мл крові набирають у суху центрифужну пробірку і залишають на 30–60 хв. Тонкою скляною паличкою обережно обводять стінки пробірки для відділення від неї згустка, центрифугують, сироватку зливають у чисту пробірку.
Підготовка камери. Відділи для електродів наповнюють буферним розчином до одного рівня (щоб попередити перетікання буфера). У внутрішні частини електродних відділів встановлюють електроди. На аркуші хроматографічного паперу (18×45 см) (якщо використовують тонкий папір, то зразки ліпше наносити на окремі смужки шириною 4–5 см) на відстанні 15 см від одного з його вузьких країв простим м’яким олівцем (графіт перешкоджає розтіканню рідини) розкреслюють місця для нанесення проб. Їх креслять у формі прямокутників (2×0,3 см), більші сторони яких розміщують перпендикулярно до довжини паперової смужки. Відстань між стартовими зонами і краями електрофореграми повинна становити 2 см. Електрофореграму просочують буфером, у якому будуть проводити електрофорез. Для цього її протягують через кювету з буферним розчином. Кінці паперових смужок (6–8 см) не змочують. Надлишок буфера вилучають шляхом промочування смужок між двома–трьома шарами фільтрувального паперу. Вологу елктрофореграму поміщають у камеру на центральну горизонтальну пластинку, а кінці занурюють у зовнішні відділи електродних відділів. Прилад щільно закривають кришкою, під якою містяться змочені водою аркуші фільтрувального паперу.
Проведення електрофорезу. Після того, як паперові смужки повністю просочаться буферним розчином, на обкреслені ділянки наносять проби: 0,01–0,02 мл (1–2 мг білка) сироватки. Камеру закривають кришкою і приєднують до джерела струму. Тривалість електрофорезу становить 22–24 год за напруги 200–300 В.
Фіксація і зафарбовування електрофореграми. Після завершення електрофорезу від’єднують камеру від джерела струму й відразу виймають електрофореграму. Електрофоретичні смужки розкладають на спеціальні підставки і висушують під витяжкою, а потім у сушильній шафі за 105 °С протягом 20 хв для фіксації білків на папері. Згодом електрофореграму переносять до емальованого лотка, заливають барвником і залишають на 2–3 год або й більше. Фарбу зливають і електрофореграму відмивають від її надлишку, заливаючи три–чотири рази 2 % розчином оцтової кислоти, кожного разу на 5–10 хв. Ділянки паперу, які не містять білків, повинні бути повністю відмиті від фарби. Для закріплення зафарбованих продуктів електрофореграму на 2 хв заливають 2 % розчином оцтовокислого натрію і висушують на повітрі під витяжкою.
Визначення окремих білкових фракцій. При рН 8,6 білки сироватки крові заряджені негативно і переміщаються в електричному полі до анода. Найшвидше до анода рухається фракція альбумінів, а тоді α1-, α2-, β-, γ-глобуліни (рис. 2.11, а). Фрагменти паперових смужок, на яких проявилися білкові плямки, розділяють поперечними лініями простим олівцем на смужки шириною 3–5 мм і розрізають по цих лініях. Кожну смужку подрібнюють і вносять в окремі пронумеровані пробірки, заливають 3 мл 0,01 М розчину NaOH, залишають на годину для екстракції фарби з паперу, а тоді кожний розчин спектрофотометрують на ФЕКу при λ = 612 нм. Паралельно обробляють контрольну пробу. Для контролю вирізають фрагмент паперу на незафарбованій ділянці електрофореграми.

Рис. 2.11. Електрофорез сироватки крові на папері або на ацетилцелюлозі. Електрофореграма сироватки крові людини (а) і крива розподілу білкових фракцій на електрофореграмі (б)
На підставі отриманих даних (оптична густина кожного білкового зразка) будують криву розподілу зафарбованих продуктів на електрофореграмі. На осі абсцис позначають номери пробірок, а на осі ординат – відповідні значення оптичної густини (рис. 2.11, б). Розраховують відсоткове співвідношення білкових фракцій у сироватці крові. Для цього побудовану криву поділяють на мінімальні ділянки, які відповідають окремим фракціям. Значення площі кожної ділянки пропорційне до кількості фарби, яка взаємодіяла з білком цієї фракції. Співвідношення між цими площами обчислюють за масою (наважка ділянок паперу пропорційна до їхньої площі), всю площу приймають за 100 %. Замість паперу можна використовувати ацетилцелюлозу (див. рис. 2.11). У цьому випадку співвідношення білкових фракцій у сироватці крові можна визначити за денситограмою.
