
- •Химическое равновесие
- •Факторы влияющие на смещение равновесия:
- •Вопросы для закрепления знаний по данной теме:
- •I Вариант:
- •Укажите уравнение обратимой реакции.
- •2. В какой системе при повышении давления равновесие сместится вправо?
- •5. Рассчитайте, как измениться скорость реакции, при увеличении температуры с 100с до 500с, если температурный коэффициент равен 3
- •6. Вещества, замедляющие скорость химической реакции, называются _________________.
- •7. Установите соответствие между названием вещества и видом химической связи, с помощью которой оно образовано.
- •Вопросы для закрепления знаний по данной теме:
- •II Вариант:
- •1. Укажите уравнение обратимой реакции.
- •2. В какой системе при повышении давления равновесие сместится вправо?
- •5. Рассчитайте, как измениться скорость реакции, при увеличении температуры с 00с до 500с, если температурный коэффициент равен 2
- •7. Установите соответствие между названием вещества и видом химической связи, с помощью которой оно образовано.
- •Вопросы для закрепления знаний по данной теме:
- •III Вариант:
- •1. Укажите уравнение обратимой реакции.
- •2. В какой системе при повышении давления равновесие сместится вправо?
- •5. Рассчитайте, как измениться скорость реакции, при увеличении температуры с 100с до 400с, если температурный коэффициент равен 4
- •6. Правило Вант – Гоффа гласит: при повышении ______________ на каждые 10o скорость реакции увеличивается в 2-4 раза.
- •7. Установите соответствие между названием вещества и видом химической связи, с помощью которой оно образовано.
Химическое равновесие
Химическое равновесие – состояние системы, при котором скорость прямой реакции равна скорости обратной реакции.
аА
+ вВ
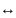 сС + dD
сС + dD
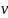 пр.
=
обр.
пр.
=
обр.
В состоянии равновесия прямая и обратная реакция не прекращаются, поэтому равновесие называют динамичным. Концентрации всех веществ остаются постоянными. При изменении давления, температуры, концентрации веществ происходит смещение химического равновесия. Направление смещения равновесия определяется принципом Ле Шателье: если на систему, находящуюся в равновесии, производится внешнее воздействие (изменяется давление, температура, концентрация вещества), то оно способствует протеканию той из двух противоположных реакций, которая ослабляет воздействие.
Факторы влияющие на смещение равновесия:
1.Котцентрация.
При увеличении концентрации реагирующих
веществ химическое равновесие смещается
в сторону образования продуктов реакции
(
пр.
 𝓋обр.);
при увеличении концентрации продукции
реакции – в сторону образования исходных
веществ (𝓋пр.
𝓋обр.).
𝓋обр.);
при увеличении концентрации продукции
реакции – в сторону образования исходных
веществ (𝓋пр.
𝓋обр.).
2.Давление. При увеличении давления химическое равновесие системы смещается в сторону той реакции, при которой объем образующихся газообразных веществ меньше. При увеличении давления равновесие смещается в сторону меньшего объема, а при уменьшении - в сторону большего объема.
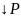
2H3N
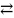 3H2
+ N2
3H2
+ N2
2V 4V
Если исходные вещества и продукты реакции занимают одинаковый объем, то давление не будет влиять на смещение равновесия, например: А + В С + D
2 2
3. Температура. При повышении температуры химическое равновесие системы смещается в сторону эндотермической реакции (-Q);
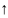 t
t
N2 + O2 ⇄ 2NO – 180,8 кДж
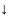 t
t
при понижении температуры – в сторону экзотермической реакции (+Q).
t
H2
+ Cl2
 + 184,6кДж
+ 184,6кДж
t
Вопросы для закрепления знаний по данной теме:
Инструкция для обучающихся.
При выполнении заданий уровня А (часть 1 ЕГЭ) - задания 1- 5 нужно выбрать среди предложенных ответов один верный и указать его номер, а при выполнении задании 6 – впи-шите слово, заканчивающее данное утверждение. При выполнении заданий уровня Б (часть 2 ЕГЭ) - задание 7 нужно установить соответствие между буквой и цифрой. Цифры в ответе могут повторяться.
I Вариант:
Укажите уравнение обратимой реакции.
1) 2NaOH + H2SO4 = Na2SO4 + 2H2O; 2) N2 + 3H2 = 2NH3;
3) AlCl3 + 3NaOH = Al(OH)3↓ + 3NaCl; 4) Li2O + 2HCl = 2LiCl + H2O.
2. В какой системе при повышении давления равновесие сместится вправо?
1) 2CO2(г) ↔ 2CO(г) + O2(г); 2) C2H4(г) ↔ C2H2(г) + H2(г);
3) PCl3(г) + Cl2(г)↔ PCl5(г); 4) H2(г) + Cl2(г)↔ 2HCl(г).
3. В системе 2SO2(г) + O2(г) ↔ 2SO3(г) + Q смещению химического равновесия в сторону исходных веществ будет способствовать
1) уменьшение концентрации SO2; 2) увеличение концентрации SO2;
3) увеличение концентрации O2; 4) уменьшение концентрации SO3.
4. На смещение химического равновесия в системе N2 + 3H2 ↔ 2NH3 + Q не оказывает влияния
1) понижение температуры; 2) повышение давления;
3) удаление NH3 из зоны реакции; 4) применение катализатора.
