
- •Введение
- •Глава 1. Аналитический обзор исследований в области химии, технологии и применения известковых огнеупоров
- •1.1. Кристаллохимические особенности оксидов металлов II группы
- •1.2. Физико-химические свойства оксида кальция
- •1.3. Распространенность в природе и сырьевая база мелов, известняков и доломитов для производства огнеупоров
- •1.4. Современное состояние и тенденции технологии огнеупоров, содержащих свободную известь
- •1.5. Исследования в области механизмов спекания и технологии известковых и известковопериклазовых клинкеров
- •1.6. Способы повышения гидратационной устойчивости СаО
- •Глава 2. Исходные материалы, их подготовка и методы исследования
- •2.1. Классификация рассматриваемых в диссертационной работе огнеупоров, материалы и методы исследования
- •2.2. Описание и характеристика исходных веществ
- •Глава 3. 3.1. Исследование спекания СаО на клинкер в лабораторных условиях
- •3.3. Технология получения высокоплотного клинкера спеканием
- •3.3.1. Технология известьсодержащего клинкера без добавок
- •3.3.2. Технология и свойства высокоплотного клинкера с добавкой TiO2
- •Кальция
- •3.3.3. Технологические особенности применения мокрого помола сырья
- •3.3.6. Краткие выводы
- •4. Безопасность объектов.
- •Организация го по производственному признаку.
- •Глава 5. Экономическая оценка технологии известковых огнеупоров
- •5.1. Затраты на производство известкового клинкера спеканием
- •10.3. Затраты на производство известковых изделий
- •10.4. Краткие выводы
- •7. Заключение и выводы
2.2. Описание и характеристика исходных веществ
В работе использовали следующие основные сырьевые материалы: мел латненского месторождения (рудник Белый Колодец), шебекинский мел (Белгородская область, далее по тексту белгородский мел).
Все эти карбонатные породы отличаются достаточно высокой природной чистотой (табл.2.2), что и послужило главным критерием при выборе проб именно этих месторождений, для изучения спекания СаО и разработки технологии клинкеров на основе СаО.
Таблица 2.2 - Химический состав пробы использованных в работе исходных
материалов, % мас. в пересчете на оксиды и сухое вещество
Вещество |
CO2 |
SiO2 |
Al2O3 |
Fe2O3 |
CaO |
MgO |
R2O |
Латненский мел |
43,28 |
0,61 |
0,67 |
0,30 |
54,79 |
- |
0,35 |
Шебекинский (Белгородский) мел |
43,63 |
0,53 |
0,28 |
0,15 |
55,10 |
0,02 |
0,29 |
Другим критерием выбора служил тот факт, что запасы всех вышеперечисленных веществ в России очень велики, что в свою очередь говорит о возможности использования результатов данной работы в огнеупорной и керамической промышленностях. Следует также отметить, что влажность данных сырьевых материалов может колебаться от 2 до 20%.
Мел. Природный мел является одной из разновидностей известняка [100] и в качестве посторонних примесей в основном содержит глинообразующие минералы с незначительным присутствием оксида железа. В составе карбонатной части мела различаются три группы форменных компонентов: карбонаты органического происхождения (остатки растительные и животные); кристаллы кальцита с хорошими гранями; порошковый кальцит.
В таблице 2.3 приведены результаты спектрального анализа содержащихся в меле Латненского месторождения примесных элементов по данным Воронежского Государственного университета.
Таблица 2.3 - Содержание примесных элементов в меле латненского
месторождения
Элемент |
Na |
Mo |
Al |
Si |
P |
S |
Cl |
K |
Ti |
Содержание, мг/кг |
21,64 |
5,39 |
1,70 |
12,81 |
0,365 |
0,105 |
0,025 |
0,510 |
0,050 |
Элемент |
V |
Cr |
Mn |
Fe |
Co |
Ni |
Cu |
Zn |
Pb |
Содержание, мг/кг |
0,021 |
0,010 |
0,010 |
0,76 |
0,139 |
0,010 |
0,010 |
0,012 |
0,144 |
Остатки органического происхождения слагают основную часть мела и в меле латненского месторождения их содержится 40-60% от всей массы вещества. Кристаллы кальцита встречаются редко и представляют собой диагенетические, т.е. вторичные образования. Порошковый кальцит представлен мельчайшими крупинками, его содержание в выбранных мелах составляет 35-55%. Мела Белгородской области, в частности шебекинского месторождения, имеют отдельные включения карбонатов магния. По внешнему виду и физическим свойствам мел - это белая, слабосцементированная порода. Характерными особенностями мела являются мягкость, отсутствие перекристаллизации и отчетливой слоистости. Одним из наиболее эффективных физических способов активации является тонкое измельчение порошков перед спеканием, т.е. увеличение их удельной поверхности и, соответственно, удельной поверхностной энергии механическим способом. Этот способ обладает следующими достоинствами:
не изменяет химического состава исходных веществ (из-за значительно более низкой твердости измельчаемых веществ по сравнению с твердостью мелющих тел «намолом шаров» можно пренебречь, это подтверждается данными химического анализа веществ до и после помолов). Давно известно [100, 101], что мел, доломит и магнезит обладают одним из самых высоких коэффициентов измельчаемости;
позволяет получать высокоплотный клинкер одностадийным обжигом, применением которого снижаются затраты на производство и сводится к минимуму контакт с пылью, растворами и суспензиями, содержащими известь;
не требует сложного и дорогого аппаратурного оформления, как в случае с активацией путем изменения атмосферы в печи, применения электромагнитных полей, растворных технологий, сверхвысоких давлений и т.д.;
позволяет избежать эффекта, который возникает при химической активации легкоплавкими добавками порошков СаО, которые проявляют основные свойства по отношению к большинству оксидов (т.е. сами по себе химически активны).
Исходные вещества для лабораторных опытов использовали в виде кусков размером от 1 до 10 мм. Для изучения влияния степени измельчения (времени помола) исходных веществ на их поведение при спекании их подвергали предварительному измельчению в вибрационной мельнице с полиуретановой футеровкой внутренней поверхности в течение 1, 2 и 12 часов. Помол проводили при соотношении массы мелющих тел (стальные шары) к массе материала = 5:1. Для изучения характеристик спекаемости эвтектической точки использовали смесь совместного помола лисьегорского доломита и латненского мела, состав которой (после прокаливания при 1100 оС), приведен в таблице 2.2.
Средний размер частиц каждого вещества после различного времени помола получен расчетом из функции распределения [148]:
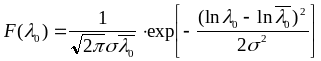 ,
(2.1)
,
(2.1)
где
![]() -
средний размер частиц мелов, доломитов
и магнезита после помола, полученный
из (3.7),
-
средний размер частиц мелов, доломитов
и магнезита после помола, полученный
из (3.7),
![]() -
содержание частиц размером
-
содержание частиц размером
![]() ,
,
![]() -
дисперсия и приведен в таблице 2.4.
-
дисперсия и приведен в таблице 2.4.
Таблица
2.4 - Средние размеры частиц исследуемых
веществ после помола![]()
и прокаливания l0
Исходное вещество |
Время помола, час. |
, мкм |
l0, мкм |
Латненский мел |
1 2 6 |
4,78 4,54 3,01 |
3,5 3,4 2,2 |
Белгородский мел |
1 2 6 |
4,34 3,76 2,92 |
3,2 2,8 2,7 |
Данные по размерам частиц каждой фракции после измельчения получены седиментационным анализом в изобутиловом спирте на приборе «Седиграф-5000Д» (Методическая инструкция МВИ 14-338-14-79-84). В таблице 3.2 также приведены (l0=0,66 - формула для мелов [102]) средние размеры частиц в начальный момент спекания СаО, которые получаются при достижении спекаемыми карбонатами Са температуры 1100оС, когда завершаются процессы термического разложения (декарбонизации) [103].
Приготовленные измельчением, порошки исходных веществ увлажняли раствором поливинилового спирта плотностью 1,24 г/см3 и перемешивали в течении 1/4 часа для равномерного распределения раствора спирта в порошках. Из увлажненных масс на ручном гидравлическом прессе при удельном давлении 20 МПа прессовали образцы диаметром 1 см и высотой 1 см.
На рис.2.4 – 2.6 в качестве примера (поскольку графики для всех использованных веществ после помола однотипны) приведены дифференциальные кривые распределения частиц латненского мела после различного времени активации порошков в вибрационной мельнице.
Отпрессованные
образцы подвергали сушке в сушильном
шкафу СНОЛ при 110оС
в течение 2-х часов. После сушки образцы
обмеривали и взвешивали. Перед обжигами
в вакуумной печи все образцы прокаливали
в муфельной печи при 1100оС
с выдержкой 1 час для проведения процесса
декарбонизации. После прокаливания
образцы охлаждали до 500оС,
переносили в вакуумную печь и сразу же
вакуумировали. Охлаждение до 500оС
(и не ниже) связано с тем, что уже при
450оС
ход реакции СаО+H2O![]() Са(OH)2
в значительной мере сдвинут вправо. Это
позволяет избежать гидратационных
изменений в образцах, содержащих СаО,
которые привели бы к искажению результатов
эксперимента из-за изменения предыстории
материалов и засорению диффузионного
насоса парами воды и выходу его из строя
[86]. Садку образцов для прокаливания и
обжига осуществляли в периклазовый
контейнер. На рис.2.7 и 2.8 показан вид
порошка СаО после прокаливания при
1100оС.
Са(OH)2
в значительной мере сдвинут вправо. Это
позволяет избежать гидратационных
изменений в образцах, содержащих СаО,
которые привели бы к искажению результатов
эксперимента из-за изменения предыстории
материалов и засорению диффузионного
насоса парами воды и выходу его из строя
[86]. Садку образцов для прокаливания и
обжига осуществляли в периклазовый
контейнер. На рис.2.7 и 2.8 показан вид
порошка СаО после прокаливания при
1100оС.

Рис.2.4 - Кривые распределения частиц латненского мела по размерам после помола: 1 часа; 2- 2 часа; 3- 6 часов.

Рис.2.7 - Вид прокаленного при 1100оС порошка СаО на приборе CamScan-4, увеличение х5000.
