
- •Введение
- •Глава 1. Аналитический обзор исследований в области химии, технологии и применения известковых огнеупоров
- •1.1. Кристаллохимические особенности оксидов металлов II группы
- •1.2. Физико-химические свойства оксида кальция
- •1.3. Распространенность в природе и сырьевая база мелов, известняков и доломитов для производства огнеупоров
- •1.4. Современное состояние и тенденции технологии огнеупоров, содержащих свободную известь
- •1.5. Исследования в области механизмов спекания и технологии известковых и известковопериклазовых клинкеров
- •1.6. Способы повышения гидратационной устойчивости СаО
- •Глава 2. Исходные материалы, их подготовка и методы исследования
- •2.1. Классификация рассматриваемых в диссертационной работе огнеупоров, материалы и методы исследования
- •2.2. Описание и характеристика исходных веществ
- •Глава 3. 3.1. Исследование спекания СаО на клинкер в лабораторных условиях
- •3.3. Технология получения высокоплотного клинкера спеканием
- •3.3.1. Технология известьсодержащего клинкера без добавок
- •3.3.2. Технология и свойства высокоплотного клинкера с добавкой TiO2
- •Кальция
- •3.3.3. Технологические особенности применения мокрого помола сырья
- •3.3.6. Краткие выводы
- •4. Безопасность объектов.
- •Организация го по производственному признаку.
- •Глава 5. Экономическая оценка технологии известковых огнеупоров
- •5.1. Затраты на производство известкового клинкера спеканием
- •10.3. Затраты на производство известковых изделий
- •10.4. Краткие выводы
- •7. Заключение и выводы
1.2. Физико-химические свойства оксида кальция
Основные физико-химические свойства СаО и его аналогов приведены в таблице 1.1.
Как видно из таблицы 1.1 многие химические, механические и упругие свойства СаО практически не изучены [4,6, 10-18].
Оксид кальция – изолятор, который приобретает при высоких температурах ионную проводимость. СаО – способен к насыщению кислородом при высоких температурах в кислородсодержащей атмосфере или к потере кислорода при высоких температурах в вакууме [21]. В зависимости от состава и температуры среды может возникать нестехиометрия по кислороду и значительная электронная проводимость. Наибольшая доля ионной проводимости соответствует интервалу 1050-1100оС, при 1200оС минимум электропроводности соответствует парциальному давлению кислорода 5,6∙10-4 ат. В переносе участвуют катионы и анионы.
Основной характер оксида кальция обуславливает его высокую химическую активность. Исследовано достаточно большое количество различных диаграмм состояния систем с СаО [4]. При высоких температурах оксид кальция легко реагирует с амфотерными и кислыми оксидами, образуя легкоплавкие соединения и эвтектики.
Поведение СаО при высоких температурах в присутствии различных металлов рассматривалось в работе [23]. Температуры интенсивного взаимодействия с молибденом и вольфрамом составляют около 1900-1950оС, с танталом и ниобием – около 1750оС. В среде инертного газа (аргона) эти температуры несколько повышаются. Однако СаО проявляет высокую стойкость к расплавам Th, Pt, Pd, Yb, La, Ce, U, Pu, Ti. Очень высока стойкость оксида кальция к расплавленным сталям различных марок, особенно высоколегированным, золоту. Есть сведения о высокой стойкости СаО к расплавленному литию и его парам.
При температурах ниже температуры дегидратации портландита (~560оС) и декарбонизации СаСО3 (~900оС) СаО интенсивно поглощает водяные пары и СО2 из воздуха. Вначале образуется двойной кристаллогидрат кальция, затем гидроксид кальция, а затем его карбонат [1, 3]. Ни высокотемпературный обжиг, ни плавление, ни плазменная обработка не устраняют гидратацию вообще, однако, способны снизить её скорость.
Работы [24-26] посвящены изучению закономерностей гидроксилирования известковых клинкеров на керамической связке (с добавкой диоксида титана). Большое значение для настоящей работы представляют собой сведения о взаимодействии оксида кальция с веществами, присутствующими в расплавленной стали [27] (при температурах 1600-1750оС):
2[Р]+5(FeO)+4(CaO)=(CaO)4(P2O5)+5Fe
2[Р]+5(FeO)+3(CaO)=(CaO)3(P2O5)+5Fe
2[P]+2,5O2(г)+4(CaO)=(CaO)4(P2O5)
2[P]+2,5O2(г)+3(CaO)=(CaO)3(P2O5)
FeS+CaO=CaS+FeO
Fe+S+CaO=CaS+FeO
2CaO+Si+2S=2CaS+SiO2
2CaO+C+2S=2CaS+CO2
3CaO+3S+2Al=3CaS+Al2O3
FeSiO4+2CaO=CaSiO4+2FeO
Приведенные выше данные прямо указывают, что в случае применения СаО в качестве огнеупора, его интенсивное взаимодействие с примесями, находящимися в металле должно способствовать их удалению в шлак.
На рис. 1.16 показана диаграмма фазового равновесия системы MgO-СаО [4], которая имеет важнейшее значение в рассматриваемой в диссертационной работе технологии известковых огнеупоров. Однако свойства конкретных составов в этой системе по-видимому не исследовались. Для состава эвтектики и температуры ее плавления системы СаО-MgO приводятся различные данные [4]. Наиболее современной и подробной представляется эта система по Домену (рис.1.16.). Эвтектика представляет собой состав из 67 мас.% СаО и 33 мас.% МgО и плавится при 2370оС. Твердые растворы образуются как со стороны СаО, так и со стороны МgО. Предельная концентрация МgО в СаО т.р. при эвтектической температуре составляет 17 мас.%, а предельная концентрация СаО в МgО т.р. при этой же температуре составляет 7,8 мас.%. Область твердых растворов резко сужается с понижением температуры, и ниже 1600оС растворимость становится незначительной.
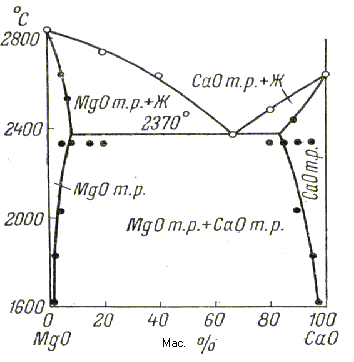
Рис.1.16 - Диаграмма фазового равновесия в системе MgO-CaO.
Из литературных данных видно, что основные огнеупоры на основе оксида кальция не должны уступать, а по целому ряду характеристик даже превосходить огнеупоры на основе оксида магния.
