
- •Введение
- •Глава 1. Аналитический обзор исследований в области химии, технологии и применения известковых огнеупоров
- •1.1. Кристаллохимические особенности оксидов металлов II группы
- •1.2. Физико-химические свойства оксида кальция
- •1.3. Распространенность в природе и сырьевая база мелов, известняков и доломитов для производства огнеупоров
- •1.4. Современное состояние и тенденции технологии огнеупоров, содержащих свободную известь
- •1.5. Исследования в области механизмов спекания и технологии известковых и известковопериклазовых клинкеров
- •1.6. Способы повышения гидратационной устойчивости СаО
- •Глава 2. Исходные материалы, их подготовка и методы исследования
- •2.1. Классификация рассматриваемых в диссертационной работе огнеупоров, материалы и методы исследования
- •2.2. Описание и характеристика исходных веществ
- •Глава 3. 3.1. Исследование спекания СаО на клинкер в лабораторных условиях
- •3.3. Технология получения высокоплотного клинкера спеканием
- •3.3.1. Технология известьсодержащего клинкера без добавок
- •3.3.2. Технология и свойства высокоплотного клинкера с добавкой TiO2
- •Кальция
- •3.3.3. Технологические особенности применения мокрого помола сырья
- •3.3.6. Краткие выводы
- •4. Безопасность объектов.
- •Организация го по производственному признаку.
- •Глава 5. Экономическая оценка технологии известковых огнеупоров
- •5.1. Затраты на производство известкового клинкера спеканием
- •10.3. Затраты на производство известковых изделий
- •10.4. Краткие выводы
- •7. Заключение и выводы
Глава 1. Аналитический обзор исследований в области химии, технологии и применения известковых огнеупоров
1.1. Кристаллохимические особенности оксидов металлов II группы
Число химических соединений, образующих класс простых и сложных оксидов с температурой плавления выше 2000оС, весьма ограничено. Среди них наибольшей распространенностью и доступностью выделяются оксиды магния и кальция, которые в природе в чистом виде практически не встречаются, но наиболее просто могут быть получены путем термолиза, главным образом карбонатов. Эти типично топохимические реакции хорошо изучены и описаны (см., например, [1-3]). В огнеупорной промышленности широкое применение находят оксид магния (периклаз) и «грязный» доломит с высоким содержанием примесей оксидов кремния и железа, алюминаты магния и кальция, цирконат кальция. Благодаря широкому применению оксидов магния и кальция в производстве щелочей, цемента и стекла их диаграммы фазового равновесия с другими оксидами также исследованы с достаточной полнотой [4,5], что в значительной мере облегчает анализ возможности их использования в производстве огнеупоров.
Несмотря на то, что MgO и СаО образуют однотипные кристаллические структуры их электронное строение, которым собственно и определяются все свойства, далеко не идентичны. Это можно проиллюстрировать графической зависимостью некоторых, наиболее важных свойств, от главного квантового числа валентных электронов рис.1.1 – 1.10 [1-7].
Как видно из этих рисунков, группу щелочноземельных металлов составляют наиболее близкие по свойствам Ca, Sr, Ba, Ra. Соединения Be и Mg, особенно Be, должны отличаться амфотерностью. Широко известны бериллаты и фторбериллаты [6,7], оксогидраты магния, магниды и т.п. соединения [8].
Амфотерность соединений магния, в частности его оксида, проявляется при сравнении термограмм разложения брусита и портландита. Если портландит вероятно разлагается в одну стадию с образованием оксида кальция и воды, то разложение брусита проходит по крайней мере через шесть стадий, на каждой из которых образуются свои оксогидраты магния, причем выделяющийся при этом
Рис.1.1- Зависимость температуры плавления МеО II группы от главного квантового числа. |
Рис.1.2- Зависимость первого потенциала ионизации металла II группы от главного квантового числа |
Рис.1.3- Зависимость электроотрицательности от главного квантового числа |
Рис.1.4- Зависимость доли ионности связи в соединении МеО от главного квантового числа. |
Рис.1.5-Зависимость растворимости Ме(ОН)2 II группы от главного квантового числа |
Рис.1.6- Зависимость электродного потенциала от главного квантового числа |
|
|
|
|
оксид магния отличается тем, что часть атомов магния находится в четверной, а часть в шестерной координации. Это значит, что такой «низкотемпературный» оксид магния по существу представляет собой смесь сложных мета- и орто-магнатов магния. Неметаллическим свойствам магния посвящена монография [8].
Объяснить эти явления и ход изменений свойств соединений металлов II группы можно на основе современной конфигурационной модели конденсированного состояния вещества [9]. Согласно этой модели, валентные электроны образуют устойчивые электронные конфигурации, статистическим весом которых и определяется прочность химической связи. К таким конфигурациям относятся полностью заполненные квантовые состояния s2, s2p6, d10, f14 полностью вакантные квантовые состояния p0, d0, f0 и наполовину заполненные квантовые состояния sp3, d5, f7. Причем наибольшей устойчивостью отличается химическая связь, образованная sp3, d5, f7 – состояниями. С увеличением главного квантового числа статистический вес стабильных конфигураций, образованных sxpy-состояниями уменьшается, а d-состояниями возрастает.
С этих позиций чисто ковалентная связь между атомами бериллия или магния с кислородом формируется путем передачи двух 2s электронов металла от одного (1) другому (2) по схеме:
1
Ме
2s2
– 2
![]()
Me 2s0
Me 2s0
2 Me 2s2 + 2 Me 2s2p2 Me sp3
Четыре sp3 – орбитали атома 2 Ме образуют с атомом кислорода структурный тетраэдр [MeO4], а пустая 2s0-орбиталь 1 Ме заполняется неподеленной парой электронов одной из sp3-орбиталей атома кислорода. Тетраэдры [MeО4] соединяются друг с другом через атомы кислорода.
Наложение 2s- и 2р-зон у бериллия определяет сильную акцепторную способность (получение чистого бериллия, как известно, сопряжено с очень большими трудностями). По этой причине формирование ковалентной связи Ве-О и в меньшей мере Mg-O может происходить путем акцептирования электронов атома кислорода:
О 2s2p4 – 2 O 2s2p2 O 2sp3
Me ns2 + 2 Me s2p2 Me nsp3
В ходе таких электронных переходов образуются наиболее стабильные полузаполненные sp3-состояния, доля которых в ВеО выше, чем в MgO. В результате ВеО и MgO должны образовывать структуры вюрцитного типа, в которых атомы металла находятся в тетраэдрическом окружении атомов кислорода, а атомы кислорода – в тетраэдрическом окружении атомов металла.
Резонанс (суперпозиция) ионного и ковалентного типа связей приводит, в частности, к полиморфизму ВеО [6, 10, 11]. В MgO достаточно увеличена роль ионной составляющей при значительной доле ковалентной (рис.1.4.). Именно поэтому MgO отличается наибольшей температурой плавления среди оксидов металлов II группы.
Приведенные выше схемы электронного строения с образованием ковалентной связи оказываются неприемлемыми для Са, у которого 2s-зона отделена от 2р-зоны 3d-зоной. Поэтому и доля ковалентной связи у СаО существенно ниже, чем у MgO, но может, в принципе, формироваться путем вовлечения в химическую связь d-зоны с образованием d3s гибридных орбиталей. Однако роль и стабильность их меньше, чем sp3-орбиталей. Поэтому у СаО температура плавления ниже, чем у MgO.
Ионная составляющая химической связи формируется путем передачи от атома Ме к атому кислорода двух внешних s-электронов с образованием соответственно Ме2+ и О2-.
В дальнейшем, при переходе к SrO, BaO, RaO химическая связь приближается к чисто ионному типу, и она ослабляется, т.к. с увеличением главного квантового числа доля стабильных d10-конфигураций, не принимающих участия в создании химической связи, возрастает, а доля sxpy-конфигураций уменьшается, в результате чего межатомное расстояние в этих оксидах увеличивается. Это влечет за собой монотонное понижение температуры плавления и других свойств, характеризующих прочность химической связи (рис.1.1 – 1.10.), которая уменьшается. На рис.1.11 и 1.12 показаны фрагменты кристаллической структуры оксида бериллия и оксида кальция, как это принято в классической кристаллографии.
Для сравнения можно отметить, что аналогичные, приведенному выше, электронные переходы характерны для образования электронного строения -Al2O3, в котором атом алюминия за счет суперпозиции 3s2 и 3sр3-состояний оказывается шестивалентным. Октаэдры [AlO6] соединены друг с другом общей гранью. В ВеО и MgO тетраэдры [ВеО4] или [MgO4] имеют общее ребро (рис.1.13). На рисунке 1.14 показано взаимное расположение группы СО3, Са и Mg в доломите.
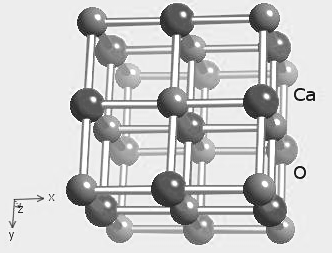
Рис.1.11 - Фрагмент структуры СаО типа NaCl (у MgO, SrO, BaO – аналогично).
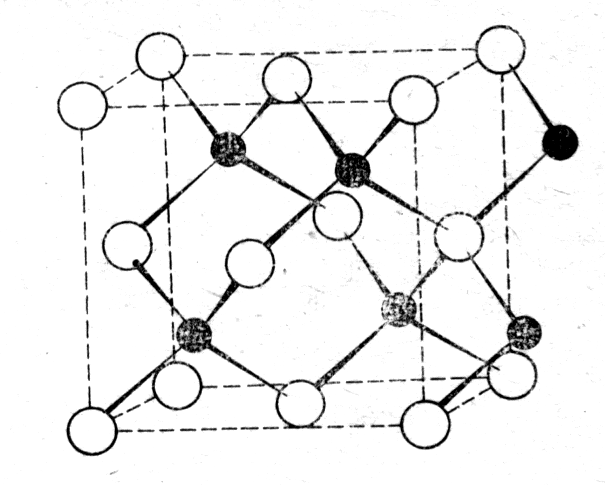
Рис.1.13 - Фрагмент структуры ВеО или MgO (структура цинковой обманки)
Таким образом, изменение свойств с увеличением главного квантового числа валентных электронов отражает изменение электронного строения оксидов металлов II группы под влиянием изменения ионной и ковалентной составляющих (табл.1.1). Из этого следует, что при близких температурах плавления MgO и СаО последний должен отличаться свойствами сильного основания, как с точки зрения теории Льюиса, так и Фулда [12], т.е. проявлять высокую химическую активность к большинству химических соединений, образуя с ними соли. Об этом свидетельствуют диаграммы фазовых равновесий СаО [4], где оксид кальция с большинством оксидов ведет себя как сильное основание, образуя по несколько легкоплавких солей. В отличие от СаО, MgO образует больше тугоплавких соединений, например форстерит, шпинель и т.п.
Таблица 1.1 – Некоторые свойства и их показатели оксидов металлов II группы
Свойство |
BeO |
МgО |
СаО |
SrO |
BaO |
Молекулярная масса, кг/кмоль |
25,012 |
40,311 |
56,078 |
103,619 |
153,339 |
Энергия кристаллической решетки, кДж/моль |
4521,7 [6] |
3935,6 [6] |
3571,3 [6] |
3257,33 [6] |
3081,485 [6] 3127,540 [6] |
Доля ионной связи (расчет по С.С. Бацанову) |
0,59 |
0,63 |
0,76 |
0,79 |
0,80 |
Температура плавления, К |
284012 [11] |
310020 [11] |
290010 [11] |
280515[11] |
2190 [6] возгоняется |
Плотность, кг/м3 |
3020 [11] |
3400 [11] |
3280 [11] |
4700 [11] |
5720 [6] |
КТР,
|
10,9 [11] 5,4 [7] |
15,5 [11] 11,7 [7], 13,4 [8] |
14,49 [11] |
13,3 [11] |
Н.д. |
Ионный радиус по Полингу, нм |
0,032 [6] |
0,065 [6] |
0,098 [6] |
0,113 [6] |
0,135 [6] |
Энтальпия образования
|
-559,131 [6] -616±2,5 [14] -6092,5 [15] |
-602,229 [6] -613,0 [14] -601,6 [15] |
-635,514 [6] -634,920,9 [15] |
-590,757 [6] -592,36 [15] |
-553,076 [6] -548,10 [15] |
Энтропия образования
|
14,109 [6] 13,770,04 [15] |
26,921 [6] 26,950,15 [15] |
39,775 [6] 38,19 [15] |
54,428 [6] 55,42 [15] |
70,338 [6] 72,05 [15] |
Теплопроводность , Вт/(мК) при 373 К для беспор. керамики |
219,807 [6] 418,68 [6] |
36,006 [6] 122 [6] |
15,240 [6] 109 [6] |
40 [6] |
6 [6] |
Модуль нормальной упругости при 298 К, беспористой керамики Е, ГПа |
356,97 [6] 290 [7] |
314 [11] 295,19 [6] 309 [5] |
181 [6] |
н.д. |
н.д. |
Модуль сдвига при 298 К, G, ГПа |
100,03 [3] 105 [16] |
133 [2], 113 [3] 130 [17] |
74 [9] |
н.д. |
н.д. |
Модуль объемной деформации при 298 К, К, ГПа |
н.д. |
167 [11] 164 [17] |
н.д. |
н.д. |
н.д. |
Прочность при сжатии беспористого вещества при 293 К, МПа (микрокрист.) |
1300 [11], 782,04 [6] 1670-2030 [13] 800 [16] |
137,2 [11] 140 [16]
|
н.д. |
н.д. |
н.д. |
Прочность при изгибе беспористого вещества при 293 К, МПа |
241 [11] 178,36 [6] 254 [17] |
89,2 [11] 89,18 [6] 110 [16] |
н.д. |
н.д. |
н.д. |
В то же время высокое сродство к кислороду (рис.1.7.), величина теплоты образования (табл.1.1) и данные таблицы 1.2, показывающие оценку устойчивости систем металл-огнеупор, позволяют сделать вывод о том, что СаО должен быть наиболее устойчив к расплавленным металлам.
Таблица 1.2 - Сравнительная оценка устойчивости систем металл-огнеупор по разности теплот образования соответствующих оксидов /19/
Огнеу-пор |
Теплота образования, кДж |
Отношение разности теплот образования на 1 г-атом кислорода огнеупора и металла к теплоте образования огнеупора, % |
|||||||||
На 1 г-моле-кулу |
На 1 г-атом кисл-орода |
Fe |
Cu |
Pb |
Cr |
Mn |
Ti |
Zr |
U |
Th |
|
CaO |
635,2 |
635,2 |
57,5 |
76,9 |
65,5 |
41,3 |
38,6 |
28,2 |
14,9 |
15,4 |
-8,8 |
MgO |
610,5 |
610,5 |
55,8 |
75,4 |
64,1 |
38,9 |
36,1 |
25,2 |
11,0 |
12,0 |
-13,2 |
BeO |
565,2 |
565,2 |
52,1 |
74,4 |
61,2 |
34,1 |
31,0 |
19,3 |
4,6 |
4,6 |
-2,2 |
Al2O3 |
1687,4 |
562,3 |
52,2 |
73,9 |
60,9 |
33,6 |
30,5 |
18,9 |
4,0 |
4,2 |
-3,4 |
SiO2 |
870,9 |
435,4 |
37,9 |
66,4 |
50,6 |
14,4 |
10,5 |
-4,8 |
-19,0 |
-23,4 |
-58,6 |
ZrO2 |
1080,7 |
540,3 |
50,0 |
73,0 |
59,3 |
31,0 |
27,8 |
15,5 |
0 |
5,8 |
-7,8 |
Именно эти свойства оксида кальция создают предпосылки для применения его в качестве высокоэффективного огнеупора.

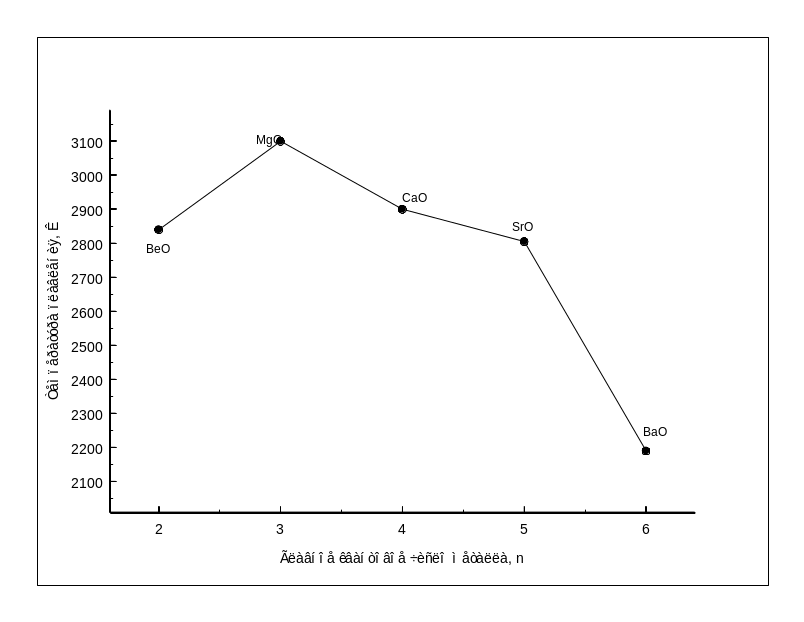
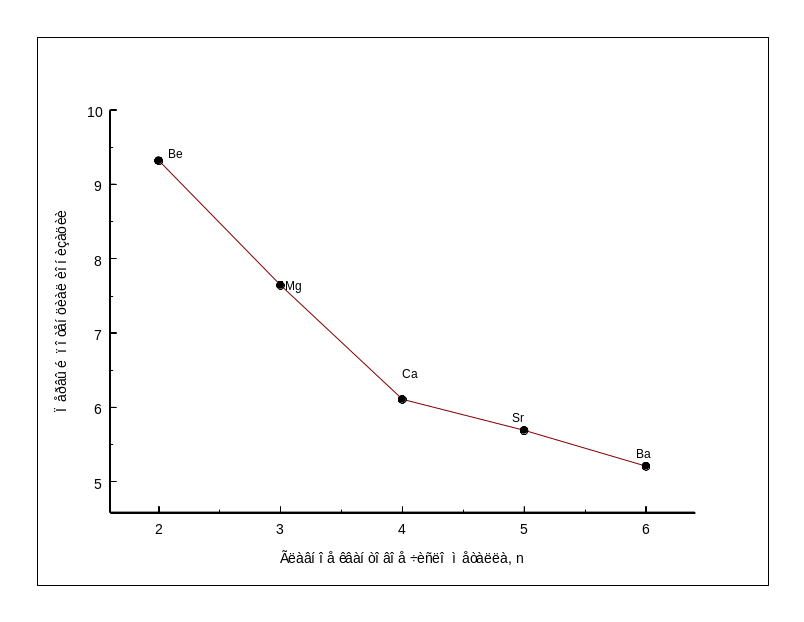
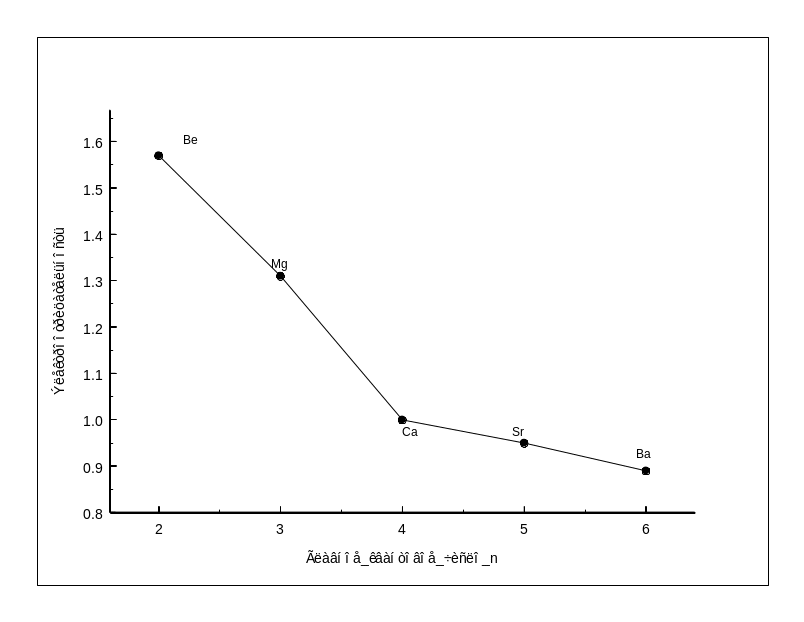
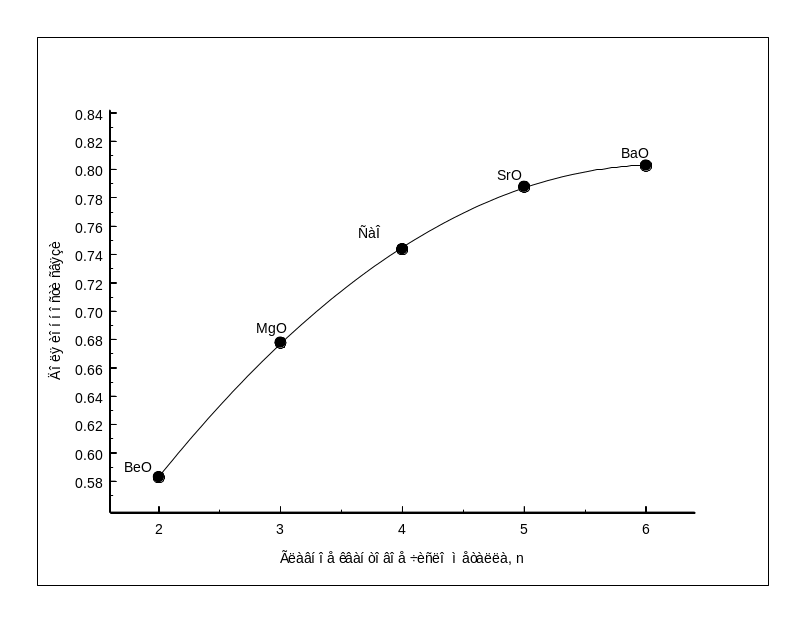
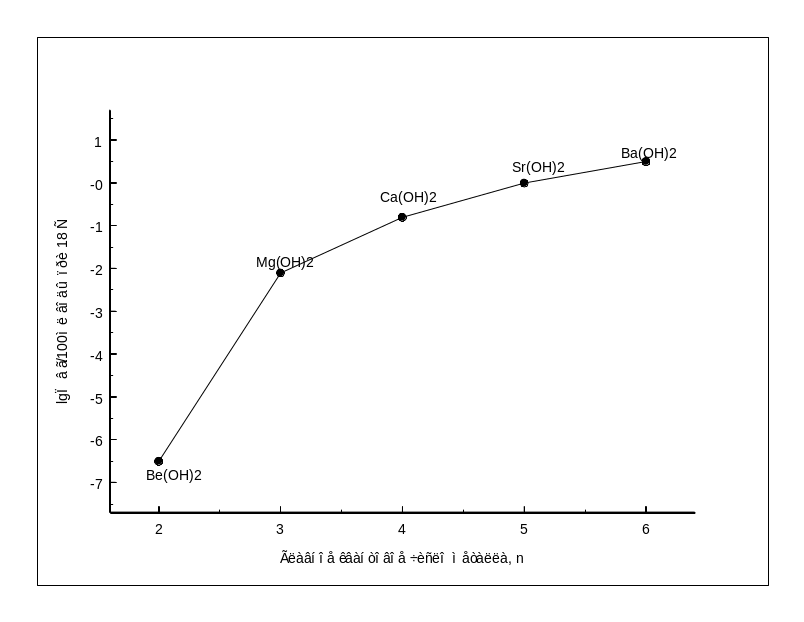
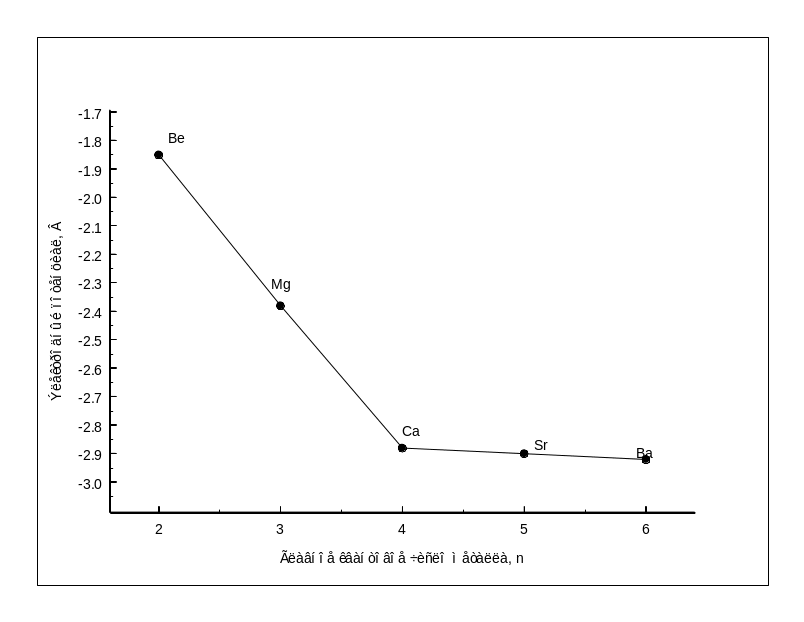
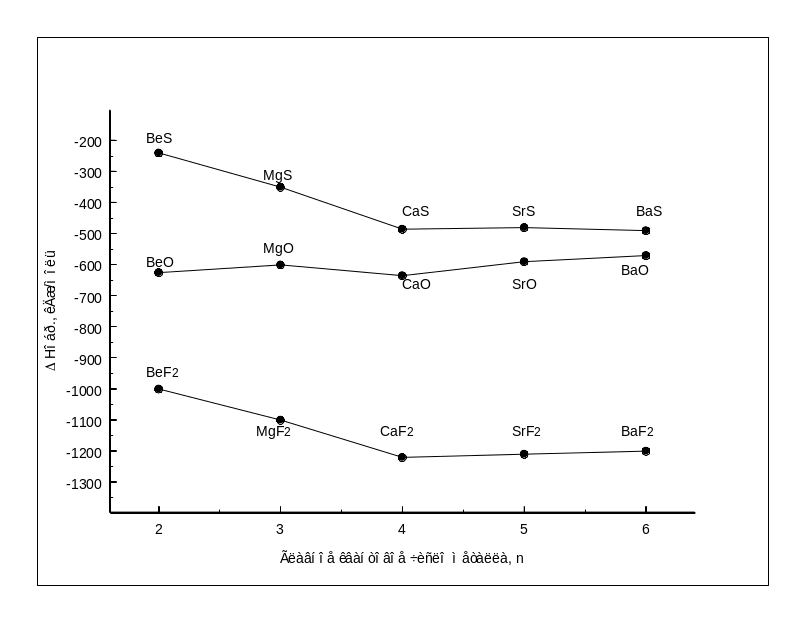 Рис.1.7-
Зависимость сродства металлов II
группы к кислороду, сере, фтору от
главного квантового числа металла
Рис.1.7-
Зависимость сродства металлов II
группы к кислороду, сере, фтору от
главного квантового числа металла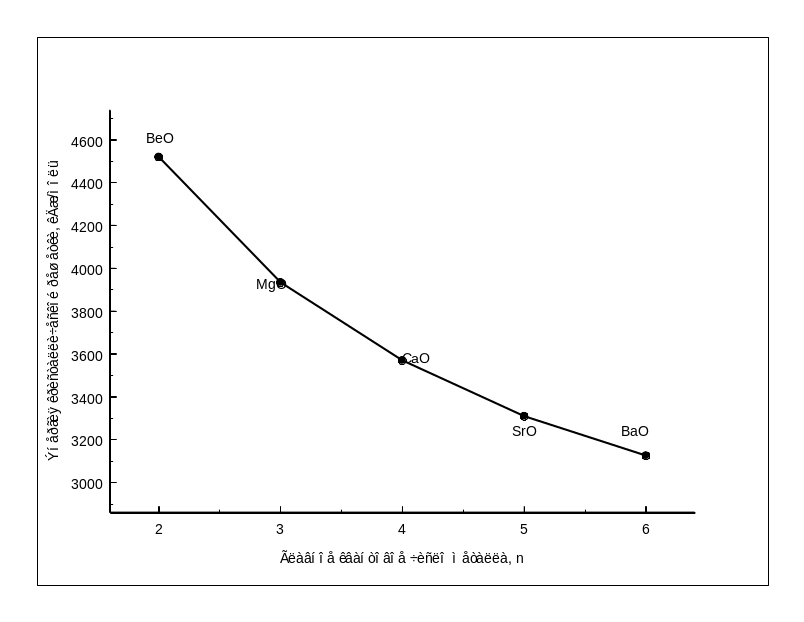 Рис.1.8-
Зависимость энергии кристаллической
решетки МеО II
группы от главного квантового числа
металла
Рис.1.8-
Зависимость энергии кристаллической
решетки МеО II
группы от главного квантового числа
металла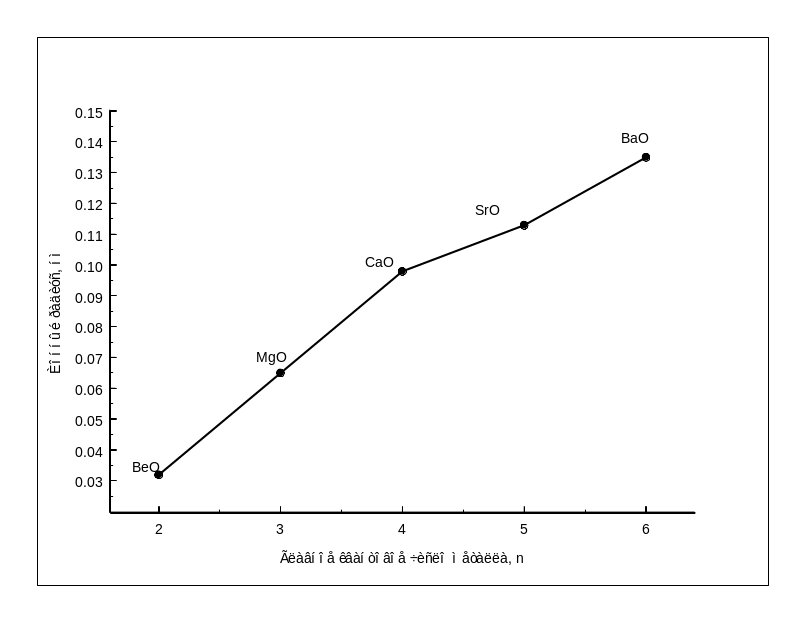 Рис.1.9-
Зависимость ионного радиуса от главного
квантового числа металла II
группы
Рис.1.9-
Зависимость ионного радиуса от главного
квантового числа металла II
группы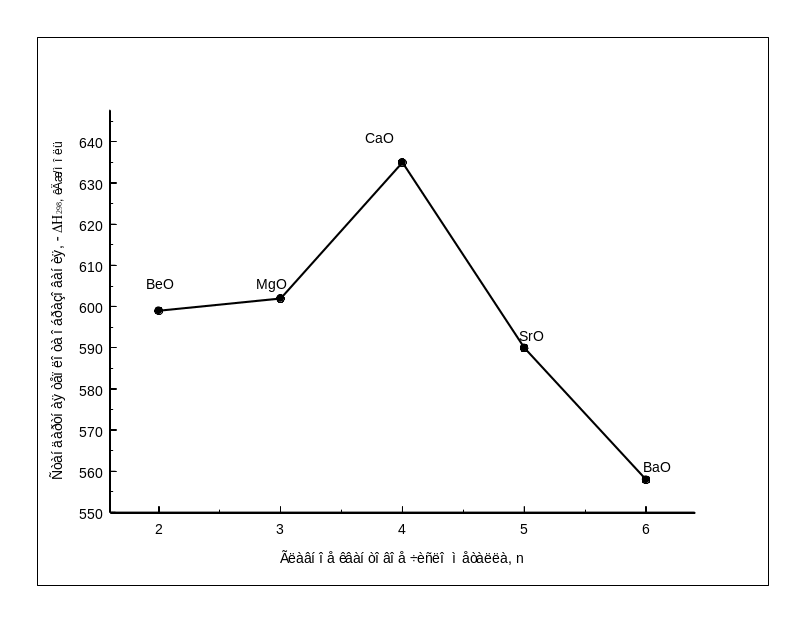 Рис.1.10-
Зависимость стандартной теплоты
образования оксида металла II
группы от главного квантового числа
металла.
Рис.1.10-
Зависимость стандартной теплоты
образования оксида металла II
группы от главного квантового числа
металла.