
- •© Зимон а.Д., , Евтушенко а.М., Крашенинникова и.Г. Учебно-практическое пособие – м., мгуту, 2004.
- •Часть II 5
- •Раздел первый Часть II
- •Основные закономерности адсорбции
- •4.1. Адсорбция как поверхностное явление
- •4.2. Фундаментальное уравнение адсорбции Гиббса
- •4.3. Причины и механизм адсорбции
- •4.4. Уравнения Генри, Фрейндлиха, Ленгмюра
- •Адсорбция на границе жидкость — газ
- •5.1. Особенности адсорбции на границе жидкости с газовой средой
- •5.2. Адсорбция пав
- •5.3. Зависимость адсорбции от концентрации адсорбтива
- •5.4. Предельная адсорбция
- •5.5. Гидрофобные взаимодействия
- •5.6. Методы определения поверхностного натяжения
- •Адсорбция на твердых поверхностях
- •6.1. Особенности адсорбции на поверхности твердых тел
- •6.2 Адсорбция газов
- •6.3. Адсорбция жидкости
- •6.4. Адсорбция ионов
- •6.5. Ионообменная адсорбция
- •Иониты, применяемые в пищевой промышленности
- •6.6. Применение адсорбционных процессов
- •Двойной электрический слой и электрокинетические явления
- •7.1. Поверхностная энергия и заряд поверхности
- •7.2. Двойной электрический слой
- •7.3. Электрокинетические явления
- •Применение электрофореза и электроосмоcа
- •7.4. Электрофоретическая подвижность
- •Тесты для самостоятельной проработки
- •Ответы на тесты для самостоятельной проработки
- •Вопросы для самоконтроля
- •Список литературы
- •Физическая и коллоидная химия. Коллоидная химия Раздел первый
- •Часть II.
- •Учебно-практическое пособие
4.2. Фундаментальное уравнение адсорбции Гиббса
Адсорбция относится к поверхностным явлениям и протекает самопроизвольно. Концентрация веществ на поверхности раздела фаз происходит до достижения равновесия между процессами адсорбции и десорбции (см. рис. 4.1).
Для нахождения условий протекания самопроизвольного равновесного процесса обратимся к основам химической термодинамики. Адсорбция идет самопроизвольно, когда имеет место уменьшение энергии Гиббса, т.е. dG < 0. Согласно условию (2.1) для изобарно-изотермического процесса в отсутствие изменений площади поверхности раздела фаз и заряда поверхности (dТ = 0, dp = 0, dB = 0 и dq = 0) можно записать
![]() .
(4.6)
.
(4.6)
Для однокомпонентной системы получим
dG < Δμdn, или ΔG < ΔμΔn. (4.7)
Если обозначить химический потенциал i-гo компонента в объеме адсорбтива через (μiV ) и на поверхности адсорбента (μiВ), то согласно согласно (4.7) изменение энергии Гиббса определится по формуле
ΔG < (μiB – μiV )dni . (4.8)
Для самопроизвольных процессов (dG < 0) из условия (4.8) получим
μiV > μiB. (4.9)
Химический потенциал является фактором интенсивности любого физико-химического процесса, в том числе и адсорбции. Согласно условию (4.9) химический потенциал вещества в объеме μiV превышает химический потенциал этого же вещества на поверхности μiB.
Процесс адсорбции будет протекать до тех пор, пока будут достигнуты равновесные условия, т.е. до достижения состояния, когда ΔG = 0, что, согласно условию (4.8), соответствует равенству химических потенциалов адсорбтива и адсорбата (μiV = μiB). В условиях равновесия скорости адсорбции и десорбции становятся равными.
На основании этого адсорбцию можно определить как процесс выравнивания химического потенциала, приводящего к росту концентрации компонентов на границе раздела фаз по сравнению с их концентрацией в объеме.
Для изобарно-изотермического процесса, когда dT = 0, dp = 0, dq = 0, с учетом всех компонентов системы в условиях равновесия (dG = 0) из уравнения (2.1) получим
μidni + σdB = 0. (4.10)
Это уравнение связывает поверхностное натяжение с процессами, протекающими на границе раздела фаз. В нем экстенсивные величины стоят под знаком дифференциала (dni и dВ). Для однородной функции первой степени относительно экстенсивных величин можно воспользоваться теоремой Эйлера, которая позволяет интегрировать это уравнение при постоянных значениях коэффициентов интенсивных величин (μi и σ) при дифференциалах.
Напомним, что согласно теореме Эйлера любая однородная функция степени k, имеющая непрерывные частные производные, удовлетворяет равенству
f/x(x,y,z)x + f/y(x,y,z)y + f/z(x,y,z)z = kf(x,y,z).
Однородной называется функция, если при умножении всех ее аргументов на множитель она приобретает этот же множитель в k-й степени, т.е. f(tx1, ..., txm) = fk(x1, ..., xm).
Таким образом, если состав поверхностного слоя не изменяется, что соответствует конечному значению В и ni, то можно записать
![]() .
(4.10, a)
.
(4.10, a)
Полный дифференциал от всех переменных уравнения (4.10, а) выглядит так:
![]() .
(4.11)
.
(4.11)
Из уравнения (4.11) вычтем уравнение (4.10), в результате получим
![]() .
(4.12)
.
(4.12)
Используя уравнение (4.4) для выражения адсорбции, вместо формулы (4.12) можно записать
![]() ;
;
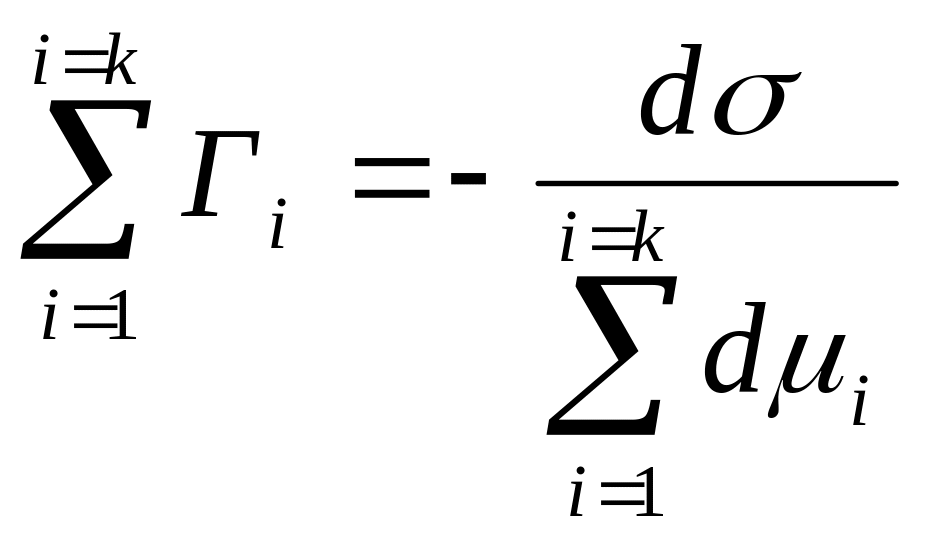 .
(4.13)
.
(4.13)
Это уравнение называют фундаментальным уравнением адсорбции Гиббса.
В случае адсорбции только одного компонента уравнение (4.13) упрощается:
–dσ = Гdμ; Г = –dσ/dμ. (4.14)
Уравнения (4.13) и (4.14) справедливы для всех видов адсорбции; они показывают, что при адсорбции происходит самопроизвольное снижение удельной свободной поверхностной энергии (поверхностного натяжения) по мере изменения химического потенциала.
Адсорбция определяется избытком концентрации адсорбива с и обусловлена изменением поверхностного натяжения σ, которое зависит от температуры (см. параграф 2.3). Все величины, определяющие адсорбцию, взаимосвязаны, т.е. Г = f(c, σ, Т). Для нахождения этой зависимости воспользуемся уравнениями (4.13), в которых dσ характеризует уменьшение поверхностного натяжения в результате самопроизвольного процесса при адсорбции; Гi определяет адсорбцию количественно, а dμi показывает возможность и интенсивность самопроизвольного процесса в результате изменения химического потенциала.
Используя уравнения (4.13), определим адсорбцию одного i-гo компонента из смеси веществ:
Гi = – (дσ/дμi)μ1, …, μi–1, μi+1, ..., μk. (4.15)
Адсорбция одного компонента i согласно условию (4.15) есть частная производная от поверхностного натяжения (удельной свободной поверхностной энергии) по изменению химического потенциала при постоянных химических потенциалах других компонентов.
Для нахождения химического потенциала воспользуемся следующим соотношением:
μi = μi0 + RTlnc, (4.16)
где μi, μi0 – равновесный и стандартный химический потенциал адсорбтива; с – концентрация адсорбтива.
Если адсорбтив является сильным электролитом и его концентрация значительна, то вместо концентрации в этом уравнении следует использовать активность а.
Дифференцируя уравнение (4.16) и учитывая, что μi0 есть величина постоянная, получим
dμi = RTdlnc = RT(dc/c). (4.17)
Заменив dμi в уравнении (4.13), подставив полученное выражение для dμi в уравнение (4.17), получим
Г = – (с/RT)(dσ/dc). (4.18)
Уравнение (4.18) непосредственно следует из фундаментального уравнения адсорбции Гиббса (4.14) и характеризует влияние на избыточную адсорбцию концентрации адсорбтива и температуры, а также изменение поверхностного натяжения (удельной свободной поверхностной энергии) в зависимости от концентрации адсорбтива. Оно справедливо для всех видов адсорбции.
Таким образом, уравнение (4.18) связывает между собой основные параметры, характеризующие адсорбцию (Г, с, Т и σ), и определяет результат самопроизвольного процесса за счет снижения поверхностного натяжения. Обычно рассматривают зависимость адсорбции от концентрации адсорбтива, что и будет использовано в дальнейшем.
