
- •Изложите товарные и определяющие технологию свойства формальдегида, область применения.
- •Укажите сырьевые источники для получения формальдегида.
- •Кратко охарактеризуйте современные промышленные способы получения формальдегида.
- •Опишите физико-химические закономерности процесса получения формальдегида путем каталитического окисления метанола кислородом воздуха. Определите тип процесса.
- •Изобразите и опишите аппаратурно-технологическую схему.
- •Рассчитайте и составьте материальный баланс процесса получения choh.
- •Работа над ошибками.
- •Литература
№1
Изложите товарные и определяющие технологию свойства формальдегида, область применения.
Формальдегид (муравьиный альдегид) НСНО – бесцветный газ с резким раздражающим специфическим запахом (т.конд. -19 ºС; т. кип. -21ºС; т. пл. 92ºС). Хорошо растворим в воде. В водных растворах находится почти исключительно в гидратированной форме – в виде метиленгликоля СН2(ОН)2 и продуктов его полимеризации – полиоксиметиленгликолей НО(СН2О)nН (n колеблется от 8 до 100). Чем концентрированнее водный раствор формальдегида, тем больше в нем полиоксиметиленгликолей.
Водный раствор формальдегида (33-40% об. НСНО) выпускается под названием формалина. При хранении может полимеризоваться. Для предотвращения полимеризации формальдегида в растворе формалина обычно стабилизируют метиловым спиртом, содержание которого колеблется от 6 до 13% вес.
Формальдегид является протоплазматическим ядом. В очень малых концентрациях он раздражает слизистые оболочки глаз, а в несколько большей концентрации действует раздражающе на слизистые оболочки дыхательных путей; вдыхание формальдегида высокой концентрации может привести к гнойному воспалению легких. Формальдегид вызывает также раздражение кожи, переходящее в воспалительный процесс. Предельно допустимая концентрация паров формальдегида в воздухе производственных помещений 1 мг/м3. [1]
Формальдегид обладает высокой реакционной способностью. Восстанавливается Н2 в присутствии многих металлов или их оксидов (например, Ni, Pt, Cu) до метанола; окисляется HNO3, KMnO4 до муравьиной кислоты или CO2 и H2O; осаждает многие металлы (Ag, Pt, Bi и др.) из растворов и солей, окисляясь при этом в муравьиную кислоту.
С альдегидами в
присутствии сильных щелочей формальдегид
вступает в так называемую перекрестную
реакцию Канниццаро (C6H5CHO
+ HCHO
![]() C6H5CH2OH
+ НCOONa); с ацетальдегидом
в присутствии Ca(OH)2
образует пентаэритрит, в паровой фазе
при 285ºС – акролеин: под действие
алкоголятов AL или Mg
формальдегид подвергается
диспропорционированию с образованием
метилфомиата.
C6H5CH2OH
+ НCOONa); с ацетальдегидом
в присутствии Ca(OH)2
образует пентаэритрит, в паровой фазе
при 285ºС – акролеин: под действие
алкоголятов AL или Mg
формальдегид подвергается
диспропорционированию с образованием
метилфомиата.
Реакция формальдегида со спиртами в присутствии сильных кислот приводов к ацеталям (формалям), с H2S – к циклич. тритиану, с HCN в присутствии щелочей – к циангидриду:
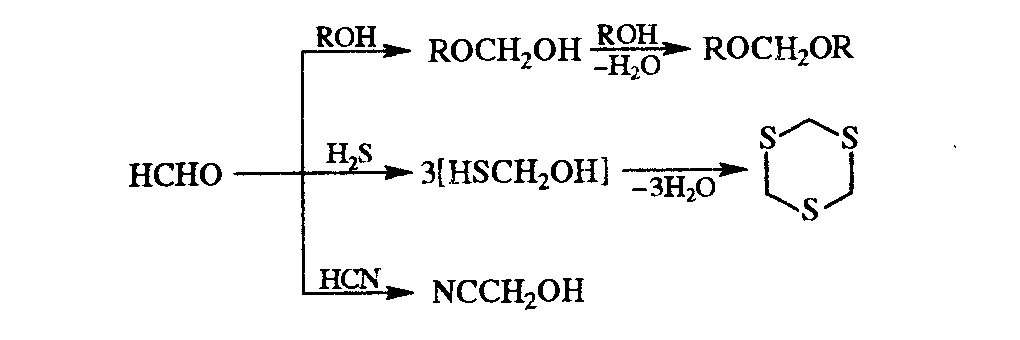
Формальдегид присоединяется к олефинам в присутствии кислых катализаторов с образованием 1,3-дигликолей и 1,3-диоксанов, реакция формальдегида с изобутиленом дает изопрен, жидкофазная конденсация с пропиленом в присутствии BF3 или H2SO4 – бутадиен. Из формальдегида и кетена в промышленности получают β-пропиолактон.
Ароматические соединения (бензол, анилин, толуол) образуют с формальдегидом соответствующие диарилметаны: в присутствии HCI бензол хлорметилируется формальдегидом по Блана реакции, образуя бензилхлорид; с фенолами в присутствии кислот или оснований формальдегид конденсируется с образованием орто- и пара-метилольных производных, которые далее превращаются в феноло-формальдегидные смолы. Продукты конденсации формальдегида с фенол- и нафталинсульфокислотами используют как дубильные вещества. [2]
Формальдегид, открытый Гофманом в 1867 г., применяется сейчас как исходный продукт в многочисленных органических синтезах, а также как дезинфицирующее и дезинсекционное средство.
В наибольших количествах формальдегид потребляется для производства полимеризационных и поликонденсационных полимеров (полиформальдегида, феноло-формальдегидных, карбамидных, меламиновых и др. смол), являющихся основой пластических масс, пленкообразующих и пропитывающих материалов, клеев и т. д. Применяется для производства антиокислительных, антикоррозионных, противозадирных, моющих присадок. За последние годы формальдегид начали использовать для получения изопрена и бутадиена – важных мономеров промышленности синтетических каучуков. На основе формальдегида можно получать синтетические смолы для химических волокон (нейлон, капрон), этиленгликоль, глицерин, пентаэритрит, красители, взрывчатые вещества, фармацевтические препараты и т. п. [1]
ПДК в атмосферном воздухе 0,003 мг/м3, в воздухе рабочей зоны 0,5 мг/м3, в воде водоемов хозяйственно-бытового пользования 0,05мг/л. Температура самовоспламенения 430ºС, КПВ при 20ºС 7-72%об. [2]
№2
