
- •3. Химическая реакция
- •3.1. Тепловой эффект химической реакции. Сохранение и превращение энергии при химических реакциях
- •1. На выбор экзо- или эндотермического процесса по предложенным уравнениям реакций
- •2. На подсчет теплового эффекта реакции по термохимическому уравнению
- •1) Выделяется 129,6 кДж теплоты 3) выделяется 64,8 кДж теплоты
- •2) Поглощается 129,6 кДж теплоты 4) поглощается 64,8 кДж теплоты
- •3. Расчетные задачи по термохимическим уравнениям
- •1) Выделяется 1665 кДж теплоты; 3) поглощается 1665 кДж теплоты;
- •2) Выделяется 3330 кДж теплоты; 4) поглощается 3330 кДж теплоты.
- •3.2. Понятие о скорости химической реакции. Факторы, влияющие на изменение скорости химической реакции
- •1. На зависимость скорости химической реакции от различных факторов
- •2. На вскрытие причин зависимости скорости химической реакции от различных факторов
- •1) Увеличение числа столкновений молекул; 3) уменьшение энергии активации процесса;
- •2) Увеличение энергии молекул; 4) изменение концентрации веществ.
- •1) Увеличении температуры; 2) увеличении давления; 3) увеличении концентрации хлора?
- •3. На закон действующих масс
- •4. На правило Вант-Гоффа
- •1) 9 Раз; 2) 6 раз; 3) 3 раза; 4) 1,5 раза.
- •3.3. Обратимые необратимые химические реакции. Химическое равновесие и условия его смещения
- •1. На выбор обратимой или необратимой реакции по предложенным уравнениям или заданным условиям
- •2. На применение принципа Ле Шателье
- •3.4. Электролитическая диссоциация неорганических и органических кислот, щелочей, солей. Степень диссоциации. Понятие о протолитах
- •1. На выбор процесса диссоциации из числа предложенных уравнений
- •2. На ступенчатость процесса диссоциации
- •3. На степень электролитической диссоциации
- •1) Кремниевая 2) сероводородная 3) хлороводородная 4) уксусная
- •4. На смещение химического равновесия процесса диссоциации
- •5. На знание протолитической теории кислот и оснований
- •1) Температуры 2) концентрации 3) объема раствора 4) природы кислоты
- •1) Уменьшается 2) изменяется периодически 3) не изменяется 4) усиливается
- •3.5. Реакции ионного обмена
- •1. На определение реагентов и продуктов по сокращенному ионному уравнению и наоборот
- •2. На определение возможности протекания реакции между ионами
- •3. На подсчет суммы коэффициентов в сокращенном ионном или молекулярном уравнении реакции
- •1) Разложения 2) замещения 3) нейтрализации 4) соединения
- •3.6. Реакции окислительно-восстановительные
- •1. На выбор окислительно-восстановительной реакции
- •2. На определение в реакции окислителя и восстановителя, их степеней окисления, процессов окисления и восстановления
- •3. На определение коэффициентов перед формулами окислителя и восстановителя и подсчет суммы коэффициентов в уравнениях окислительно-восстановительных реакций
- •4. На установление соответствия между реагентами и схемами превращений элементов
- •3.7. Гидролиз солей
- •1. На определение солей, подвергающихся или не подвергающихся гидролизу
- •2. На определение среды раствора при гидролизе солей
- •1) Ацетата алюминия 2) нитрата калия 3) сульфата алюминия 4) фосфата натрия
- •1) Ацетата калия 2) сульфата цинка 3) карбоната натрия 4) нитрата калия
- •3. На определение типа гидролиза и продуктов взаимодействия солей с водой
- •1) Ацетат натрия 2) сульфат калия 3) фосфат калия 4) хлорид железа (III)
- •1) Фиолетовый 2) синий 3) красный 4) зеленый
- •1) Нитрита калия 2) гипохлорита натрия 3) хлорида железа (II) 4) нитрата калия
- •3.8. Электролиз расплавов и растворов солей
- •1. На определение процессов, протекающих на катоде и аноде
- •2. На определение продуктов электролиза
- •1) Сульфата натрия 2) бромида натрия 3) нитрата натрия 4) перхлората натрия
- •3. На написание уравнений электролиза
- •1) Азот 2) водород 3) медь 4) кислород
- •3.9. Виды коррозии металлов. Способы предупреждения коррозии
- •1. На определение коррозионно-активных компонентов
- •2. На определение процессов, протекающих при коррозии металлов, и способов защиты от коррозии
- •1) Свинца 2) олова 3) цинка 4) алюминия
- •1) Фосфор 2) хром 3) кремний 4) углерод
- •2.15. Особенности химического и электронного строения алканов, алкенов, алкинов. Понятие о циклических углеводородах
- •2.16. Ароматические углеводороды. Бензол, его электронное строение. Гомологи бензола
- •3.10. Характерные реакции углеводородов различных классов
- •3Нссн (Синтез н.Д. Зелинского, б.А. Казанского, 1922 г.).
- •1. Реакции замещения
- •2. Реакции присоединения
- •1) Этаном 2) этеном 3) этином 4) этандиолом
- •1) Муравьиный альдегид 2) уксусный альдегид 3) муравьиная кислота 4) этиловый спирт
- •3. Реакции полимеризации
- •1) Пропен 2) пропан 3) циклопропан 4) циклогексан
- •1) Изомеризации 2) поликонденсации 3) полимеризации 4) гидратации
- •4. Реакции окисления (горения)
- •1) Бутен-2 2) этанол 3) этилен 4) бутадиен-1,2
- •1) Пропан 2) бутадиен-1,3 3) аминокапроновая кислота 4) метиламин
- •3.11. Механизмы реакций замещения и присоединения в органической химии. Правило в. В. Марковникова
- •1. На механизм реакций присоединения и правило в. В. Марковникова
- •1) Пропанол-1 2) пропанол-2 3) уксусная кислота 4) ацетон
- •2. На механизм реакций замещения
- •1) Этанол 2) этаналь 3) этилен 4) этилацетат
- •1) Пропен 2) гексан 3) циклопропан 4) 2,3-диметилбутан
- •1) Пропеном 2) бензолом 3) гексаном 4) метилциклопентаном
- •3.12. Реакции, подтверждающие взаимосвязь углеводородов и кислородсодержащих органических соединений
- •1. На получение кислородсодержащих органических соединений из углеводородов
- •2. На получение углеводородов из кислородсодержащих органических соединений
- •1) Этаналя 2) этана 3) этанола 4) хлорэтана
- •3. На установление генетических связей между углеводородами и кислородсодержащими органическими соединениями
- •1) Этилен 2) хлорэтан 3) 1,2-дихлорэтан 4) хлорвинил
- •3.13. Реакции, подтверждающие взаимное влияние атомов в молекулах органических соединений
- •– Образование сложных эфиров (этерификация):
- •1. На правила ориентации в бензольном ядре
- •2. На взаимное влияние функциональных групп и углеводородных радикалов
- •1) Усиливаются 2) ослабевают 3) не изменяются
- •4) Сначала увеличиваются, потом уменьшаются
- •1) Пропаном 2) бензолом 3) этанолом 4) анилином
1. На получение кислородсодержащих органических соединений из углеводородов
Пример 1 (блок А). Промышленное получение этанола основано на реакции
1) C2H5ONa + H2O C2H5OH + NaOH 2) CH3CHO + H2 C2H5OH
3) CH3COOC2H5 + H2O CH3COOH + C2H5OH 4) C2H4 + H2O C2H5OH
В промышленности этанол получают по реакции гидратации этилена в кислой среде. Правильный ответ: 4.
2. На получение углеводородов из кислородсодержащих органических соединений
Пример 1 (блок А). В схеме превращений этанол Х бутан веществом Х является 1) бутанол-1 2) бромэтан 3) этан 4) этилен
Для получения бутана из этанола необходимо удлинить углеродную цепь атомов. Это можно сделать, используя реакцию Вюрца, заключающуюся во взаимодействии галогенопроизводных углеводородов с металлическим натрием. Таким промежуточным веществом будет бромэтан, который можно получить по реакции спирта с бромоводородом. Правильный ответ: 2.
Пример 2 (блок А). Бутадиен-1,3 образуется из
1) Этаналя 2) этана 3) этанола 4) хлорэтана
Бутадиен-1,3 можно получить по реакции Лебедева путем дегидрирования и дегидратации этилового спирта. Правильный ответ: 3.
3. На установление генетических связей между углеводородами и кислородсодержащими органическими соединениями
Пример 1 (блок С). Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
CH3COOK
CH3COOH
этилацетат
ацетат натрия
![]() А этин.
А этин.
Укажите условия протекания реакций.
Правильный ответ:
1) CH3COOK
+ H2SO4
![]() CH3COOH
+ KHSO4
CH3COOH
+ KHSO4
2) CH3COOH
+ C2H5OH
![]() CH3COOC2H5
+ H2O
CH3COOC2H5
+ H2O
3) CH3COOC2H5 + NaOH CH3COONa + C2H5OH
4) CH3COONa + NaOH Na2CO3 + CH4
5) 2CH4 C2H2 + 3H2
Задания для самостоятельной работы
3.96. В ходе реакции этанола с соляной кислотой в присутствии H2SO4 образуется
1) Этилен 2) хлорэтан 3) 1,2-дихлорэтан 4) хлорвинил
3.97. В схеме превращений С2Н4
![]() Х1
Х1
![]() Х2 относительная молекулярная
масса вещества Х2 равна ___. (Запишите
число с точностью до целых).
Х2 относительная молекулярная
масса вещества Х2 равна ___. (Запишите
число с точностью до целых).
3.98. Приведите уравнения реакций,
с помощью которых можно осуществить
следующие превращения: этен
Х1 этаналь
![]() Х2
Х2
![]() Х3
Х3
![]() Х4
Х4
3.99. Напишите уравнения реакций получения этилацетата из метана. Укажите условия протекания реакций.
3.100. Напишите уравнения реакций,
с помощью которых можно осуществить
следующие превращения: метанол
бромметан этан
![]() Х
Х
![]() Y
Y
Укажите условия протекания реакций и названия соединений Х и Y.
3.13. Реакции, подтверждающие взаимное влияние атомов в молекулах органических соединений
Материал о взаимном влиянии атомов в молекулах углеводородов и кислородсодержащих органических соединений см. выше в соответствующих разделах.
Амины
Амины – органические производные аммиака, которые можно рассматривать как продукты замены атомов водорода аммиака на углеводородные радикалы.
В зависимости от числа замещенных на радикалы атомов водорода аммиака различают
первичные
(R–NН2),
вторичные (R–NН–R′)
и третичные (![]() )
амины.
)
амины.
Это создает дополнительные возможности для изомерии.
Способы получения анилина
Восстановление ароматических нитросоединений. Эта реакция впервые осуществлена Н. Н. Зининым (1842 г.). Действуя на нитробензол сульфидом аммония, он получил анилин:
С6Н5NO2 + 3(NH4)2S C6H5NH2 + 6NH3 + 3S + 2H2O
Для превращения нитросоединений в амины могут быть использованы и другие восстановители – олово, цинк, железо в кислой среде, хлори олова (II), водород в присутствии катализаторов. Восстановление можно осуществить и электрохимически.
Наибольшее значение в технике получило восстановление нитробензола в анилин действием железа в присутствии соляной кислоты. Суммарное уравнение процесса:
4С6Н5NO2
+ 9Fe
+ 4H2O
![]() 4C6H5NH2
+ 3Fe3O4
4C6H5NH2
+ 3Fe3O4
В лабораторных условиях восстановление нитросоединений до аминов часто проводят оловом и соляной кислотой: C6H5NO2 + 3Sn + 7HCl C6H5NH2HCl + 3SnCl2 + 2H2O
Амины – органические основания. Являясь органическими производными аммиака, амины сохраняют главные его химические особенности. В частности, подобно аммиаку, амины проявляют свойства оснований. Это обнаруживается по щелочной реакции их водных растворов: NH3 + H2O ⇄ NH4+ + OH–; RNH2 + H2O ⇄ RNH3+ + OH–
По мере роста углеводородного остатка растворимость аминов в воде уменьшается. Поэтому высшие амины уже не дают щелочной реакции. Однако и они сохраняют свойства оснований: способны образовывать с кислотами соли. Причина основных свойств аминов – неподеленная электронная пара атома азота, за счет которой атом азота аммиака или аминов может присоединять ион водорода с образованием солей аммония или алкиламмония:
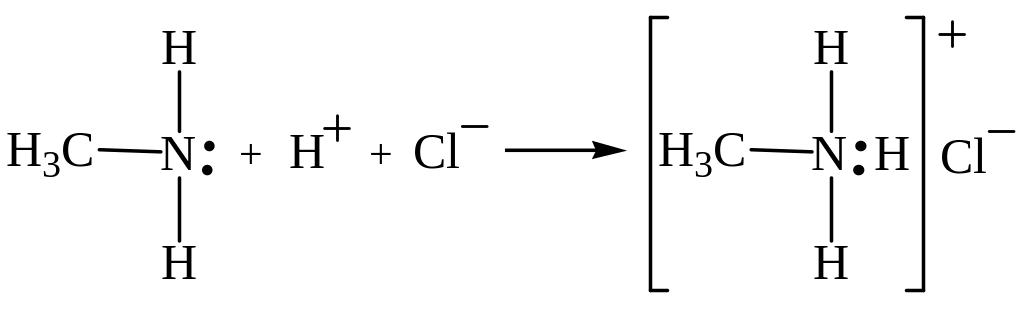
метиламин хлорид метиламмония
Природа радикала, с которым связана аминогруппа, оказывает влияние на основные свойства аминов. Чем больше атомов углерода в радикале, тем слабее основные свойства аминов. Ароматические амины являются гораздо более слабыми основаниями, чем амины жирного ряда. Это объясняется тем, что неподеленная электронная пара аминного азота взаимодействует с подвижными -электронами ароматического ядра. Распределение электронной плотности в анилине можно условно выразить так:
 или
или

Аминогруппа в свою очередь оказывает влияние на ароматическое ядро: как электронодонорный заместитель она повышает электронную плотность в ядре, облегчая тем самым реакции электрофильного замещения. Анилин легко бромируется, образуя уже при действии бромной воды триброманилин.
Аминокислоты
Аминокислоты – соединения, содержащие в молекуле амино- и карбоксильную группы.
-Аминокислоты, т. е. аминокислоты, имеющие в молекуле аминогруппу у второго атома углерода (в -положении), играют роль структурных элементов в белках. Приведем формулы некоторых аминокислот:
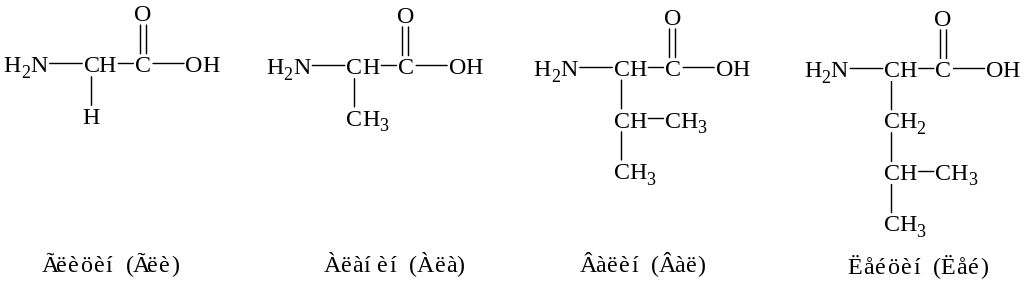
Химические свойства аминокислот
1. Амфотерность. В водных растворах молекулы аминокислот находятся в виде биполярных ионов, проявляющих как кислотные, так и основные свойства:

2. Образование пептидов:

3. Реакции по карбоксильной группе
– Реакции солеобразования – взаимодействие с металлами, основными оксидами, щелочами (аналогично карбоновым кислотам).
