
- •3. Химическая реакция
- •3.1. Тепловой эффект химической реакции. Сохранение и превращение энергии при химических реакциях
- •1. На выбор экзо- или эндотермического процесса по предложенным уравнениям реакций
- •2. На подсчет теплового эффекта реакции по термохимическому уравнению
- •1) Выделяется 129,6 кДж теплоты 3) выделяется 64,8 кДж теплоты
- •2) Поглощается 129,6 кДж теплоты 4) поглощается 64,8 кДж теплоты
- •3. Расчетные задачи по термохимическим уравнениям
- •1) Выделяется 1665 кДж теплоты; 3) поглощается 1665 кДж теплоты;
- •2) Выделяется 3330 кДж теплоты; 4) поглощается 3330 кДж теплоты.
- •3.2. Понятие о скорости химической реакции. Факторы, влияющие на изменение скорости химической реакции
- •1. На зависимость скорости химической реакции от различных факторов
- •2. На вскрытие причин зависимости скорости химической реакции от различных факторов
- •1) Увеличение числа столкновений молекул; 3) уменьшение энергии активации процесса;
- •2) Увеличение энергии молекул; 4) изменение концентрации веществ.
- •1) Увеличении температуры; 2) увеличении давления; 3) увеличении концентрации хлора?
- •3. На закон действующих масс
- •4. На правило Вант-Гоффа
- •1) 9 Раз; 2) 6 раз; 3) 3 раза; 4) 1,5 раза.
- •3.3. Обратимые необратимые химические реакции. Химическое равновесие и условия его смещения
- •1. На выбор обратимой или необратимой реакции по предложенным уравнениям или заданным условиям
- •2. На применение принципа Ле Шателье
- •3.4. Электролитическая диссоциация неорганических и органических кислот, щелочей, солей. Степень диссоциации. Понятие о протолитах
- •1. На выбор процесса диссоциации из числа предложенных уравнений
- •2. На ступенчатость процесса диссоциации
- •3. На степень электролитической диссоциации
- •1) Кремниевая 2) сероводородная 3) хлороводородная 4) уксусная
- •4. На смещение химического равновесия процесса диссоциации
- •5. На знание протолитической теории кислот и оснований
- •1) Температуры 2) концентрации 3) объема раствора 4) природы кислоты
- •1) Уменьшается 2) изменяется периодически 3) не изменяется 4) усиливается
- •3.5. Реакции ионного обмена
- •1. На определение реагентов и продуктов по сокращенному ионному уравнению и наоборот
- •2. На определение возможности протекания реакции между ионами
- •3. На подсчет суммы коэффициентов в сокращенном ионном или молекулярном уравнении реакции
- •1) Разложения 2) замещения 3) нейтрализации 4) соединения
- •3.6. Реакции окислительно-восстановительные
- •1. На выбор окислительно-восстановительной реакции
- •2. На определение в реакции окислителя и восстановителя, их степеней окисления, процессов окисления и восстановления
- •3. На определение коэффициентов перед формулами окислителя и восстановителя и подсчет суммы коэффициентов в уравнениях окислительно-восстановительных реакций
- •4. На установление соответствия между реагентами и схемами превращений элементов
- •3.7. Гидролиз солей
- •1. На определение солей, подвергающихся или не подвергающихся гидролизу
- •2. На определение среды раствора при гидролизе солей
- •1) Ацетата алюминия 2) нитрата калия 3) сульфата алюминия 4) фосфата натрия
- •1) Ацетата калия 2) сульфата цинка 3) карбоната натрия 4) нитрата калия
- •3. На определение типа гидролиза и продуктов взаимодействия солей с водой
- •1) Ацетат натрия 2) сульфат калия 3) фосфат калия 4) хлорид железа (III)
- •1) Фиолетовый 2) синий 3) красный 4) зеленый
- •1) Нитрита калия 2) гипохлорита натрия 3) хлорида железа (II) 4) нитрата калия
- •3.8. Электролиз расплавов и растворов солей
- •1. На определение процессов, протекающих на катоде и аноде
- •2. На определение продуктов электролиза
- •1) Сульфата натрия 2) бромида натрия 3) нитрата натрия 4) перхлората натрия
- •3. На написание уравнений электролиза
- •1) Азот 2) водород 3) медь 4) кислород
- •3.9. Виды коррозии металлов. Способы предупреждения коррозии
- •1. На определение коррозионно-активных компонентов
- •2. На определение процессов, протекающих при коррозии металлов, и способов защиты от коррозии
- •1) Свинца 2) олова 3) цинка 4) алюминия
- •1) Фосфор 2) хром 3) кремний 4) углерод
- •2.15. Особенности химического и электронного строения алканов, алкенов, алкинов. Понятие о циклических углеводородах
- •2.16. Ароматические углеводороды. Бензол, его электронное строение. Гомологи бензола
- •3.10. Характерные реакции углеводородов различных классов
- •3Нссн (Синтез н.Д. Зелинского, б.А. Казанского, 1922 г.).
- •1. Реакции замещения
- •2. Реакции присоединения
- •1) Этаном 2) этеном 3) этином 4) этандиолом
- •1) Муравьиный альдегид 2) уксусный альдегид 3) муравьиная кислота 4) этиловый спирт
- •3. Реакции полимеризации
- •1) Пропен 2) пропан 3) циклопропан 4) циклогексан
- •1) Изомеризации 2) поликонденсации 3) полимеризации 4) гидратации
- •4. Реакции окисления (горения)
- •1) Бутен-2 2) этанол 3) этилен 4) бутадиен-1,2
- •1) Пропан 2) бутадиен-1,3 3) аминокапроновая кислота 4) метиламин
- •3.11. Механизмы реакций замещения и присоединения в органической химии. Правило в. В. Марковникова
- •1. На механизм реакций присоединения и правило в. В. Марковникова
- •1) Пропанол-1 2) пропанол-2 3) уксусная кислота 4) ацетон
- •2. На механизм реакций замещения
- •1) Этанол 2) этаналь 3) этилен 4) этилацетат
- •1) Пропен 2) гексан 3) циклопропан 4) 2,3-диметилбутан
- •1) Пропеном 2) бензолом 3) гексаном 4) метилциклопентаном
- •3.12. Реакции, подтверждающие взаимосвязь углеводородов и кислородсодержащих органических соединений
- •1. На получение кислородсодержащих органических соединений из углеводородов
- •2. На получение углеводородов из кислородсодержащих органических соединений
- •1) Этаналя 2) этана 3) этанола 4) хлорэтана
- •3. На установление генетических связей между углеводородами и кислородсодержащими органическими соединениями
- •1) Этилен 2) хлорэтан 3) 1,2-дихлорэтан 4) хлорвинил
- •3.13. Реакции, подтверждающие взаимное влияние атомов в молекулах органических соединений
- •– Образование сложных эфиров (этерификация):
- •1. На правила ориентации в бензольном ядре
- •2. На взаимное влияние функциональных групп и углеводородных радикалов
- •1) Усиливаются 2) ослабевают 3) не изменяются
- •4) Сначала увеличиваются, потом уменьшаются
- •1) Пропаном 2) бензолом 3) этанолом 4) анилином
2. На механизм реакций замещения
Пример 1 (блок А). Первой стадии реакции хлорирования этана соответствует уравнение
1) C2H6 + Cl2 C2H4Cl2 + 2HCl 3) C2H6 CH3 + CH3
2) C2H6 C2H5 + H 4) Cl2 Cl + Cl
Реакция хлорирования алканов проходит по радикальному механизму, первой стадией которого является инициирование цепи. Свободные радикалы образуются путем разрыва связи в молекуле хлора, т.к. эта связь менее прочная, чем связь С–Н в молекуле этана. Правильный ответ: 4.
Пример 2 (блок А). В результате реакции,
схема которой СН3–СН2–СН3
+ Br2
![]() ,
преимущественно образуется
,
преимущественно образуется
1) 1-бромпропан 2) 2-бромпропан 3) 1,2-дибромпропан 4) 2,2-дибромпропан
В реакциях радикального замещения в первую очередь замещаются атомы водорода у третичного атома углерода, затем у вторичного и, наконец, у первичного. Правильный ответ: 2.
Задания для самостоятельной работы
3.85. Присоединение бромоводорода к пропену приводит к образованию
1) 1-бромпропана 2) 2-бромпропана 3) 1-бромпропена 4) 2-бромпропена
3.86. В схеме превращений ![]()
веществом Х2 является
1) СН3–СНBr–СН3 2) СН3–СН(OH)–СН3 3) СН3–СН2–СН2–Br 4) СН3–СН2–СН3
3.87. 2-хлорбутан образуется в процессе
1) присоединения хлора к бутену-1
2) взаимодействия бутена-2 с хлором при освещении
3) присоединения хлороводорода к бутену-2
4) присоединения избытка хлороводорода к бутину-2
3.88. При взаимодействии ![]()
с хлороводородом Cl– присоединяется к атому углерода 1) 1 2) 2 3) 3 4) 4.
3.89. В схеме превращений этин Х уксусная кислота веществом Х является
1) Этанол 2) этаналь 3) этилен 4) этилацетат
3.90. Продуктом взаимодействия 2-бромпропана с металлическим натрием является
1) Пропен 2) гексан 3) циклопропан 4) 2,3-диметилбутан
3.91. Жидкий углеводород, молекула которого при жестком ультрафиолетовом освещении присоединяет шесть атомов хлора, а в присутствии железа с хлором образует монохлорпроизводное, называется
1) Пропеном 2) бензолом 3) гексаном 4) метилциклопентаном
3.92. Этиламин не взаимодействует с веществом, формула которого
1) HCl 2) O2 3) H2 4) H2O
3.93. Присоединение HCl к метилпропену, в соответствии с правилом В. В. Марковникова, приводит к образованию 1) 2-метил-2-хлорпропана 3) 2-метил-2-хлорпропена
2) 2-метил-1-хлорпропана 4) 2-метил-1-хлорпропена
3.94. С водородом могут реагировать все вещества ряда
1) толуол, пропин, гексан 3) изопрен, бензол, ацетальдегид
2) этаналь, пропан, пропадиен 4) бутадиен, бензол, этанол
3.95. Этиламин реагирует с 1) HCl 2) NaOH 3) H2 4) CH4
3.12. Реакции, подтверждающие взаимосвязь углеводородов и кислородсодержащих органических соединений
Спирты
Спирты – производные углеводородов, в молекулах которых один или несколько атомов водорода замещены на гидроксильные группы.
В зависимости от числа гидроксилов в молекуле спирты делятся на следующие группы.
1. Одноатомные: СН3–СН2–ОН – этанол (этиловый спирт); СН2=СН–СН2–ОН – пропен-2-ол-1 (аллиловый спирт); С6Н5–СН2–ОН – бензиловый спирт
2. Двухатомные (гликоли): НО–СН2–СН2–ОН этандиол-1,3 (этиленгликоль)
3. Трехатомные:  пропантриол-1,2,3
(глицерин)
пропантриол-1,2,3
(глицерин)
4. Многоатомные.
В зависимости от характера углеводородного радикала спирты делят на ациклические (насыщенные и ненасыщенные), циклические и ароматические.
Одноатомные спирты
Способы получения
1. Гидратация алкенов в кислой среде (этот способ получения спиртов имеет большое промышленное значение – этим способом получают спирты из газов крекинга).
СН2=СН2 + Н2О СН3–СН2ОН (первичный спирт);
этанол
 (вторичный
спирт);
(вторичный
спирт);
пропанол-2
 (третичный
спирт);
(третичный
спирт);
2-метилпропанол-2
Условия: прямая гидратация – смесь алкенов с водяным паром пропускают над фосфатным катализатором (Н3РО4 на алюмосиликате с солями кадмия, меди, кобальта), 300С, 8 МПа.
2. Получение из галогенопроизводных (гидролиз):
R–Cl
+ KOH
![]() R–OH
+ KCl
R–OH
+ KCl
3. Восстановление альдегидов и кетонов:
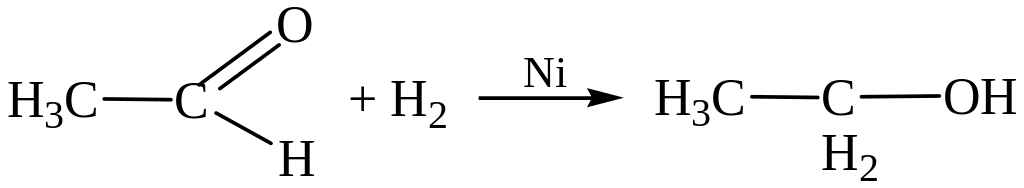
Этаналь (ацетальдегид) Этанол
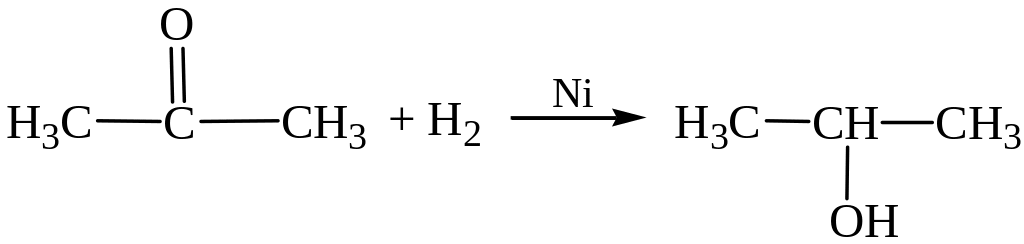
Пропанон (ацетон) Пропанол-2
Физические свойства спиртов существенно зависят от строения углеводородного радикала и положения гидроксильной группы. Первые представители гомологического ряда спиртов – жидкости, высшие спирты – твердые вещества. Для низших нормальных (неразветвленных) первичных спиртов разность температур кипения гомологов составляет примерно 20°С.
Метанол, этанол и пропанол смешиваются с водой во всех соотношениях. С ростом молекулярной массы растворимость спиртов в воде резко падает. Высшие спирты практически не растворимы в воде. Низшие спирты обладают характерным алкогольным запахом, запах средних гомологов сильный и часто неприятный. Высшие спирты практически не имеют запаха. Третичные спирты обладают особым характерным запахом плесени.
Низшие гликоли – вязкие бесцветные жидкости, не имеющие запаха; хорошо растворимы в воде и этаноле, обладают сладким вкусом.
С введением в молекулу второй гидроксильной группы происходит повышение относительной плотности и температуры кипения спиртов. Например, плотность этиленгликоля при 0°С – 1,13, а этилового спирта – 0,81.
Водородные связи. Спирты обладают аномально высокими температурами кипения по сравнению с представителями таких классов органических соединений, как алканы, галогеналканы, тиолы, амины, Например, температура кипения этанола 78°С, тогда как хлорэтана – 13°С, а этана – –88,5°С. Эти различия объясняются особенностями строения спиртов. Атом кислорода в молекуле спирта обладает большой электроотрицательностью и оттягивает на себя электронную плотность -связей связанных с ним атомов, в частности атома водорода. Связь О–Н в молекуле спирта сильно поляризована RОН. Электронная плотность на атоме водорода оказывается пониженной. Поэтому он может взаимодействовать с неподеленной парой электронов атома кислорода другой молекулы спирта. Между двумя молекулами возникает нековалентная водородная связь. Молекулы, связанные между собой водородными связями, образуют ассоциаты:

Образование ассоциатов как бы увеличивает массу спирта и понижает его летучесть. Прочность водородных связей невелика, но для их разрыва при переходе молекулы из жидкого в газообразное состояние требуется дополнительная энергия. Этим и объясняются высокие температуры кипения спиртов. Наибольшую склонность к образованию водородных связей проявляют первичные спирты. Для вторичных и особенно третичных спиртов способность к ассоциации уменьшается, поскольку образованию водородных связей препятствуют разветвленные углеводородные радикалы.
Химические свойства. Главные химические свойства спиртов обусловливает функциональная группа – гидроксильная. Связи С–О и О–Н поляризованы, причем отрицательным полюсом диполя является атом кислорода как более электроотрицательный. На атомах С и Н имеются частичные положительные заряды: R–С+Н2О–Н+.
Такой электронный характер гидроксильной группы предопределяет ее склонность к реакциям гетеролитического типа, в ходе которых может разрываться связь С–О или О–Н.
1. Кислотно-основные свойства. Спирты – практически нейтральные вещества, они не изменяют окраски индикаторов, не вступают в реакцию ни с водными растворами щелочей, ни с разбавленными кислотами. Однако в определенных реакциях спирты все же проявляют свойства очень слабых кислот т оснований, т.е. являются амфотерными, подобно воде.
Кислотные свойства у спиртов выражены несколько слабее, чем у воды. Алкильные группы отталкивают от себя электронную плотность, снижая тем самым легкость отщепления иона Н+, поэтому у третичных спиртов кислотные свойства выражены слабее, чем у вторичных и первичных. Если же в радикал спирта ввести электроноакцепторный атом (например, атом F), то кислотные свойства усиливаются.
Кислотные свойства спиртов проявляются в реакции их со щелочными металлами, в ходе которых образуются соли – алкоголяты: 2СН3–СН2–ОН + 2 Na 2СН3–СН2–ОNа + Н2.
этилат натрия
Алкоголяты имеют характер солей очень слабых кислот и сильных оснований, поэтому подвергаются гидролизу: С2Н5ОNa + Н2О ⇄ С2Н5ОН + NаОН.
Основные свойства. Оснóвным центром в молекуле спирта является атом кислорода, обладающий неподеленной парой электронов. При действии на спирты сильными кислотами происходит присоединение иона водорода к атому кислорода гидроксильной группы и образуется неустойчивый алкилоксониевый ион:

Хлорид этилоксония
2. Замещение гидроксильной группы галогеном с образованием галогенопроизводных (алкилгалогенидов): С2Н5–ОН + НСl С2Н5–Сl + Н2О.
3. Образование сложных эфиров (реакция этерификации). При действии на спирты минеральной или органической кислоты образуются сложные эфиры:
СН3–СН2–ОН + НОSО3Н(конц.) ⇄ СН3–СН2–О–SО3Н + Н2О
Этанол Серная Этилсерная
кислота кислота

Взаимодействие спиртов с карбоновыми кислотами протекает по механизму нуклеофильного замещения. В качестве нуклеофила выступает молекула спирта, атакующая атом углерода карбоксильной группы кислоты, несущий частичный положительный заряд. Отличительной особенностью этой реакции является то, что замещение протекает у атома углерода, находящегося в состоянии sр2-гибридизации. Механизм таких реакций будет рассмотрен в разделе «Карбоновые кислоты».
4. Дегидратация спиртов. В определенных условиях спирты способны терять воду. В качестве водоотнимающих средств можно применять концентрированную серную или фосфорную кислоты. Легче всего дегидратируются третичные спирты, труднее – первичные.
Спирты дегидратируются также при пропускании их паров над нагретым твердым катализатором (силикагель, каолин, оксид алюминия и др.).
В зависимости от условий реакция может идти по одному из двух направлений. В жестких условиях (при высокой температуре) каждая молекула спирта теряет молекулу воды с образованием алкена (внутримолекулярная дегидратация). Механизм реакции рассмотрен выше:
![]()
При менее жестких условиях молекула воды отщепляется от двух молекул спирта и образуется простой эфир (межмолекулярная гидратация):

5. Реакции окисления. Спирты окисляются легче, чем углеводороды, причем в первую очередь окислению подвергается атом углерода, при котором находится гидроксильная группа. Первичные и вторичные спирты окисляются легче третичных, что обусловлено наличием атомов водорода у атома углерода, связанного с гидроксильной группой.
Окисление спиртов обычно проводят сильными окислителями – хромовой смесью или смесью перманганата калия с серной кислотой.
В зависимости от природы спирта, а также условий проведения реакции могут образовываться различные продукты.
Первичные спирты окисляются до альдегидов, а затем до карбоновых кислот:
(5С3Н7ОН + 2КMnO4 + 3H2SO4 5C2H5CHO + 2MnSO4 + K2SO4 + 8H2O;
5С2Н5СНО + 2КMnO4 + 3H2SO4 5C2H5CОOН + 2MnSO4 + K2SO4 + 3H2O)
Вторичные спирты окисляются до кетонов:

Третичные спирты при действии сильных окислителей окисляются с разрывом связей С–С и образованием кетонов и кислот, содержащих в молекуле меньше атомов углерода, чем исходный спирт.
6. Каталитическое дегидрирование. Превращение спиртов в альдегиды и кетоны можно осуществить также дегидрированием – пропусканием паров спиртов над нагретым металлическим катализатором, например медью, цинком или серебром, при 300С без добавления окислителя:

Многоатомные спирты
Двухатомные спирты называют гликолями или диолами, трехатомные – глицеринами или триолами. Положение гидроксильных групп указывают цифрами:
НО–СН2–СН2–ОН этиленгликоль (этандиол-1,2)
НО–СН2–СН(ОН)–СН2–ОН глицерин (пропантриол-1,2,3)
Многоатомные спирты хорошо растворимы в воде, плохо – в органических растворителях, имеют высокие температуры кипения. Могут быть получены теми же способами, что и одноатомные спирты.
Этиленгликоль. Наиболее важным из диолов является этиленгликоль.
Химические свойства этиленгликоля и вообще многоатомных спиртов напоминают свойства одноатомных спиртов. В зависимости от того, участвует ли в реакции одна гидроксильная группа или обе, получаются два ряда соединений. Гликоли так же, как и одноатомные спирты, не изменяют окраски индикаторов, но этиленгликоль обладает несколько более кислотным характером, чем этиловый спирт. Увеличение числа гидроксильных групп усиливает кислотный характер. Гликоляты образуются под действием не только щелочных металлов, но и гидроксидов тяжелых металлов. Например, при реакции этиленгликоля со свежеосажденным гидроксидом меди получается гликолят меди (синего цвета). Причиной легкого образования гликолятов тяжелых металлов является не только повышенная кислотность этиленгликоля, но и повышенная устойчивость этих гликолятов, имеющих характер внутрикомплексных соединений:
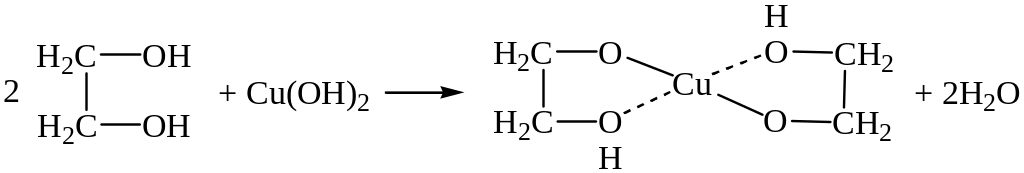
Гидроксильные группы в этиленгликоле могут замещаться на атомы галогена. При действии хлоро- или бромоводорода замещается одна гидроксильная группа и получается галогенгидрин:
HO–CH2–СН2–ОН + НСl С1–СН2–СН2–ОН этиленхлоргидрин
Вторая гидроксильная группа замещается труднее – под действием РС15 или SOC12.
Глицерин (пропантриол-1,2,3) – важнейший представитель многоатомных спиртов. По свойствам глицерин подобен этиленгликолю: легко дает с гидроксидами тяжелых металлов глицераты, например, глицерат меди – внутрикомплексное соединение ярко-синего цвета:

Гидроксильные группы обмениваются на галоген, глицерин образует простые и сложные эфиры, например эфир глицерина и азотной кислоты – тринитрат глицерина (тринитроглицерин), неточно называемый «нитроглицерином»:

Фенолы
Фенолы – гидроксилсодержащие ароматические соединения, в молекулах которых гидроксильная группа связана непосредственно с углеродным атомом бензольного ядра (в отличие от ароматических спиртов). По числу гидроксильных групп в молекуле различают одно-, двух- и многоатомные фенолы:




фенол о-крезол гидрохинон пирогаллол
(гидрокси- (2-гидрокси- (1,4-дигидрокси- (1,2,3-тригидрокси-
бензол) толуол) бензол) бензол)
Химические свойства фенолов. По строению фенолы аналогичны спиртам. Однако гидроксильная группа и бензольное ядро оказывают сильное влияние друг на друга, что обусловливает специфичность свойств фенолов, отличающих их от ароматических спиртов.
Для характеристики важнейших свойств фенолов рассмотрим отдельно реакции фенольной гидроксильной группы и бензольного ядра.
Реакции, обусловленные гидроксильной группой
1. Кислотные свойства. Фенолы, как и спирты, не изменяют окраски индикаторов, но кислотные свойства у них выражены хотя и слабо, но сильнее, чем у спиртов и воды.
Более сильный кислотный характер фенолов по сравнению со спиртами объясняется влиянием бензольного ядра. Неподеленная пара электронов атома кислорода вступает в сопряжение с -электронами бензольного ядра. В результате электронная плотность кислородного атома перемещается частично на связь кислород–углерод, увеличивая при этом электронную плотность в орто- и пара-положениях в бензольном ядре. Электронная пара связи кислород–водород сильнее притягивается к атому кислорода, способствуя тем самым созданию большего положительного заряда на атоме водорода гидроксильной группы и, следовательно, отщеплению этого водорода в виде иона. В отличие от спиртов фенолы реагируют с водными растворами щелочей, образуя феноляты (поэтому простейший фенол был назван «карболовой кислотой»): С6Н5ОН + NаОН ⇄ С6Н5ОNа + Н2О.
фенолят натрия
Феноляты подобно всем солям слабых кислот и сильных оснований легко гидролизуются, водные растворы их имеют сильнощелочную реакцию. Под действием.сильных кислот гидролиз протекает необратимо: C6H5ONa + H2SО4 С6Н5ОН + NaHSO4.
По сравнению с кислотами кислотные свойства у фенолов выражены чрезвычайно слабо. Так, фенол значительно слабее угольной кислоты (примерно в 3000 раз), поэтому фенолы нерастворимы в водных растворах карбонатов щелочных металлов и не разлагают солей угольной кислоты. Наоборот, при действии на фенолят угольной кислотой образуется свободный фенол:
C6H5ONa + СО2 + Н2О С6Н5ОН + NaHCO3.
2. Образование простых эфиров. Простые эфиры фенолов образуются аналогично простым эфирам спиртов: С6Н5–ONa + СН3Br С6Н5–О–СН3 + NaBr.
метилфениловый эфир
3. Образование сложных эфиров. В отличие от спиртов фенолы не образуют сложных эфиров при непосредственном действии кислот. Обычно их получают при действии на фенолы хлорангидридами или ангидридами кислот.
4. Обмен гидроксильной группы на галоген. Эта реакция практически не идет, так как связь С–О в фенолах прочнее, чем в спиртах.
Реакции бензольного ядра
1. Реакции электрофильного замещения. Гидроксильная группа относится к числу наиболее сильных орто-пара-ориентантов (см. методичку «Теоретические основы органической химии. Углеводороды»). Реакции электрофильного замещения водорода в бензольном ядре для фенолов протекают значительно легче и в более мягких условиях, чем для бензола. Так, при действии бромной водой происходит замещение трех атомов водорода в ядре на бром, образовавшийся трибромфенол выпадает в виде белого осадка (качественная реакция на фенолы); при действии хлора на фенол образуются о- и п-хлорфенолы:
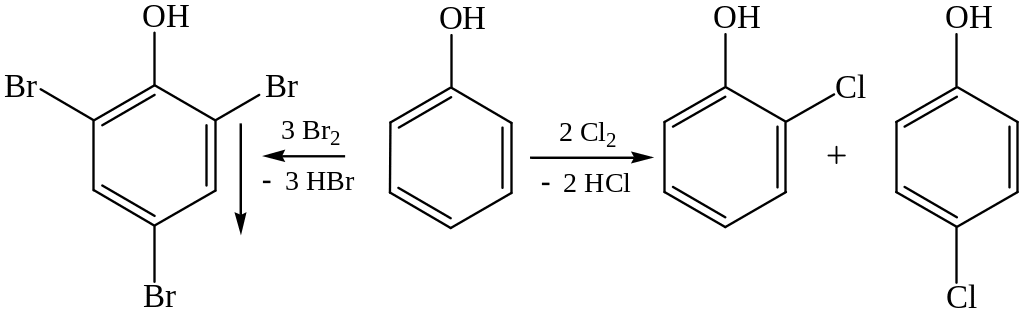
2,4,6-трибромфенол о-хлорфенол п-хлорфенол
Нитрование фенола идет в более мягких условиях, чем нитрование бензола. При действии разбавленной азотной кислоты при комнатной температуре образуется смесь о- и п-нитрофенолов; конечным продуктом нитрования является 2,4,6-тринитрофенол, называемый также пикриновой кислотой:

пикриновая кислота о-нитрофенол п-нитрофенол
2. Конденсация с альдегидами. Данная реакция может протекать как в кислой, так и в щелочной средах за счет атомов водорода орто- и пара-положений. Одной из практически важных реакций является конденсация фенола с формальдегидом с образованием гидроксиметилфенолов:
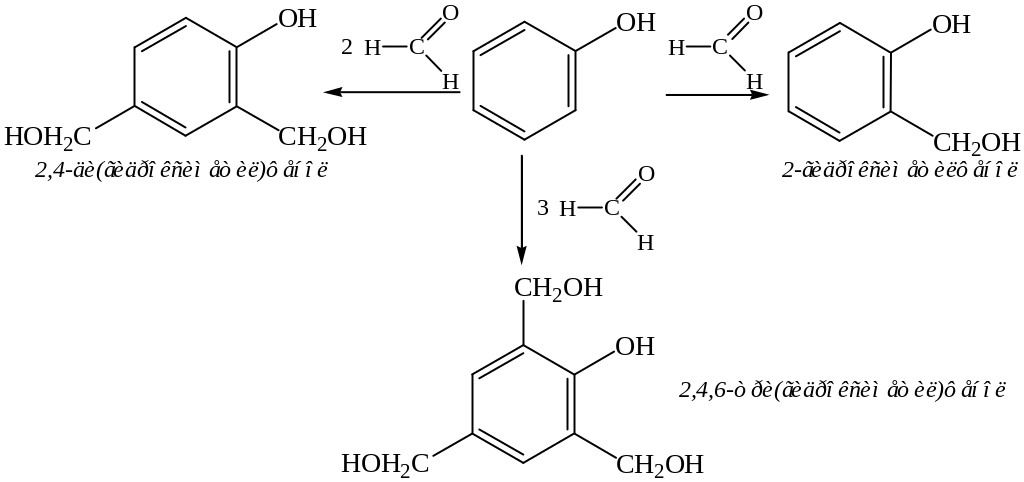
При дальнейшей конденсации образуются высокомолекулярные соединения – фенолоформальдегидные смолы.
3. Гидрирование. Фенолы хорошо гидрируются в присутствии никелевого катализатора, давая соответствующие циклогексанолы: С6Н5–ОН + 3Н2 С6Н11–ОН
Фенол дает с 1–2%-ным раствором хлорида железа (III) фиолетовое окрашивание, в результате образования комплексного иона: 6С6Н5ОН + FеСl3 Н3[Fе(ОС6Н5)6] + 3НСl.
Крезолы СН3–С6Н4–ОН образуют соединения синего цвета, многоатомные фенолы – соединения различных оттенков. Эту реакцию используют для качественного обнаружения фенолов.
Альдегиды и кетоны
Функциональной группой этого типа соединений является карбонильная группа С=О. Соединения, в молекулах которых карбонильная группа связана с одним органическим радикалом и с атомом водорода, называют альдегидами, а соединения, в которых карбонильная группа связана с двумя углеводородными радикалами, – кетонами:
![]()
альдегид альдегидная группа кетон кетогруппа
Способы получения
1. Получение из спиртов. При окислении первичные спирты дают альдегиды, вторичные – кетоны (см. выше).
2. Окисление углеводородов кислородом воздуха в присутствии катализаторов. Способ используется в промышленности и приобретает все большее значение. Так получают, например, уксусный альдегид из этилена:
СН2=СН2
+ ½ О2
![]() СН3–СНО.
СН3–СНО.
3. Из ацетиленовых углеводородов гидратацией по Кучерову (см. выше).
Строение карбонильной группы. Физические свойства. В функциональной группе альдегидов и кетонов связь между углеродом и кислородом двойная (четырехэлектронная). Углеродный атом карбонильной группы находится в состоянии sр2-гибридизации, и его конфигурация плоская. Вследствие большей электроотрицательности атома кислорода по сравнению с атомом углерода связь С=О сильно поляризована за счет смещения электронной плотности -связи к атому кислорода:

Полярность карбонильной группы сказывается на физических свойствах. Многие альдегиды и кетоны хорошо растворимы в воде. Низшие (ацетальдегид, ацетон) смешиваются с водой во всех отношениях. Температуры кипения низших членов ряда альдегидов и кетонов выше, чем у соответствующих углеводородов, и ниже, чем у соответствующих спиртов; последнее указывает на отсутствие у оксосоединений существенной молекулярной ассоциации.
Химические свойства. Полярность карбонильной группы определяет и ее реакции. Эта группа – одна из наиболее реакционноспособных. Характерные реакции альдегидов: 1) присоединение и полимеризация по двойной связи карбонильной группы; 2) конденсация; 3) атом О влияет на атом Н, соединенный с карбонильной группой, в результате чего он легко окисляется (примерами окисления альдегидов могут быть качественные реакции – реакции серебряного зеркала и Троммера); 4) замещение атома кислорода карбонильной группы азотсодержащими группировками. Кетоны менее реакционноспособны, чем альдегиды. Окисление их происходит в присутствии сильных окислителей в жестких условиях и сопровождается разрывом С–С-связи, при этом образуются карбоновые кислоты с меньшим числом атомов С в молекуле. Реакция серебряного зеркала для кетонов отрицательна.
Реакции присоединения
1. Присоединение водорода с образованием спиртов. Из альдегидов получаются первичные спирты, а из кетонов – вторичные:

2. Присоединение воды. Формальдегид легко присоединяет воду при комнатной температуре (без катализатора), образуя гидрат формальдегида:

Реакции полимеризации. При полимеризации альдегидов происходит разрыв двойной связи карбонильной группы, и атом кислорода одной молекулы соединяется с атомом карбонильного углерода другой. В результате могут образоваться линейные и циклические продукты. Так, при стоянии водного раствора формальдегида постепенно выделяется белый осадок. Это линейный полимер – параформ, или полиоксиметилен:
nСН2=О + Н2О НОСН2[–ОСН2–]n–2ОСН2ОН (n = 10–50).
При нагревании параформа до 150°С выделяется мономерный формальдегид.
Реакции конденсации. Пример реакции конденсации формальдегида с фенолом приведен в разделе «Фенолы».
Окисление альдегидов и кетонов. Альдегиды и кетоны по-разному относятся к действию окислителей. Наличие в альдегидной группе атома водорода обусловливает легкость окисления этой группы до карбоксильной, в результате получается кислоты с тем же числом углеродных атомов в молекуле.
Альдегиды окисляются слабыми
окислителями, например аммиачным
раствором оксида серебра, содержащим
комплексное соединение – гидроксид
диамминсеребра [Ag(NH3)2]OH.
При этом на поверхности стеклянного
сосуда образуется слой металлического
серебра – «серебряное зеркало»: R–СНО
+ 2[Аg(NН3)2]ОН
![]() R–СООН + 2Аg
+ 4NН3 + Н2О
R–СООН + 2Аg
+ 4NН3 + Н2О
Аммиачный раствор оксида серебра получают по реакциям:
AgNO3 + NH3H2O AgOH + NH4NO3; AgOH + 2NH3H2O [Ag(NH3)2]OH + 2H2O
Эту реакцию, а также реакции восстановления свежеосажденного гидроксида меди (реакция Троммера) используют для идентификации альдегидов (кетоны этих реакций не дают):
R–CHO + 2Cu(OH)2 R–COOH + 2CuOH + H2O; 2CuOH Cu2O + H2O
голубой желтый красный
Кетоны окисляются значительно труднее, они устойчивы к слабым окислителям и к кислороду воздуха. Действие на кетоны сильных окислителей в жестких условиях приводит к разрыву углерод-углеродной связи, в результате образуется смесь разных продуктов (кислот и кетонов) с меньшим числом атомов углерода, чем исходный кетон. По продуктам окисления можно судить о строении исходного кетона:

Карбоновые кислоты
Карбоновые кислоты – соединения, содержащие в молекуле карбоксильную группу –СООН.
Водород карбоксильной группы обладает кислотным характером. По числу карбоксильных групп различают одноосновные (монокарбоновые), двухосновные (дикарбоновые) и многоосновные (поликарбоновые) кислоты. По характеру радикала, связанного с карбоксильной группой, кислоты могут быть предельными, непредельными, ароматическими и др.
Мы рассмотрим лишь одноосновные карбоновые кислоты.
Физические свойства. Кислоты имеют аномально высокие температуры кипения и плавления (даже по сравнению со спиртами). Это объясняется значительной ассоциацией, обусловленной водородной связью. Такие связи образуются у кислот в результате взаимодействия атома водорода гидроксильной группы одной молекулы и атома кислорода карбонильной группы другой молекулы.
Водородные связи в кислотах отличаются большей прочностью, чем в спиртах, так как связь О–Н в молекулах кислот более поляризована. Ассоциация молекул может быть линейной, но более характерна циклическая – димерная ассоциация. В таких димерах межъядерное расстояние между двумя атомами кислорода равно 0,27 нм (как и в ассоциированных спиртах); атомы водорода удалены от атомов кислорода на разные расстояния:
![]()

линейная ассоциация димерная ассоциация
Не только в твердом и жидком состояниях, но даже в газообразном состоянии и в растворах в углеводородах, большая часть кислот находится в ассоциированном состоянии в виде димеров. Только при высоких температурах димеры распадаются на мономеры.
Строение карбоксильной группы. Химические свойства. Карбоксильная группа формально представляет собой сочетание групп =С=О и –ОН. Вследствие близкого расположения этих групп они оказывают друг на друга сильное влияние, поэтому карбоновые кислоты отличаются по свойствам как от альдегидов, так и от спиртов.
Гидроксильная группа кислот легче отщепляет ион Н+, чем гидроксильная группа спиртов. Причиной усиления кислотности является влияние полярной карбонильной группы. Карбонильный атом С, несущий положительный заряд, стремится погасить дефицит электронов, притягивая неподеленную электронную пару гидроксильного атома О. Последняя взаимодействует с -связью С=О (р--сопряжение):

Вследствие этого связь углерод – гидроксильный кислород упрочняется, а связь О–Н поляризуется. Поэтому для данных соединений характерны кислотные свойства и не характерны основные.
Карбоновые кислоты диссоциируют с образованием карбоксилат-иона и иона водорода; в водном растворе существует равновесие: RCOOH ⇄ RCOO– + H+
Водные растворы кислот изменяют окраску индикаторов. Хотя кислотные свойства у карбоновых кислот выражены сильнее, чем у спиртов и воды, по сравнению с сильными минеральными кислотами – это слабые кислоты (исключением является муравьиная кислота – кислота средней силы).
На силу кислот оказывает влияние радикал, связанный с карбоксильной группой: чем он больше, тем слабее кислота. Самой сильной из карбоновых кислот является муравьиная.
Для кислот наиболее типичны реакции, связанные с кислотными свойствами, т. е. реакции, которые сопровождаются разрывом связи кислород–водород, а также реакции замещения гидроксильной группы. Для остальной части молекулы возможны реакции, обусловленные ее структурой – наличием кратной связи, ароматического кольца, других функциональных групп.
1. Образование солей. Карбоновые кислоты легко реагируют с основаниями, основными оксидами, активными металлами. При этом атом водорода карбоксильной группы замещается металлом и образуются соли:
RCOOH + NaOH RCOONa + Н2О; 2RCOOH + Mg (RCOO)2Mg + Н2
Соли карбоновых кислот легко гидролизуются, как и вообще соли слабых кислот. Поэтому водные растворы солей щелочных металлов имеют щелочную реакцию:
СН3СОО– + Н2О ⇄ СН3СООН + ОН–
2. Образование функциональных производных. При замещении гидроксильной группы различными группами можно получать функциональные производные кислот – ангидриды, галогенангидриды, сложные эфиры, амиды.
Сложные эфиры получают реакцией этерификации, которая протекает при нагревании в присутствии концентрированной серной кислоты, являющейся катализатором и смещающей равновесие реакции в сторону продуктов за счет водоотнимающих свойств:
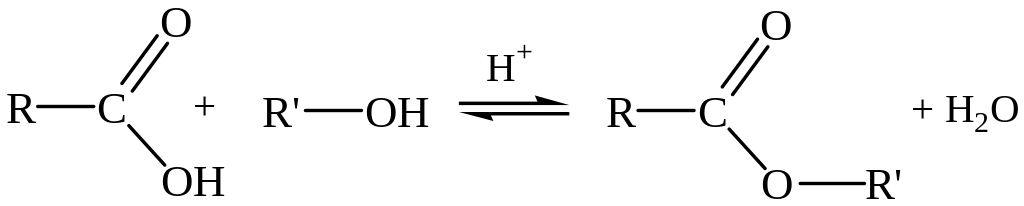
Механизм реакции следующий:
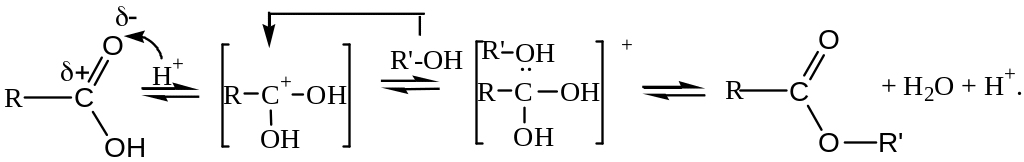
Для этих соединений характерно, что при гидролизе из них вновь образуются кислоты.
3. Галогенирование (реакция Зелинского – Гелля – Фольгарда). В присутствии брома и небольших количеств красного фосфора образуются -бромзамещенные кислоты:
СН3–СН2–СООН
+ Br2
![]() CH3–CHBr–COOH
+ HBr
CH3–CHBr–COOH
+ HBr
пропионовая кислота -бромпропионовая кислота
Муравьиная кислота НСООН отличается рядом особенностей. Наличие в молекуле муравьиной кислоты альдегидной группы обусловливает ее восстанавливающие свойства. В частности, она дает реакцию серебряного зеркала:
Н–СО–ОН + 2[Ag(NH3)2]OH
![]() Н2О
+ СО2 +
2Ag
+ 4NH3
+ H2O
Н2О
+ СО2 +
2Ag
+ 4NH3
+ H2O
Особое место среди жирных кислот занимают высокомолекулярные кислоты – пальмитиновая CH3(CH2)14COOH и стеариновая CH3(CH2)16COOH. Глицериды этих кислот являются главной составной частью природных жиров и масел.
Жиры
С химической точки зрения жиры представляют собой сложные эфиры, образованные трехатомным спиртом глицерином и высшими жирными кислотами.
Глицерин как трехатомный спирт может образовывать сложные эфиры с участием всех или 1–2 гидроксильных групп. Жиры являются, как правило, полными эфирами глицерина, включающие остатки одной или нескольких высших жирных кислот. Наиболее важные жирные кислоты, входящие в состав жиров, следующие: 1) насыщенные: пальмитиновая С15Н31СООН; стеариновая С17Н35СООН; 2) ненасыщенные: олеиновая СН3–(СН2)7–СН=СН–(СН2)7–СООН; линолевая СН3–(СН2)3–(СН2–СН=СН)2–(СН2)7–СООН.
Твердые жиры образуются преимущественно насыщенными жирными кислотами. Это в основном животные жиры – сало (кроме рыбьего жира). Жидкие жиры (растительные масла) образованы в основном ненасыщенными кислотами (кроме кокосового масла).
Химические свойства жиров обусловлены сложноэфирными связями и строением радикалов кислот.
1. Гидролиз сложноэфирных связей (см. выше). Гидролиз жиров ускоряется щелочами и кислотами. При щелочном гидролизе (омылении) образуются соли насыщенных жирных кислот, называемые мылами:

2. Окисление. Жиры, содержащие остатки ненасыщенных кислот, способны окисляться кислородом воздуха по месту разрыва двойных связей.
3. Гидрогенизация (гидрирование). Сущность этой реакции состоит в присоединении водорода к непредельным жирным кислотам. Таким путем из жидких жиров получают твердые.
Масла проявляют и другие свойства непредельных соединений.
Углеводы
Углеводы содержатся в растительных и животных организмах. В классе углеводов выделяют три группы – моносахариды, олигосахариды и полисахариды.
Моносахариды – это гетерофункциональные соединения, содержащие альдегидную или кетонную группу и несколько гидроксильных групп. Они не способны распадаться на более простые углеводы. Моносахариды, содержащие альдегидную группу, называют альдозами (альдегидоспиртами), а моносахариды, содержащие кетогруппу, – кетозами (кетоспиртами). По числу углеродных атомов в молекуле различают тетрозы, пентозы, гексозы, гептозы.
Примерами пентоз являются рибоза и дезоксирибоза, остатки которых входят в состав нуклеиновых кислот; примеры гексоз – глюкоза и фруктоза.
Глюкоза С6Н12О6 содержит альдегидную группу. Важным свойством глюкозы является способность взаимодействовать со свежеприготовленным гидроксидом меди (II) с образованием ярко-синего комплекса, что характерно для многоатомных спиртов. Таким образом, глюкоза является альдегидоспиртом:

Наряду с ациклической формой глюкоза и другие моносахариды могут существовать и в циклических формах (см. раздел «Изомерия»).
Моносахариды вступают в реакции, которые обусловлены имеющимися в них функциональными группами. Как спирты, они могут образовывать простые и сложные эфиры. За счет альдегидной группы глюкоза легко окисляется в мягких условиях, и при этом образуется глюконовая кислота (окислителем могут быть: бромная вода, аммиачный раствор оксида серебра – реакция "серебряного зеркала", гидроксид меди (II) – реакция Троммера) и др.
Возможна реакция восстановления альдегидной группы, что приводит к образованию 6-атомного спирта сорбита.
Моносахариды подвергаются сложному процессу расщепления под влиянием микроорганизмов. Этот процесс называют брожением. В результате такого расщепления образуются этанол, молочная кислота СН3–СН(ОН)–СООН и т.д. Наряду с ними выделяются СО2, Н2О и другие соединения. В зависимости от конечных продуктов (спирт, молочная, лимонная, масляная кислоты и т.п.) различают соответственно спиртовое, молочнокислое, лимоннокислое, маслянокислое брожение и т.д. Каждый из этих процессов протекает под влиянием определенных микроорганизмов. Например, спиртовое брожение протекает при участии ферментов дрожжевых грибков: С6Н12О6 2С2Н5ОН + 2СО2.
Фруктоза (фруктовый сахар) – структурный изомер глюкозы, но в отличие от последней, относится к кетоспиртам:

-фруктоза -фруктоза
Дисахариды. Примером дисахарида является сахароза (тростниковый, или свекловичный сахар). Молекула сахарозы состоит из остатков молекул двух моносахаридов: -глюкозы и -фруктозы, связанных между собой связью С1–С2:

При гидролизе сахарозы образуются глюкоза и фруктоза.
Полисахариды. Примерами полисахаридов являются крахмал и целлюлоза. Состав этих углеводов выражается формулой (С6Н10О5)n.
Крахмал образуется в растениях при фотосинтезе. Структурная формула крахмала:
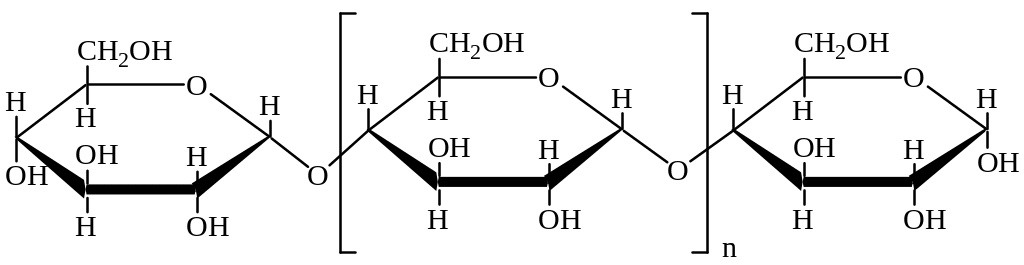
Молекулы крахмала с иодом дают соединения включения темно-синего цвета
Крахмал подвергается гидролизу при действии ферментов амилаз или при нагревании с кислотами: (С6Н10О5)n + nН2О nС6Н12О6 (глюкоза).
Целлюлоза (клетчатка) – полисахарид линейного строения, состоящий из остатков -глюкозы:

Химические свойства целлюлозы определяются прежде всего присутствием гидроксильных групп. За счет них она образует простые и сложные эфиры:
[С6Н7О2(ОН)3]n
+ 3nHNO3
![]() [C6H7O2(ONO2)3]n
+ 3nH2O
[C6H7O2(ONO2)3]n
+ 3nH2O
тринитроцеллюлоза
[С6Н7О2(ОН)3]n + 3n(СН3СО)2О [C6H7O2(OСОСН3)3]n + 3nСН3СООН
уксусный триацетатцеллюлоза
ангидрид
Целлюлоза подвергается гидролизу (как крахмал).
Виды заданий ЕГЭ
