
- •3. Химическая реакция
- •3.1. Тепловой эффект химической реакции. Сохранение и превращение энергии при химических реакциях
- •1. На выбор экзо- или эндотермического процесса по предложенным уравнениям реакций
- •2. На подсчет теплового эффекта реакции по термохимическому уравнению
- •1) Выделяется 129,6 кДж теплоты 3) выделяется 64,8 кДж теплоты
- •2) Поглощается 129,6 кДж теплоты 4) поглощается 64,8 кДж теплоты
- •3. Расчетные задачи по термохимическим уравнениям
- •1) Выделяется 1665 кДж теплоты; 3) поглощается 1665 кДж теплоты;
- •2) Выделяется 3330 кДж теплоты; 4) поглощается 3330 кДж теплоты.
- •3.2. Понятие о скорости химической реакции. Факторы, влияющие на изменение скорости химической реакции
- •1. На зависимость скорости химической реакции от различных факторов
- •2. На вскрытие причин зависимости скорости химической реакции от различных факторов
- •1) Увеличение числа столкновений молекул; 3) уменьшение энергии активации процесса;
- •2) Увеличение энергии молекул; 4) изменение концентрации веществ.
- •1) Увеличении температуры; 2) увеличении давления; 3) увеличении концентрации хлора?
- •3. На закон действующих масс
- •4. На правило Вант-Гоффа
- •1) 9 Раз; 2) 6 раз; 3) 3 раза; 4) 1,5 раза.
- •3.3. Обратимые необратимые химические реакции. Химическое равновесие и условия его смещения
- •1. На выбор обратимой или необратимой реакции по предложенным уравнениям или заданным условиям
- •2. На применение принципа Ле Шателье
- •3.4. Электролитическая диссоциация неорганических и органических кислот, щелочей, солей. Степень диссоциации. Понятие о протолитах
- •1. На выбор процесса диссоциации из числа предложенных уравнений
- •2. На ступенчатость процесса диссоциации
- •3. На степень электролитической диссоциации
- •1) Кремниевая 2) сероводородная 3) хлороводородная 4) уксусная
- •4. На смещение химического равновесия процесса диссоциации
- •5. На знание протолитической теории кислот и оснований
- •1) Температуры 2) концентрации 3) объема раствора 4) природы кислоты
- •1) Уменьшается 2) изменяется периодически 3) не изменяется 4) усиливается
- •3.5. Реакции ионного обмена
- •1. На определение реагентов и продуктов по сокращенному ионному уравнению и наоборот
- •2. На определение возможности протекания реакции между ионами
- •3. На подсчет суммы коэффициентов в сокращенном ионном или молекулярном уравнении реакции
- •1) Разложения 2) замещения 3) нейтрализации 4) соединения
- •3.6. Реакции окислительно-восстановительные
- •1. На выбор окислительно-восстановительной реакции
- •2. На определение в реакции окислителя и восстановителя, их степеней окисления, процессов окисления и восстановления
- •3. На определение коэффициентов перед формулами окислителя и восстановителя и подсчет суммы коэффициентов в уравнениях окислительно-восстановительных реакций
- •4. На установление соответствия между реагентами и схемами превращений элементов
- •3.7. Гидролиз солей
- •1. На определение солей, подвергающихся или не подвергающихся гидролизу
- •2. На определение среды раствора при гидролизе солей
- •1) Ацетата алюминия 2) нитрата калия 3) сульфата алюминия 4) фосфата натрия
- •1) Ацетата калия 2) сульфата цинка 3) карбоната натрия 4) нитрата калия
- •3. На определение типа гидролиза и продуктов взаимодействия солей с водой
- •1) Ацетат натрия 2) сульфат калия 3) фосфат калия 4) хлорид железа (III)
- •1) Фиолетовый 2) синий 3) красный 4) зеленый
- •1) Нитрита калия 2) гипохлорита натрия 3) хлорида железа (II) 4) нитрата калия
- •3.8. Электролиз расплавов и растворов солей
- •1. На определение процессов, протекающих на катоде и аноде
- •2. На определение продуктов электролиза
- •1) Сульфата натрия 2) бромида натрия 3) нитрата натрия 4) перхлората натрия
- •3. На написание уравнений электролиза
- •1) Азот 2) водород 3) медь 4) кислород
- •3.9. Виды коррозии металлов. Способы предупреждения коррозии
- •1. На определение коррозионно-активных компонентов
- •2. На определение процессов, протекающих при коррозии металлов, и способов защиты от коррозии
- •1) Свинца 2) олова 3) цинка 4) алюминия
- •1) Фосфор 2) хром 3) кремний 4) углерод
- •2.15. Особенности химического и электронного строения алканов, алкенов, алкинов. Понятие о циклических углеводородах
- •2.16. Ароматические углеводороды. Бензол, его электронное строение. Гомологи бензола
- •3.10. Характерные реакции углеводородов различных классов
- •3Нссн (Синтез н.Д. Зелинского, б.А. Казанского, 1922 г.).
- •1. Реакции замещения
- •2. Реакции присоединения
- •1) Этаном 2) этеном 3) этином 4) этандиолом
- •1) Муравьиный альдегид 2) уксусный альдегид 3) муравьиная кислота 4) этиловый спирт
- •3. Реакции полимеризации
- •1) Пропен 2) пропан 3) циклопропан 4) циклогексан
- •1) Изомеризации 2) поликонденсации 3) полимеризации 4) гидратации
- •4. Реакции окисления (горения)
- •1) Бутен-2 2) этанол 3) этилен 4) бутадиен-1,2
- •1) Пропан 2) бутадиен-1,3 3) аминокапроновая кислота 4) метиламин
- •3.11. Механизмы реакций замещения и присоединения в органической химии. Правило в. В. Марковникова
- •1. На механизм реакций присоединения и правило в. В. Марковникова
- •1) Пропанол-1 2) пропанол-2 3) уксусная кислота 4) ацетон
- •2. На механизм реакций замещения
- •1) Этанол 2) этаналь 3) этилен 4) этилацетат
- •1) Пропен 2) гексан 3) циклопропан 4) 2,3-диметилбутан
- •1) Пропеном 2) бензолом 3) гексаном 4) метилциклопентаном
- •3.12. Реакции, подтверждающие взаимосвязь углеводородов и кислородсодержащих органических соединений
- •1. На получение кислородсодержащих органических соединений из углеводородов
- •2. На получение углеводородов из кислородсодержащих органических соединений
- •1) Этаналя 2) этана 3) этанола 4) хлорэтана
- •3. На установление генетических связей между углеводородами и кислородсодержащими органическими соединениями
- •1) Этилен 2) хлорэтан 3) 1,2-дихлорэтан 4) хлорвинил
- •3.13. Реакции, подтверждающие взаимное влияние атомов в молекулах органических соединений
- •– Образование сложных эфиров (этерификация):
- •1. На правила ориентации в бензольном ядре
- •2. На взаимное влияние функциональных групп и углеводородных радикалов
- •1) Усиливаются 2) ослабевают 3) не изменяются
- •4) Сначала увеличиваются, потом уменьшаются
- •1) Пропаном 2) бензолом 3) этанолом 4) анилином
3Нссн (Синтез н.Д. Зелинского, б.А. Казанского, 1922 г.).
бензол
4. Реакции замещения (кислотные свойства). Связь С–Н в ацетилене более полярна, чем в этилене и этане, т.к. увеличивается электроотрицательность атома углерода в состоянии sр-гибридизации. Этим объясняются кислотные свойства ацетилена (и его гомологов, имеющих в молекуле концевую тройную связь), проявляющиеся в способности давать металлические производные – ацетилениды:
НССН + 2[Аg(NН3)2]ОН(р-р) АgССАg + 4NН3 + 2Н2О.
гидроксид диаммин серебра ацетиленид серебра (серого цвета)
(аммиачный раствор оксида серебра)
Ароматические углеводороды (арены)
Простейшим представителем аренов является бензол С6Н6. Он был открыт М. Фарадеем в 1825 г., а в 1845 г. А. Гофман выделил его из каменноугольной смолы.
Природа ароматического состояния. В молекуле бензола все связи С–С выровнены (длины всех связей 0,139 нм). Это плоская молекула, где 6 атомов углерода объединены в правильный шестиугольный цикл. Все атомы углерода в бензольном кольце находятся в состоянии sр2-гибридизации. Каждый из них образует три -связи (две С–С и одну С–Н) с углом между ними 120. Орбитали всех шести р-электронов перпендикулярны плоскости кольца и взаимно параллельны. Каждый из них взаимодействует с р-электронами соседних атомов углерода. Шесть р-электронов не локализованы в пары, как при образовании обычных двойных связей, а образуют общую -систему – осуществляется круговое сопряжение. Электронная плотность в бензольном кольце распределена равномерно, т.е. ни простых, ни двойных связей в бензольном ядре нет, все связи одинаковы.
Ароматичность молекулы означает ее повышенную устойчивость, обусловленную делокализацией -электронов в циклической системе.
Критерии ароматичности аренов:
1. Атомы углерода в sp2-гибридизованном состоянии образуют циклическую систему.
2. Атомы углерода располагаются в одной плоскости (цикл имеет плоское строение).
3. Замкнутая система сопряженных связей содержит 4n+2 -электронов (n – целое число).
Этим критериям полностью соответствует молекула бензола С6Н6.
Изомерия производных бензола. Однозамещенные бензолы изомеров не имеют, т.к. все атомы углерода в бензоле равноценны.
Двузамещенные бензолы существуют в виде трех изомеров, отличающихся расположением заместителей относительно друг друга. Положение заместителей указывают при помощи приставок орто- (о-, рядом), мета- (м-, через один) и пара- (п-, напротив) или обозначают цифрами:

По три изомера имеют и трех- и четырехзамещенные бензолы с одинаковыми заместителями.
Производные бензола, которые можно рассматривать как продукты замещения атомов водорода бензола насыщенными (алкильными) углеводородными радикалами, называют гомологами бензола. Общая формула таких углеводородов СnН2n–6. Углеводородными заместителями могут быть также ненасыщенные радикалы (алкенильные, алкинильные). В молекулах «бензоидных» углеводородов различают две части: бензольное ядро и боковую цепь. Изомерия этих соединений обусловлена строением радикалов, их составом и расположением.
Номенклатура производных бензола. Названия углеводородов ряда бензола составляют из названий радикалов с добавлением окончания «бензол». Для многих из них употребительны тривиальные названия. Примеры:








Способы получения. Для получения бензола и его гомологов используются нециклические и циклические углеводороды нефти.
1. Получение из нециклических углеводородов.
– Каталитическая дегидроциклизация – получение из алканов с неразветвленной цепью, имеющих не менее 6-ти атомов углерода в молекуле (Б.А. Казанский, А.Ф. Платэ, Б.Л. Молдавский):


Катализатором может служить платинированный уголь при 300С, а также оксиды хрома, молибдена, ванадия. Наиболее часто используют оксид хрома на оксиде алюминия при 500С и 3МПа.
– Полимеризация ацетилена и его гомологов (см. раздел «Химические свойства алкинов»).
2. Получение из циклических углеводородов.
– Каталитическое дегидрирование (Н.Д. Зелинский, 1911 г.; катализатор – палладиевая чернь, 300С): С6Н12 С6Н6 + 3Н2
В промышленности в качестве катализатора используют платину на оксиде алюминия; температура около 450С.
Химические свойства. Арены склонны к реакциям, в результате которых сохраняется ароматичность (-система), т.е. к реакциям замещения. В реакции, сопровождающиеся нарушением ароматичности, арены вступают только в жестких условиях. Это реакции окисления и присоединения.
Реакции замещения.
– Галогенирование. В обычных условиях с хлором и бромом бензол не взаимодействует. Реакция протекает в присутствии катализатора (чаще всего используют галогениды алюминия и железа: AlCl3, AlBr3, FeCl3, FeBr3): С6Н6 + Cl2 С6Н5Cl + НСl.
– Нитрование. Действуют смесью концентрированных азотной и серной кислот:

Реакции присоединения к бензолу идут в жестких условиях. Например, на свету 1 моль бензола присоединяет 3 моль хлора с образованием гексахлорциклогексана (гексахлорана).
Производные бензола имеют ряд особенностей в химическом поведении, связанных с наличием в их молекулах алкильных радикалов (или функциональных групп).
Взаимное влияние атомов в молекулах производных бензола
1. Реакции в боковой цепи (влияние ядра).
По химическим свойствам алкильные радикалы подобны алканам. Атомы водорода в них замещаются на галоген. Влияние бензольного ядра приводит к тому, что замещение облегчается и замещается всегда атом водорода у атома углерода, непосредственно связанного с ароматическим кольцом:

толуол фенилхлорметан фенилдихлорметан фенилтрихлорметан

этилбензол 1-фенил-1-хлорэтан
Боковые цепи в гомологах бензола подвергаются окислению легче, чем соответствующие алканы, (например, при действии НNО3, КМnО4 и др.) и независимо от длины углеродной цепи окисляются в карбоксильную группу, что также обусловлено влиянием бензольного ядра (смещением к нему электронной плотности от углеводородных радикалов):

бензойная кислота
Бензольное кольцо оказывает влияние и на поведение функциональных групп (–ОН, –NН2 и др.), связанных с ним. Так, фенол проявляет более выраженные кислотные свойства по сравнению со спиртами и взаимодействует с основаниями:
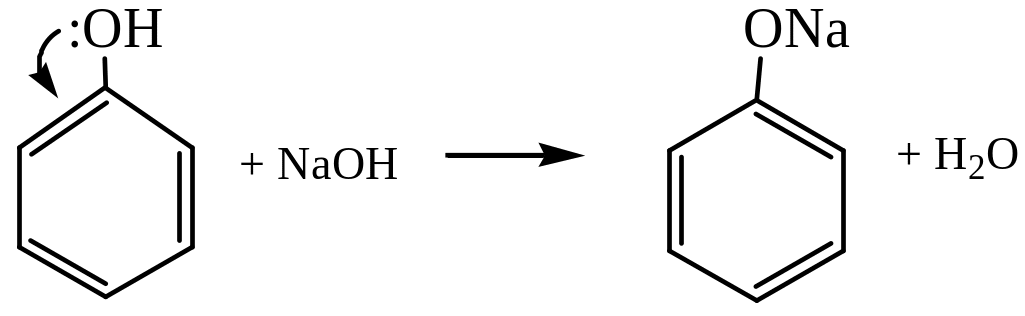
фенолят натрия
Это объясняется р--сопряжением неподеленной пары электронов атома О гидроксильной группы с -системой бензольного кольца, упрочнением связи С–О и большей поляризацией связи О–Н.
За счет р--сопряжения неподеленной электронной пары атома N аминогруппы с -системой бензольного кольца анилин является менее сильным основанием, чем амины жирного ряда:
![]()
2. Ориентация при замещении в бензольном ядре (влияние заместителей).
Вследствие равноценности всех атомов углерода в бензоле однозамещенные бензолы изомеров не имеют. При вступлении в молекулу второго заместителя могут образоваться три изомера – орто-, мета- или пара-.
Место вступления нового электрофильного заместителя (катиона или частицы, имеющей дефицит электронов) определяется природой уже имеющегося в ароматическом ядре заместителя.
Все заместители по их ориентирующему действию при реакции замещения в бензольном ядре делят на две группы:
1. Заместители I рода – электронодонорные группы, подающие электроны в бензольное ядро, что приводит к увеличению и перераспределению электронной плотности в ядре так, что в орто- и пара-положениях наблюдается ее избыток (-). К заместителям I рода относят алкильные радикалы, гидроксильную, аминогруппы и т.п.:

толуол фенол анилин
Таким образом, заместители I рода активируют бензольное ядро, облегчая введение нового заместителя, и ориентируют последний в орто- и пара-положения.
Например, при нитровании толуола (атакующая частица – ион нитрония NО2+) получаются орто- и (или) пара-изомеры:

2. Заместители II рода – электроноакцепторные группы, оттягивающие электронную плотность от ядра, что приводит к снижению и перераспределению электронной плотности в ядре так, что в орто- и пара-положениях наблюдается ее недостаток (+), а в мета-положениях она оказывается несколько повышенной. К заместителям II рода относятся нитро-, сульфо-, циано-, карбонильная и карбоксильная группы:

нитробензол бензойная кислота
Таким образом, заместители II рода затрудняют введение нового электрофильного заместителя, а вступающий заместитель направляется ими в мета-положение:

Виды заданий ЕГЭ
