
- •3. Химическая реакция
- •3.1. Тепловой эффект химической реакции. Сохранение и превращение энергии при химических реакциях
- •1. На выбор экзо- или эндотермического процесса по предложенным уравнениям реакций
- •2. На подсчет теплового эффекта реакции по термохимическому уравнению
- •1) Выделяется 129,6 кДж теплоты 3) выделяется 64,8 кДж теплоты
- •2) Поглощается 129,6 кДж теплоты 4) поглощается 64,8 кДж теплоты
- •3. Расчетные задачи по термохимическим уравнениям
- •1) Выделяется 1665 кДж теплоты; 3) поглощается 1665 кДж теплоты;
- •2) Выделяется 3330 кДж теплоты; 4) поглощается 3330 кДж теплоты.
- •3.2. Понятие о скорости химической реакции. Факторы, влияющие на изменение скорости химической реакции
- •1. На зависимость скорости химической реакции от различных факторов
- •2. На вскрытие причин зависимости скорости химической реакции от различных факторов
- •1) Увеличение числа столкновений молекул; 3) уменьшение энергии активации процесса;
- •2) Увеличение энергии молекул; 4) изменение концентрации веществ.
- •1) Увеличении температуры; 2) увеличении давления; 3) увеличении концентрации хлора?
- •3. На закон действующих масс
- •4. На правило Вант-Гоффа
- •1) 9 Раз; 2) 6 раз; 3) 3 раза; 4) 1,5 раза.
- •3.3. Обратимые необратимые химические реакции. Химическое равновесие и условия его смещения
- •1. На выбор обратимой или необратимой реакции по предложенным уравнениям или заданным условиям
- •2. На применение принципа Ле Шателье
- •3.4. Электролитическая диссоциация неорганических и органических кислот, щелочей, солей. Степень диссоциации. Понятие о протолитах
- •1. На выбор процесса диссоциации из числа предложенных уравнений
- •2. На ступенчатость процесса диссоциации
- •3. На степень электролитической диссоциации
- •1) Кремниевая 2) сероводородная 3) хлороводородная 4) уксусная
- •4. На смещение химического равновесия процесса диссоциации
- •5. На знание протолитической теории кислот и оснований
- •1) Температуры 2) концентрации 3) объема раствора 4) природы кислоты
- •1) Уменьшается 2) изменяется периодически 3) не изменяется 4) усиливается
- •3.5. Реакции ионного обмена
- •1. На определение реагентов и продуктов по сокращенному ионному уравнению и наоборот
- •2. На определение возможности протекания реакции между ионами
- •3. На подсчет суммы коэффициентов в сокращенном ионном или молекулярном уравнении реакции
- •1) Разложения 2) замещения 3) нейтрализации 4) соединения
- •3.6. Реакции окислительно-восстановительные
- •1. На выбор окислительно-восстановительной реакции
- •2. На определение в реакции окислителя и восстановителя, их степеней окисления, процессов окисления и восстановления
- •3. На определение коэффициентов перед формулами окислителя и восстановителя и подсчет суммы коэффициентов в уравнениях окислительно-восстановительных реакций
- •4. На установление соответствия между реагентами и схемами превращений элементов
- •3.7. Гидролиз солей
- •1. На определение солей, подвергающихся или не подвергающихся гидролизу
- •2. На определение среды раствора при гидролизе солей
- •1) Ацетата алюминия 2) нитрата калия 3) сульфата алюминия 4) фосфата натрия
- •1) Ацетата калия 2) сульфата цинка 3) карбоната натрия 4) нитрата калия
- •3. На определение типа гидролиза и продуктов взаимодействия солей с водой
- •1) Ацетат натрия 2) сульфат калия 3) фосфат калия 4) хлорид железа (III)
- •1) Фиолетовый 2) синий 3) красный 4) зеленый
- •1) Нитрита калия 2) гипохлорита натрия 3) хлорида железа (II) 4) нитрата калия
- •3.8. Электролиз расплавов и растворов солей
- •1. На определение процессов, протекающих на катоде и аноде
- •2. На определение продуктов электролиза
- •1) Сульфата натрия 2) бромида натрия 3) нитрата натрия 4) перхлората натрия
- •3. На написание уравнений электролиза
- •1) Азот 2) водород 3) медь 4) кислород
- •3.9. Виды коррозии металлов. Способы предупреждения коррозии
- •1. На определение коррозионно-активных компонентов
- •2. На определение процессов, протекающих при коррозии металлов, и способов защиты от коррозии
- •1) Свинца 2) олова 3) цинка 4) алюминия
- •1) Фосфор 2) хром 3) кремний 4) углерод
- •2.15. Особенности химического и электронного строения алканов, алкенов, алкинов. Понятие о циклических углеводородах
- •2.16. Ароматические углеводороды. Бензол, его электронное строение. Гомологи бензола
- •3.10. Характерные реакции углеводородов различных классов
- •3Нссн (Синтез н.Д. Зелинского, б.А. Казанского, 1922 г.).
- •1. Реакции замещения
- •2. Реакции присоединения
- •1) Этаном 2) этеном 3) этином 4) этандиолом
- •1) Муравьиный альдегид 2) уксусный альдегид 3) муравьиная кислота 4) этиловый спирт
- •3. Реакции полимеризации
- •1) Пропен 2) пропан 3) циклопропан 4) циклогексан
- •1) Изомеризации 2) поликонденсации 3) полимеризации 4) гидратации
- •4. Реакции окисления (горения)
- •1) Бутен-2 2) этанол 3) этилен 4) бутадиен-1,2
- •1) Пропан 2) бутадиен-1,3 3) аминокапроновая кислота 4) метиламин
- •3.11. Механизмы реакций замещения и присоединения в органической химии. Правило в. В. Марковникова
- •1. На механизм реакций присоединения и правило в. В. Марковникова
- •1) Пропанол-1 2) пропанол-2 3) уксусная кислота 4) ацетон
- •2. На механизм реакций замещения
- •1) Этанол 2) этаналь 3) этилен 4) этилацетат
- •1) Пропен 2) гексан 3) циклопропан 4) 2,3-диметилбутан
- •1) Пропеном 2) бензолом 3) гексаном 4) метилциклопентаном
- •3.12. Реакции, подтверждающие взаимосвязь углеводородов и кислородсодержащих органических соединений
- •1. На получение кислородсодержащих органических соединений из углеводородов
- •2. На получение углеводородов из кислородсодержащих органических соединений
- •1) Этаналя 2) этана 3) этанола 4) хлорэтана
- •3. На установление генетических связей между углеводородами и кислородсодержащими органическими соединениями
- •1) Этилен 2) хлорэтан 3) 1,2-дихлорэтан 4) хлорвинил
- •3.13. Реакции, подтверждающие взаимное влияние атомов в молекулах органических соединений
- •– Образование сложных эфиров (этерификация):
- •1. На правила ориентации в бензольном ядре
- •2. На взаимное влияние функциональных групп и углеводородных радикалов
- •1) Усиливаются 2) ослабевают 3) не изменяются
- •4) Сначала увеличиваются, потом уменьшаются
- •1) Пропаном 2) бензолом 3) этанолом 4) анилином
1. На определение коррозионно-активных компонентов
Пример 1 (блок А). Наиболее коррозионно-активным компонентом загрязненного городского воздуха по отношению к металлам, особенно при повышенной влажности, является
1) NH3 2) CO 3) SO2 4) NO
На оксиды азота и углерода повышенная влажность воздуха влиять не будет, так как они с водой не реагируют и в ней не растворяются. Аммиак с водой дает щелочь, а сернистый газ – кислоту, которая и будет разрушать металлы. Правильный ответ: 3.
Пример 2 (блок В). Устойчивость алюминия к коррозии объясняется наличием на его поверхности соединений из класса ___. (Запишите слово в соответствующем падеже множественного числа).
Алюминий при обычных условиях покрыт прочной оксидной пленкой, которая предохраняет его от коррозии. Правильный ответ: оксидов.
2. На определение процессов, протекающих при коррозии металлов, и способов защиты от коррозии
Пример 1 (блок А). При коррозии оцинкованного железа
1) оба металла разрушаются 3) разрушается железо, а не цинк
2) оба металла защищены 4) разрушается цинк, а не железо
Разрушающему действию коррозии при контакте двух металлов подвергается тот из них, который является более активным. Правильный ответ: 4.
Задания для самостоятельной работы
3.62. Для защиты кровельного железа от коррозии его покрывают тонким слоем
1) Свинца 2) олова 3) цинка 4) алюминия
3.63. Для получения нержавеющей стали в ее состав вводят
1) Фосфор 2) хром 3) кремний 4) углерод
2.15. Особенности химического и электронного строения алканов, алкенов, алкинов. Понятие о циклических углеводородах
2.16. Ароматические углеводороды. Бензол, его электронное строение. Гомологи бензола
3.10. Характерные реакции углеводородов различных классов
Алканы
Алканы (предельные углеводороды, парафины) – насыщенные углеводороды, в молекулах которых атомы углерода и водорода связаны только -связями.
Общая формула алканов – СnH2n+2.
В молекулах алканов атомы углерода находятся в sp3-гибридном состоянии и каждый из них образует 4 -связи с атомами углерода и (или) водорода. Состояние sp3-гибридизации характеризуется тетраэдрической конфигурацией атома углерода.
Природными источниками алканов являются нефть, попутные нефтяные газы и природный газ.
Способы получения. Важнейшие синтетические методы получения:
1. Гидрирование непредельных углеводородов.
СН3–СН=СН–СН3
+ Н2
![]() СН3–СН2–СН2–СН3
(катализатор
– Ni,
Pt
или Pd).
СН3–СН2–СН2–СН3
(катализатор
– Ni,
Pt
или Pd).
бутен-2 бутан
2. Получение из галогенопроизводных (реакция Ш.А. Вюрца, 1854 г.).
2СН3I + 2Na CH3–CH3 + 2NaI.
иодметан этан
3. Получение из солей карбоновых кислот (лабораторный способ).
СН3СООNa(тв.)
+ NaOH(тв.).
![]() CH4
+ Na2CO3.
CH4
+ Na2CO3.
ацетат натрия метан
В этих реакциях, как правило, берется не чистый гидроксид натрия, а его смесь с гидроксидом кальция, называемая натронной известью. Исходные вещества предварительно прокаливают.
4. Прямой синтез из углерода и водорода.
В электрической дуге, горящей в атмосфере водорода, образуется значительное количество метана: С + 2Н2 СН4.
Такая же реакция идет при температуре 400–500С, давлении порядка 30 МПа и в присутствии катализатора – железа или марганца. Эта реакция имеет большое практическое значение для получения смеси углеводородов – синтетического бензина.
5. Получение
из синтез-газа. nСО
+ (2n+1)H2
![]() CnH2n+2
+ nH2O.
CnH2n+2
+ nH2O.
Химические свойства. В химическом отношении алканы малоактивны, за что и были названы парафинами (от лат. parum affinis – лишенные сродства). Это объясняется прочностью -связей, устойчивость которых обусловлена малым размером атома С и его тетраэдрической конфигурацией, что способствует максимальной концентрации электронной плотности между ядрами атомов. -Связь С–Н мало поляризована вследствие близости электроотрицательностей атомов С и Н. В силу этого алканы – малополярные вещества и труднополяризуемые, на них не действуют кислоты, щелочи, обычные окислители (например, КМnО4), металлы.
Для алканов возможен гомолитический (радикальный) разрыв связей, при этом происходят реакции замещения атомов Н, расщепления углеродного скелета (крекинг), окисления (частичного или полного).
1. Реакции замещения.
– Хлорирование.В
качестве примера реакций замещения
рассмотрим реакцию хлорирования метана,
которая относится к цепным радикальным
реакциям. Процесс протекает энергично
на свету или при нагревании (до 250–400оС).
Первая стадия называется зарождением,
или инициированием,
цепи: ![]() (под
действием энергии квантов света или
высокой температуры некоторые молекулы
хлора гомолитически расщепляются на 2
атома, имеющих неспаренные электроны,
– свободные радикалы).
(под
действием энергии квантов света или
высокой температуры некоторые молекулы
хлора гомолитически расщепляются на 2
атома, имеющих неспаренные электроны,
– свободные радикалы).
Далее происходит развитие (рост) цепи:
Сl + CН4 НСl + СН3 (метил); СН3 + Сl2 СН3Сl + Сl и т.д.
Обрыв цепи происходит, если сталкиваются два свободных радикала; при этом могут образоваться молекулы С2Н4, СН3Сl, Сl2.
При хлорировании других алканов легче всего замещение идет у третичного атома углерода (атома, который затрачивает на С–С-связь 3 валентности), затем у вторичного и в последнюю очередь – у первичного. При образовании полигалогензамещенных соединений атомы хлора преимущественно замещают атомы водорода у одного и того же или у соседних атомов углерода. – Закономерности В. В. Марковникова.
– Нитрование (реакция М. И. Коновалова, 1888 г.).
 .
.
Реакцию проводят 10%-ной азотной кислотой при температуре около 140С и небольшом давлении.
2. Окисление. В промышленности алканы окисляют кислородом воздуха на марганцевых катализаторах при температуре около 200С. При этом расщепляются С–С-связи и получаются низкомолекулярные кислородсодержащие соединения – спирты, альдегиды, кетоны, карбоновые кислоты. Алканы горят на воздухе с выделением большого количества теплоты:
СН4 + 2О2 СО2 + 2Н2О + 890 кДж.
Алкены
Алкены (этиленовые углеводороды) – ненасыщенные углеводороды, молекулы которых содержат одну двойную связь С=С.
Общая формула алкенов – СnH2n.
Двойная связь образуется при помощи двух пар обобщенных электронов. Атомы углерода, связанные двойной связью, находятся в состоянии sp2-гибридизации, каждый из них образует 3 -связи, лежащие в одной плоскости под углом 120. Негибридные р-орбитали атомов углерода расположены перпендикулярно плоскости -связей и параллельны друг другу и вследствие «бокового» перекрывания образуют -связь, электронное облако которой расположено частично над, а частично под плоскостью молекулы.
Способы получения
1. Пиролиз алканов.Пиролиз – процессы химических превращений органических соединений, происходящие при высокой температуре.
Пиролиз алканов является важнейшим промышленным способом получения алкенов из высококипящих фракций нефти. Под действием сильного нагревания (до 700оС) в молекулах алканов гомолитически расщепляются -связи С–С и С–Н. При этом образуются различные свободные радикалы. В результате взаимодействия радикалов с молекулами алканов и друг с другом образуется смесь низкомолекулярных алканов, алкенов и водорода.

2. Дегидрирование алканов.

3. Дегидратация спиртов.
СН3–СН2–ОН
![]() СН2=СН2
+ Н2О
СН2=СН2
+ Н2О
При дегидратации спиртов водород предпочтительнее отщепляется по правилу А. М. Зайцева (1875 г.) – от того из соседних атомов углерода, который беднее водородом (наименее гидрогенизирован):

4. Дегидрогалогенирование галогенопроизводных. Этот процесс также протекает по правилу А.М. Зайцева:

5. Дегалогенирование дигалогенопроизводных.

Химические свойства. Характерная особенность р-электронов – их подвижность, они менее прочно удерживаются ядрами атомов, чем -электроны. Поэтому -связь под действием электрофильных реагентов легко поляризуется и гетеролитически рвется, в связи с чем для алкенов характерны реакции присоединения. Кроме этого, алкены легко вступают в реакции окисления и полимеризации по двойной связи.
1. Реакции электрофильного присоединения.
– Гидрогалогенирование (присоединение галогеноводорода).
СН3–СН=СН–СН3 + НСl СН3–СН2–СНСl–СН3
Если в реакции участвует несимметричный алкен (например, пропен), то преимущественное направление реакции определяется правилом В.В. Марковникова (1869 г.): при присоединении молекул типа НХ (где Х – атом галогена, группа ОН и др.) к несимметричным алкенам атом Н присоединяется к более гидрированному атому С молекулы алкена:
СН3–СН=СН2 + НВr СН3–СНВr–СН3.
пропен 2-бромпропан
Это можно объяснить исходя из следующих соображений:
1). Распределение электронной плотности в нереагирующей молекуле (статический фактор) – метильный радикал отталкивает от себя электронную плотность связи С–С. Вследствие этого происходит поляризация -связи:
![]()
Полярная молекула НВr ориентируется атомом Н к молекуле пропена за счет электростатического притяжения к электронам двойной связи; происходит ионный разрыв связи Н–Вr, и ион Н+ притягивается преимущественно к первому атому С молекулы пропена и присоединяется к нему за счет электронной пары -связи. На среднем атоме С молекулы пропена возникает заряд «+» (молекула превращается в карбкатион):
![]()
Затем бромид-ион присоединяется к положительно заряженному атому С карбкатиона:

2). Устойчивость
образующегося карбкатиона (динамический
фактор).
Взаимодействие иона Н+
с молекулой пропена теоретически может
привести и к образованию карбкатиона
![]() (ион пропения-1). Однако это не происходит,
т.к. в силу того, что алкильные радикалы
(СН3,
СН3–СН2)
отталкивают электронную плотность от
себя и гасят положительный заряд атома
углерода, ион пропения-2
(ион пропения-1). Однако это не происходит,
т.к. в силу того, что алкильные радикалы
(СН3,
СН3–СН2)
отталкивают электронную плотность от
себя и гасят положительный заряд атома
углерода, ион пропения-2
![]() оказывается устойчивее, чем ион
пропения-1. Это также говорит в пользу
направления реакции по правилу
Марковникова.
оказывается устойчивее, чем ион
пропения-1. Это также говорит в пользу
направления реакции по правилу
Марковникова.
– Гидратация. Этот процесс также протекает по правилу В. В. Марковникова:
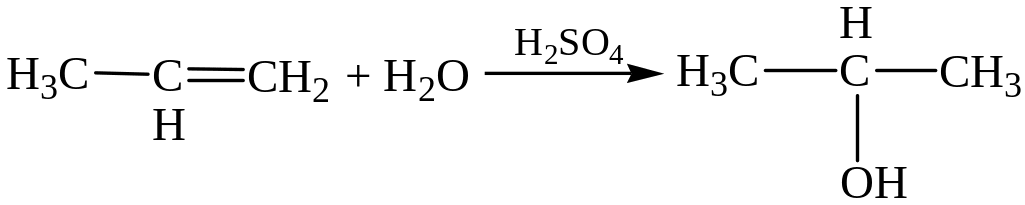
– Галогенирование (качественная реакция на двойную связь).
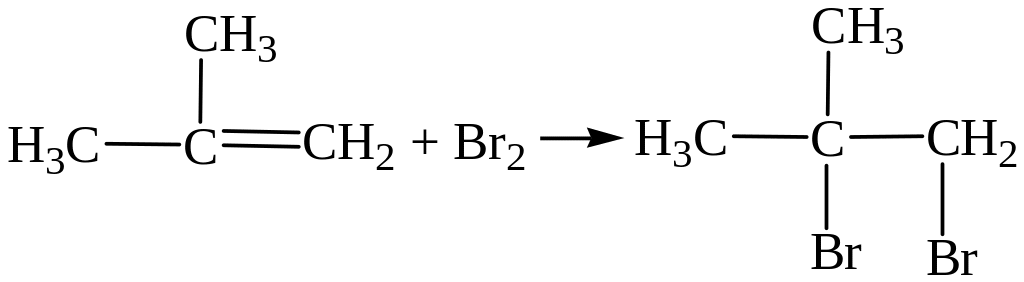
Наблюдается обесцвечивание бромной воды.
2. Реакции окисления и восстановления.
– Реакция Е.Е. Вагнера (1888 г.) – качественная реакция на двойную связь.
3СН2=СН2 + 2KMnO4 + 4H2O 3HO–CH2–CH2–OH + 2KOH + 2MnO2
этиленгликоль
Наблюдается выделение бурого осадка оксида марганца (IV) и обесцвечивание раствора перманганата калия.
В кислой среде реакция алкенов с перманганатом калия идет с разрывом связи С=С, поэтому образуются соответствующие карбоновые кислоты или кетоны:
5Н3C–CH=CH–CH3 + 8KMnO4 + 12H2SO4 10H3C–COOH + 8MnSO4 + 4K2SO4 + 12H2O
бутен-2 уксусная кислота
5Н3C–CH=C(СH3)–CH3 + 6KMnO4 + 9H2SO4 5H3C–COOH + 5H3C–CO–CH3 + 6MnSO4 + 3K2SO4 + 9H2O
2-метилбутен-2 уксусная кислота пропанон (ацетон)
– Гидрирование.
Н3C–CH=CH–CH3
+ Н2
![]() Н3C–CH2–CH2–CH3
Н3C–CH2–CH2–CH3
В качестве катализаторов в этой реакции, кроме Ni, могут использоваться Pt и Pd.
3. Реакции полимеризации.
Реакция полимеризации – это последовательное присоединение молекул ненасыщенных соединений друг к другу с образованием высокомолекулярного соединения – полимера.
Наиболее распространенными полимерами углеводородной природы являются полиэтилен и полипропилен. nН2С=СН2 (–СН2–СН2–)n
этилен полиэтилен
Алкадиены
Алкадиены (диеновые углеводороды) – ненасыщенные углеводороды, молекулы которых содержат 2 двойные связи С=С. Общая формула алкенов – СnH2n–2.
По взаимному расположению двойных связей различают следующие диеновые углеводороды.
1. Диены с кумулированными двойными связями содержат непосредственно примыкающие друг к другу двойные связи. Например: Н2С=С=СН2 – пропадиен (аллен).
2. Диены с сопряженными двойными связями. В этом случае в соединении двойные и одинарные связи чередуются. Например: Н2С=СН–СН=СН2 – бутадиен-1,3 (дивинил).
3. Диены с изолированными двойными связями. В этих соединениях двойные связи разделены в цепи одним и более sp3-гибридными атомами углерода. Например:
Н2С=СН–СН2–СН=СН2 – пентадиен-1,4.
Диены с изолированными двойными связями не отличаются по свойствам от алкенов.
Природа сопряженных двойных связей. Рассмотрим строение молекул алкадиенов с сопряженными двойными связями на примере молекулы бутадиена-1,3. В ней все атомы углерода находятся в состоянии sр2-гибридизации. Они лежат в одной плоскости. Четыре параллельные друг другу орбитали р-электронов перпендикулярны плоскости молекулы. При взаимодействии подвижных р-электронов двух сопряженных -связей возникает единое -электронное облако, охватывающее все 4 атома углерода. Отдельные р-электроны не закреплены попарно в определенных связях, а делокализованы, т.е. распределены по всей сопряженной системе, по всем находящимся в сопряжении связям, и простым, и кратным.
Взаимное влияние сопряженных связей проявляется в некотором выравнивании межъядерных расстояний. Длина центральной связи (0,148 нм) короче обычной -связи (0,154 нм), а кратные связи (0,136 нм) несколько длиннее обычной двойной связи (0,133 нм).
В связи с вышесказанным формулу бутадиена-1,3 часто изображают так:
![]()
Сопряженные системы обладают меньшим запасом энергии, т.е. они более устойчивы, чем соединения с изолированными двойными связями.
Способы получения. Для получения бутадиена-1,3 используют бутановую фракцию крекинг-процесса нефти или попутный нефтяной газ.
Синтетический способ получения бутадиена-1,3 из этанола был открыт в 1932 г. С.В. Лебедевым. Он заключается в одновременном дегидрировании и дегидратации этанола:
2С2Н5ОН
![]() СН2=СН–СН=СН2
+ Н2
+ 2Н2О.
СН2=СН–СН=СН2
+ Н2
+ 2Н2О.
В качестве катализаторов в этом процессе используют ZnO, Al2О3 и др.
2-Метил-бутадиен-1,3, или изопрен, впервые был получен из натурального каучука нагреванием его без доступа воздуха (сухая перегонка).
В настоящее время его получают из легких фракций углеводородов нефти:

Химические свойства. Характерны реакции электрофильного присоединения. Однако, в химическом поведении алкадиенов-1,3 есть особенности, связанные с наличием в их молекулах сопряжения. Так, в реакции присоединения могут быть получены два продукта – за счет присоединения по любой двойной связи (1,2-присоединение) или в результате 1,4-присоединения. Преимущественное протекание реакции по тому или иному пути зависит от конкретных условий.
1. Гидрирование.

2. Гидрогалогенирование.

Алкины
Алкины – ненасыщенные углеводороды, содержащие в молекуле тройную связь СС.
Общая формула алкинов – СnН2n–2 (алкины изомерны алкадиенам). простейшим представителем алкинов является ацетилен НССН.
В образовании тройной связи участвуют три пары обобщенных электронов. Атомы углерода, образующие тройную связь, находятся в состоянии sр-гибридизации. Каждый из них образует две -связи, направленные под углом 180, с атомами углерода и (или) водорода. Две негибридные р-орбитали каждого атома углерода расположены под прямым углом друг к другу. Они попарно перекрываются, образуя две -связи, расположенные в двух взаимно перпендикулярных плоскостях.
Способы получения. Сырьевыми источниками ацителена являются уголь, природный газ, нефть.
Прокаливанием угля в смеси с оксидом кальция в электрических печах получают карбид кальция, при разложении которого водой образуется ацетилен:
3С
+ СаО
![]() СаС2
+ СО; СаС2
+ 2Н2О
НССН
+ Са(ОН)2.
СаС2
+ СО; СаС2
+ 2Н2О
НССН
+ Са(ОН)2.
Этот способ применяют как в лабораториях, так и в промышленности, где он освоен еще в XIX в. Но карбидный ацетилен дорог вследствие больших затрат электроэнергии.
В
более новом способе ацетилен получают
термическим крекингом или электрокрекингом
метана: 2СН4
![]() НССН
+ 3Н2
НССН
+ 3Н2
и
гомологов метана: С2Н6
![]() НССН
+ 2Н2.
НССН
+ 2Н2.
Другой путь получения ацетилена – окислительный пиролиз – сожжение метана с недостаточным количеством воздуха. При этом идет частичное окисление метана:
6СН4 + О2 2НССН + 2СО + 10Н2.
Другие алкины получают из дигалогенопроизводных:
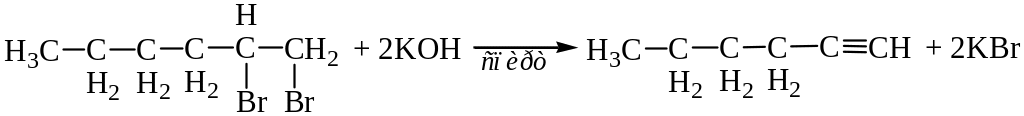
Химические свойства. Типичными реакциями для ацетилена и его гомологов являются реакции присоединения, протекающие аналогично соответствующим реакциям алкенов, но в две последовательные стадии.
Тройная связь окисляется труднее и в более жестких условиях, чем двойная. Термически она также более устойчива.
1. Реакции присоединения.
– Присоединение галогена (качественная реакция).
НССН
+ Br2
Br–CH=CH–Br
![]()
![]()
– Присоединение галогеноводородов.
НССН + HCl Н2С=СН–Cl винилхлорид (хлорвинил)
Реакции присоединения молекул типа НХ к гомологам ацетилена протекают по правилу В. В. Марковникова:

– Гидрирование алкинов протекает легче, чем гидрирование алкенов:
НССН
+ Н2
![]() Н2С=СН2
Н2С=СН2
![]() Н3С–СН3.
Н3С–СН3.
– Гидратация (реакция М. Г. Кучерова, 1881 г.).
При присоединении воды образуются оксосоединения, т.к. ненасыщенные спирты с группой ОН у атома углерода, при котором имеется двойная связь, нестойки и превращаются в карбонильные соединения – альдегиды или кетоны (правило А. П. Эльтекова, 1877 г.):


2. Реакции окисления.
– Горение. Ацетилен горит коптящим пламенем: 2С2Н2 + 5О2 4СО2 + 2Н2О
– Окисление раствором перманганата калия (качественная реакция).
3Н3С–СС–С2Н5 + 8KMnO4 + 4H2O 3H3C–COOH + 3C2H5–COOH + 8MnO2 + 8KOH
уксусная кислота пропионовая кислота
Наблюдается выделение бурого осадка оксида марганца (IV) и обесцвечивание раствора перманганата калия.
3. Реакции полимеризации и циклизации.
2НССН
![]() СН2=СН–ССН;
СН2=СН–ССН;
винилацетилен
