
- •Isbn 5-02-006396-7
- •Глава 1. Процессы переработки нефти ...................................................... 26
- •Глава 2. Процессы переработки угля и газа ............................................ 60
- •Глава 3. Олефиновые мономеры ................................................................ 81
- •Глава 4. Диеновые мономеры .................................................................... 118
- •Глава 5. Галогенсодержащие мономеры ................................................. 171
- •Глава 6. Виниловые мономеры с ароматическими и гетероцикли- ческими заместителями .............................................................. 212
- •Глава 7. Акриловые мономеры ................................................................ 241
- •Глава 8. Спирты и виниловые эфиры ...................................................... 283
- •Глава 9. Мономеры для простых полиэфиров ....................................... 313
- •Глава 10. Мономеры для сложных полиэфиров .................................... 346
- •Глава 11. Мономеры для полиамидов....................................................... 399
- •Глава 12. Мономеры для полиимидов...................................................... 470
- •Глава 13. Мономеры для полиуретанов................................................... 496
- •Глава 14. Мономеры для поликарбонатов…………………… 531
- •Глава 15. Мономеры для феноло- и амино-альдегидных полимеров 569
- •Глава 16. Кремнийорганические мономеры ........................................ 596
- •Глава 17. Другие металлсодержащие и неорганические мономеры 642 17.1. Мономеры для серосодержащих полимеров ...................................... 642
- •Глава 1
- •1.1. Термодеструктивные процессы
- •1.1.1. Атмосферно-вакуумная перегонка нефти
- •1.1.2. Висбрекинг
- •1.1.3. Термический крекинг
- •1.1.4. Термоконтактный крекинг
- •1.1.5. Пиролиз нефтяного сырья
- •1.1.6. Коксование
- •1.2. Каталитические процессы
- •1.2.1. Каталитический крекинг
- •1.2.2. Каталитический риформинг
- •1.2.3. Гидрокрекинг
- •1.2.4. Алкилирование
- •1.2.5. Изомеризация алканов
- •1.3. Структура современного
- •Глава 2
- •2.1 . Газификация угля
- •2.1.1. Автотермические процессы
- •2.1.2. Газификация в "кипящем слое"
- •2.1.3. Гидрогенизация угля
- •2.2. Переработка природных и попутных газов и
- •2.2.1. Переработка природных газов
- •2.2.2. Переработка газового конденсата
- •2.3. Химические основы производства водорода
- •2.3.1. Каталитическая конверсия углеводородов
- •2.3.2. Каталитическая конверсия оксида углерода
- •2.3.3. Общие сведения о технологии получения водорода
- •Глава 3
- •3.1. Низшие олефины
- •3.1.1. Сырье для производства низших олефинов
- •3.1.2. Получение этилена
- •3.1.3. Получение пропилена
- •3.1.4. Получение бутена-1
- •3.1.5. Получение изобутилена
- •3.2. Высшие олефины
- •3.2.1. Получение высших олефинов димеризацией и
- •3.2.2. Диспропорционирование олефинов
- •3.2.3. Димеризация и диспропорционирование
- •3.2.4. Получение высших олефинов из синтез-газа
- •3.2.5. Получение циклоолефинов
- •Глава 4
- •4.1. Бутадиен-1,3
- •4.1.1. Способ с.В. Лебедева
- •4.1.2. Способ и.И. Остромысленского
- •4.1.3. Получение бутадиена из ацетилена
- •4.1.4. Промышленные способы получения бутадиена
- •4.2. Изопрен
- •4.2.1. Двухстадийное получение изопрена из
- •4.2.2. Получение изопрена из изобутилена и формальдегида
- •4.2.3. Получение изопрена из изобутилена и метилаля
- •4.2.4. Получение изопрена дегидрированием углеводородов с
- •4.2.5. Получение изопрена из пропилена
- •4.2.6. Получение изопрена из ацетилена и ацетона
- •4.2.7. Получение изопрена жидкофазным окислением углеводородов
- •4.2.8. Получение изопрена из бутенов-2 и синтез-газа
- •4.3. Диеновые мономеры для получения
- •4.3.2. Получение производных норборнена
- •Глава 5
- •5.1. Хлоросодержащие мономеры
- •5.1.1. Теоретические основы процессов хлорирования углеводородов
- •5.1.2. Окислительное хлорирование
- •5.1.3.Гидрохлорирование
- •5.1.4. Дегидрохлорирование
- •5.1.5. Производство хлорорганических продуктов
- •5.1.6. Получение винилхлорида
- •5.1.7.Получение винилиденхлорида
- •5.1.8. Получение хлоропрена
- •5.1.9. Получение эпихлоргидрина
- •5.2. Фторсодержащие мономеры
- •5.2.1. Теоретические основы процессов фторирования
- •5.2.2. Механизм реакций фторирования
- •5.2.3. Способы фторирования алканов
- •5.2.4. Фторирующие агенты
- •5.2.5. Получение винилфторида
- •5.2.6. Получение винилиденфторида
- •5.2.7. Получение перфторпроизводных углеводородов
- •5.2.8. Получение других фторпроизводных углеводородов
- •5.2.9. Получение хладонов (фреонов)
- •Глава 6 виниловые мономеры с ароматическими и гетероциклическими заместителями
- •6.1. Стирол и его производные
- •6.1.1. Получение стирола Препаративные методы синтеза стирола
- •Промышленные методы синтеза стирола
- •6.1.2. Получение -метилстирола
- •6.2. Винилпиридины
- •6.2.1. Общая характеристика основных способов получения винилпиридинов
- •6.2.2. Промышленные методы получения винилпиридинов Синтез 5-винил-2-метилпиридина
- •Синтез 2- и 4-винилпиридинов и 2-винил-5-этилпиридина
- •6.3.1. Прямое винилирование -пирролидона ацетиленом
- •6.3.2 Косвенное винилирование -пирролидона
- •6.4.1. Получение n-винилкарбазола по реакции винилирования ацетиленом
- •6.4.2. Получение n-винилкарбазола по реакции винилового обмена
- •6.4.3. Получение 9-винилкарбазолов многостадийными методами
- •Разложение n-(2-гидроксиэтил)карбазола
- •Разложение 1-замещенных n-этилкарбазолов
- •6.5. Другие виниловые мономеры
- •6.5.1. Получение этилиденнорборнена
- •6.5.2. Получение винилтолуола
- •6.5.3. Получение винилкетонов
- •Синтез винилметилкетона
- •Синтез изопропенилметилкетона
- •Синтез винилфенилкетона
- •Синтез виниленкарбоната
- •Глава 7
- •7. 1. Акрилонитрил
- •7.1.1.Получение акрилонитрила через этиленоксид и этиленциангидрин
- •7.1.2.Окислительный аммонолиз пропилена
- •7.1.3.Получение акрилонитрила из ацетилена и синильной кислоты
- •7.1.4.Получение акрилонитрила через ацетальдегид и гидроксинитрил
- •7.2.1. Препаративные методы получения акриламида
- •7.2.2. Промышленные методы получения акриламида
- •7.3 Акриловая кислота
- •7.3.1.Гидролиз акрилонитрила
- •7.3.2.Гидрокарбоксилирование ацетилена
- •7.3.3. Парофазное окисление пропилена
- •7.3.4. Гидролиз этиленциангидрина
- •7.3.5. Гидролиз -пропиолактона
- •7.3.6. Окислительное карбонилирование этилена
- •7.4. Метакриловая кислота
- •7.4.1. Газофазное окисление изобутилена
- •7.4.2. Окисление метакролеина
- •7.4.3. Газофазное окисление метакролеина
- •7.5. Акрилаты
- •7.5.1. Получение акрилатов этерификацией акриловой метакриловой кислот
- •7.5.2. Получение акрилатов переэтерификацией
- •7.5.3. Получение акрилатов из этиленциангидрина
- •7.5.4. Получение акрилатов из ацетилена по реакции Реппе
- •7.5.5. Получение акрилатов из кетена и формальдегида
- •7.5.6. Получение акрилатов из акрилонитрила
- •7.6. Метакрилаты
- •7.6.1. Получение метилметакрилата из ацетона и циангидрина
- •7.6.2. Получение метилметакрилата из трет-бутилового спирта
- •7.6.3. Получение метилметакрилата из изобутилена
- •7.6.4. Новые методы получения метилметакрилата
- •7.6.5. Получение других алкилметакрилатов
- •7.7.Олигоэфиракрилаты
- •Глава 8
- •8.1. Поливиниловый и аллиловый спирты
- •8.2. Основы процессов винилирования
- •8.3. Простые виниловые эфиры
- •8.3.1. Получение простых виниловых эфиров
- •8.3.2. Другие методы получения простых виниловых эфиров
- •8.4. Сложные виниловые эфиры. Винилацетат
- •8.5. Производные поливилового спирта –
- •Глава 9
- •9.1. Формальдегид
- •9.1.1 Механизм и катализаторы
- •9.1.2. Получение формальдегида
- •9.2. Этиленоксид
- •9.2.1. Получение этиленоксида через этиленхлоргидрин
- •9.2.2. Прямое окисление этилена
- •9.3. Пропиленоксид
- •9.3.1. Получение пропиленоксида
- •9.3.2. Получение пропиленоксида окислением пропилена через пропиленхлоргидрин
- •9.4. Фениленоксид
- •9.5. Аллилглицидиловый эфир
- •9.6. Эпихлоргидрин
- •9.6.1. Получение эпихлоргидрина из глицерина
- •9.6.2. Получение эпихлоргидрина из аллилхлорида
- •9.7. Сульфоны
- •Глава 10 мономеры для сложных полиэфиров
- •10.1. Терефталевая кислота и диметилтерефталат
- •10.1.1. Процесс фирмы "Дюпон"
- •10.1.2. Процесс фирмы "Виттен"
- •10.1.3. Процесс фирмы "Aмoкo"
- •Промежуточные и побочные продукты окисления п-ксилола до терефталевой кислоты
- •Технология получения терефталевой кислоты
- •10.1.4. Одностадийный процесс внипим
- •10.1.5. Получение ароматических и гетероциклических карбоновых кислот путем термического превращения их щелочных солей
- •Превращения щелочных солей
- •10.1.6 Процесс фирмы "Мицубиси"
- •10.1.7. Получение терефталевой кислоты из угля
- •10.2. Малеиновый ангидрид
- •10.2.1 . Получение малеинового ангидрида окислением бензола в газовой фазе
- •10.2.2 . Получение малеинового ангидрида окислением бутана
- •10.2.3. Получение малеинового ангидрида окислением н-бутенов
- •10.2.4. Выделение малеинового ангидрида как побочного продукта в производстве фталевого ангидрида
- •10.3. Фталевый ангидрид
- •10.3.1. Парофазное окисление о-ксилола или нафталина
- •10.3.2. Жидкофазное окисление о-ксилола или нафталина
- •10.3.3. Процесс внииос
- •10.4. Фумаровая кислота
- •10.5. Дихлормалеиновая и дихлормуровая кислоты
- •10.5.1. Получение дихлормалеиновой кислоты и ее ангидрида
- •10.5.2. Получение дихлорфумаровой кислоты и ее ангидрида
- •10. 6. Нафталин-2,6-дикарбоновая кислота
- •10.7. Тиофен-2,5-дикарбоновая кислота
- •10.8. Азелаиновая кислота
- •10.9. Диолы
- •10.9.1. Получение этиленгликоля
- •10.9.2. Получение пропандиола-1,2
- •10.9.3. Получение бутандиола-1,4
- •Синтез бутандиола-1,4 на основе возобновляемого сырья (процесс фирмы "Квакер Оатс")
- •10.9.4. Получение 1,4-дигидроксиметилциклогексана
- •Глава 11
- •11.1. Мономеры для полиамидов, получаемых полимеризацией
- •11.1.1. Получение капролактама Методы синтеза капролактама
- •Капролактоновый процесс фирмы "Юнион Карбайд"
- •Нитроциклогексановый процесс фирмы "Дюпон"
- •Процесс фирмы «Байер»
- •Процесс фирмы "сниа Вискоза".
- •Основные стадии синтеза капролактама
- •Синтез капролактама из толуола
- •Фотохимический синтез капролактама
- •11.1.2. Получение валеролактама
- •11.1.3. Получение 7-аминогептановой кислоты
- •11.1.4. Получение каприлолактама
- •11.1.5. Получение 9-аминононановой кислоты
- •11.1.6. Получение 11-аминоундекановой кислоты
- •11.1.7. Получение лауролактама
- •Тримеризация бутадиена
- •Процесс фирмы "Хемише Халс"
- •Процесс фирмы "Убе"
- •11.1.8. Получение α-пирролидона
- •Восстановительное аминирование малеинового ангидрида
- •11.2. Мономеры для полиамидов, получаемых поликонденсацией дикарбоновых кислот и диаминов
- •11.2.1. Получение адипиновой кислоты
- •Синтез адипиновой кислоты из циклогексана
- •Синтез адипиновой кислоты из тетрагидрофурана
- •Синтез адипиновой кислоты из фенола
- •Другие промышленные методы синтезы адипиновой кислоты
- •11.2.2. Получение адиподинитрила
- •Синтез адиподинитрила из адипиновой кислоты
- •Синтез адиподинитрила из бутадиена
- •Синтез адиподинитрила из акрилонитрила электрохимическим методом
- •Каталитическая димеризация акрилонитрила
- •11.2.3. Получение гексаметилендиамина
- •Синтез гексаметилендиамина из адипиновой кислоты
- •Синтез гексаметилендиамина через гександиол-1,6
- •Синтез гексаметилендиамина из бутадиена
- •Димеризация акрилонитрила
- •11.2.4. Получение других мономеров для синтеза полиамидов
- •11.2.5. Получение м-ксилилендиамина
- •Бромирование м-ксилола
- •Окислительный аммонолиз
- •11.3.2. Получение волокнообразующих полиамидов на основе декандикарбоновой кислоты и 4,4-диаминодициклогексилметана
- •Синтез декандикарбоновой кислоты
- •11.4. Мономеры для полностью ароматических полиамидов
- •11.4.1. Получение хлорангидридов ароматических кислот
- •Синтез хлорангидриродов из ксилолов
- •Тионильный метод
- •11.4.2. Получение мономеров для волоконообразующих полиамидов поликонденсацией 4,4-диаминодифенилсульфона
- •11.4.3. Получение 2,5-бис(n-аминофенил)-1,3,4-оксадиазола
- •11.4.4. Получение 5,5'-Бис(м-аминофенил)-2,2'-бис(1,3,4-оксадиазолил)
- •11.4.5. Получение 4,4'-бис(п-аминофенил)-2,2-битиазола
- •11.4.6. Получение бис(м-аминофенил)тиазоло(5,4-d)тиазола
- •11.4.7. Получение мономеров для полиамидов на основе пиперазина и двухосновных кислот Синтез пиперазина
- •Глава 12
- •12.1. Пиромеллитовый диангидрид
- •12.1.1. Получение дурола
- •12.1.2.Получение пиромеллитового диангидрида
- •12.2. Диангидриды дифенилтетракарбоновых кислот
- •12.2.1. Получение диангидрида дифенил-2,2',3,3'-тетракарбоновой кислоты
- •12.2.2. Получение диангидрида дифенил-2,3,5,6-тетракарбоновой
- •12.2.3. Получение
- •12.2.4. Получение
- •12.3. Диангидриды нафталинтетракарбоновых кислот
- •12.3.1. Получение
- •12.3.2. Получение диангидрида нафталин-2,3,6,7-тетракарбоновой
- •12.4. Диангидриды бензофенон- и
- •12.4.1. Получение
- •12.4.2. Получение диангидрида перилен-3,4,9,10-тетракарбоновой кислоты
- •12.5. Ароматические диамины
- •12.5.1. Получение о- и м-фенилендиаминов
- •12.5.2. Получение n-фенилендиамина
- •12.5.3. Получение бензидина
- •12.6. Производные анилина
- •12.6.1 Получение анилинфталеина
- •12.6.2. Получение анилинфлуорена
- •12.6.3. Получение анилинантрона
- •Глава 13
- •13.1. Диамины
- •13.1.1. Получение диаминов восстановлением динитрилов
- •13.1.2. Получение диаминов
- •13.2. Диизоцианаты и изоцианаты
- •13.2.1. Фосгенирование аминов
- •13.2.2. Перегруппировки Курциуса, Гофмана и Лоссена
- •13.2.3. Получение толуилендиизоцианатов
- •13.2.5. Получение других диизоцианатов
- •13.2.6. Получение изоцианатов
- •13.3. Полиолы и простые полиэфиры
- •13.3.1. Получение β-диолов
- •13.3.2 Получение глицерина
- •13.3.3. Получение арилалифатические диолов
- •13.3.4. Получение мономеров для полиэфирполиолов
- •Глава 14
- •14.1. Бисфенолы
- •14.1.1. Получение бисфенола а
- •14.1.2. Получение галогензамещенных бисфенолов
- •14.2. Дифенилкарбонат
- •14.2.1. Получение дифенилкарбоната
- •14.2.2. Получение дифенилкарбоната
- •14.3. Бисфенол s
- •14.4. Резорцин
- •14.5. Циклокарбонаты
- •14.5.2. Получение циклокарбонатов
- •14.5.3. Получение циклокарбонатов на основе диолов
- •14.5.4. Получение полифункциональных циклокарбонатов
- •Глава 15
- •15.1. Мономеры для феноло-альдегидных полимеров
- •15.1.2. Получение бромфенолов и их производных – антипиренов
- •15.2. Мономеры для карбамидо-альдегидных
- •15.2.1. Получение карбамида
- •15.2.2. Получение меламина
- •Глава 16
- •16.1. Методы получения
- •16.1.1. Магнийорганический синтез
- •16.1.2. Прямой синтез
- •16.1.3. Дегидроконденсация кремнийгидридов
- •16.1.4. Конденсация кремнийгидридов
- •16.1.5 Гидросилилирование
- •16.2. Органохлорсиланы
- •16.2.1. Получение метил- и этилхлорсиланов
- •16.2.2. Получение органохлорсиланов термокаталитическим
- •16.2.3. Получение органохлорсиланов
- •16.2.4. Пиролитические способы получения органохлорсиланов
- •16.2.5. Получение кремнийорганических мономеров химическими
- •16.2.6 Получение тетрахлорсилана
- •16.2.7. Очистка диорганодихлорсиланов
- •16.3. Мономеры для силоксановых каучуков
- •16.3.1. Получение силоксановых каучуков
- •16.3.2. Получение силоксановых мономеров
- •16.3.3. Другие способы получения
- •16.4. Мономеры
- •16.4.1. Получение гексаорганоциклотрисилоксанов
- •16.4.2. Получение кремнийорганических уретанов
- •16.5. Мономеры для поликремнийуглеводородов -
- •Глава 17
- •17.1. Мономеры для серосодержащих полимеров
- •17.1.1. Получение сульфида и полисульфидов натрия
- •17.1.2. Получение 1,2-дихлорэтана
- •17.1.3. Получение n-дихлорбензола
- •17.2. Фосфазены (фосфонитрилы)
- •17.3. Борсодержащие мономеры
- •17.4. Азотсодержащие мономеры
- •17.4.1. Получение мономеров с азольными циклами
- •17.4.2. Получение ди- и тетракарбоновых кислот
- •17.4.3. Получение бензимидазолов
- •17.4.4. Получение бензоксазолов
- •17.4.5. Получение бисмалеимидов
- •17.5. Металлсодержащие мономеры и полимеры на их
- •17.5.1. Получение металлсодержащих мономеров, включающих кова-
- •17.5.2. Получение металлсодержащих мономеров ионного типа
- •17.5.3. Получение металлсодержащих мономеров,
- •17.5.4. Получение металлсодержащих мономеров π-типа
- •In the synthesis of monomers
4.1.4. Промышленные способы получения бутадиена
из бутана или бутена-1
Производство бутадиена из углеводородов С4 (н-бутан и н-бутены) мето-дами каталитического дегидрирования является основным направлением в со-временной технологии получения бутадиена. В промышленности используют различные технологические варианты получения бутадиена дегидрированием углеводородов С4. Применяемые процессы можно условно разделить на сле-дующие группы: дегидрирование бутана в бутены, дегидрирование бутенов; одностадийное дегидрирование бутана в бутадиен.
Характерной особенностью реакций дегидрирования с образованием олефинов является ограничение степени превращения условиями равновесия. Реакции дегидрирования всегда являются эндотермическими и, следовательно, равновесие в сторону образования ненасыщенных углеводородов должно сдви-гаться с повышением температуры. Степень превращения углеводородов воз-растает с повышением температуры и понижением давления. На практике при температурах выше 773-823 К даже в отсутствие катализаторов предельные уг-
|
128 |
|
|
леводороды претерпевают реакции изомеризации, крекинга и др. Поэтому про-цесс дегидрирования бутана проводят при температурах до 923-973 К, т.е. при температурах более низких, чем термодинамически оптимальные. Применение катализаторов позволяет достигнуть высокой скорости процесса при относи-тельно низкой температуре, когда еще не существенен вклад побочных реак-ций. Ввиду обратимости реакций дегидрирования –гидрирования и, следова-тельно, способности катализаторов ускорять обратимые реакции в обоих на-правлениях, эти реакции катализируются одними и теми же соединениями.
При дегидрировании вследствие отщепления водорода всегда происходит увеличение объема газа и понижение давления благоприятствует повышению степени конверсии. По этой причине процессы дегидрирования проводят при давлении, близком к атмосферному, а в некоторых случаях процесс осуществ-ляют в вакууме.
Иногда вместо применения вакуума предпочтительнее разбавлять реак-ционную массу газом, инертным в условиях реакции, или паром, что также приводит к снижению парциальных давлений реагентов и возрастанию равно-весной степени конверсии. Снижение парциального давления позволяет также понизить температуру реакции и, следовательно, уменьшить образование по-бочных продуктов.
Важным параметром при проведении реакции дегидрирования является время контакта реакционной смеси с катализатором. Рис. 4.1 иллюстрирует влияние температуры и времени реакции на содержание бутенов.
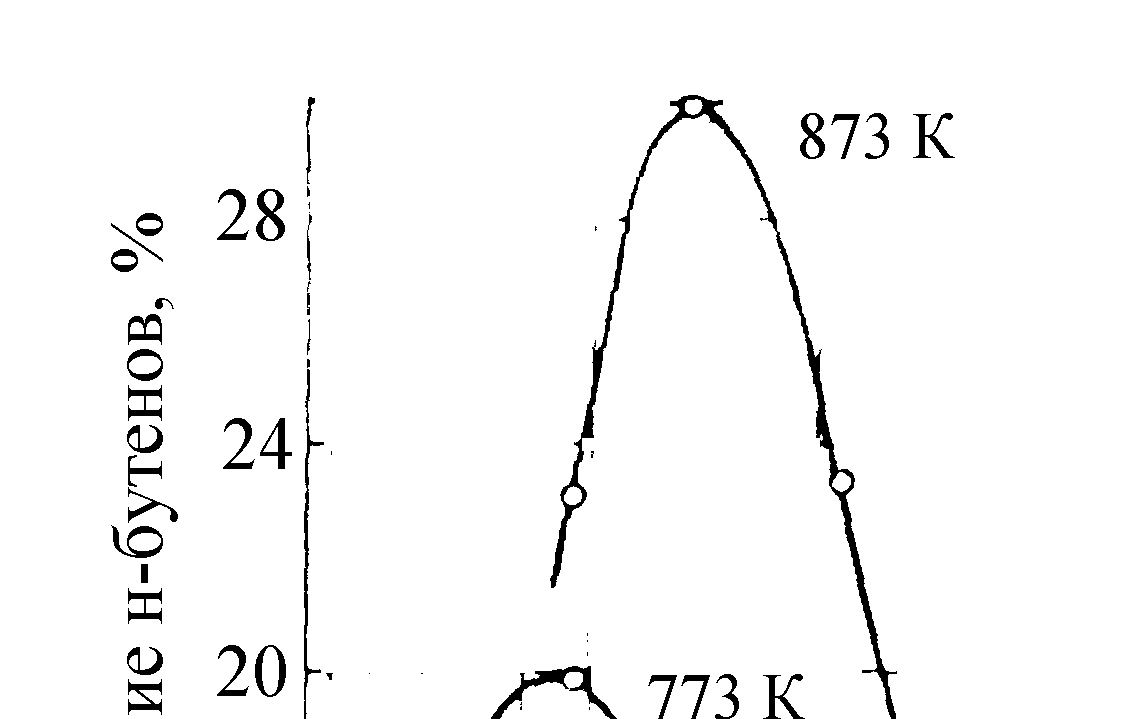
Рис. 4.1. Зависимость содержания н-бутенов при ка-
талитическом дегидрировании н-бутана от температуры
и времени реакции
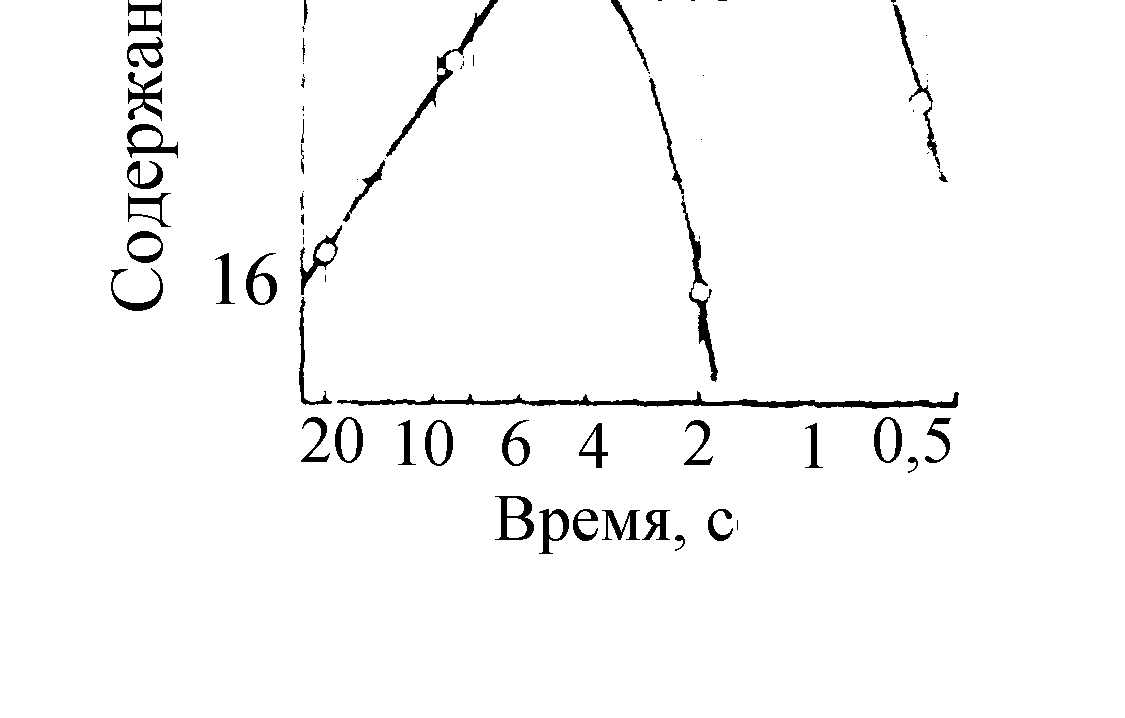
Максимальный выход олефинов не соот-ветствует рассчитанной равновесной концентрации при соответствующей тем-пературе: он всегда значительно ниже. С увеличением времени реакции выше оптимального выход олефинов уменьшается, так как увеличивается вклад по-бочных реакций.
Работы по каталитическому дегидрированию н-бутана по двухстадийно-му варианту: н-бутан н-бутен бутадиен были начаты в США в 1920-х го-
|
129 |
|
|
дах. В Советском Союзе фундаментальные исследования в этой области прово-дили С.В. Лебедев, Н.И. Шуйкин, А.А. Баландин, Б.А. Казанский и др.
Дегидрирование углеводородов С-С в олефины и диены
45
Дегидрирование бутана в бутен осуществляется в "кипящем слое" алю-мохромового катализатора при температуре в реакторе 838-853 К.
Бутены выделяют экстрактивной ректификацией водным ацетоном или диметилформамидом (ДМФА). Бутены дегидрируют в реакторах с неподвиж-ным слоем катализатора и с подводом тепла за счет разбавления исходной сме-си водяным паром при 853-893 К на хромкальцийникельфосфатном катализато-ре. Общий выход бутадиена - 60% (мас.) от теоретического.
В промышленности США и Западной Европы используется также односта-
дийный способ дегидрирования бутана до бутадиена по Гудри. По этому
способу дегидрированию подвергают бутан-бутеновую смесь в соотноше-
нии 60:40 при 873 К и ~1,225 кПа в периодических реакторах с неподвиж-
ным слоем алюмохромового катализатора без внешнего теплообмена. Про-
должительность процесса 7-10 мин. Регенерацию катализатора проводят
выжиганием отложившегося кокса в потоке воздуха. Из продуктов дегидри-
рования выделяют бутадиен и бутан-бутеновую фракцию, которую направ-
ляет далее в рецикл с добавлением в нее свежего бутана. Выход бутадиена
составляет до 14% (мас.) на пропущенный и до 54% (мас.) в расчете на пре-
вращенный бутан.
Оптимальная глубина дегидрирования н-бутана (~ 30% за проход) дости-гается при температуре выше 773 К, а для дегидрирования бутенов при атмо-сферном давлении равновесная глубина превращения даже при температуре 903 К не превышает 30%, что не приемлемо для промышленности. Увеличить выход целевого продукта можно путем снижения парциального давления, на-пример при проведении реакции при 823 К и парциальном давлении 10,1 кПа, что соответствует разбавлению бутена в соотношении 1:10.
Как правило, катализаторы дегидрирования н-бутана состоят из оксида хрома на оксиде алюминия. В качестве промотирующих добавок используют оксиды калия, кремния или бериллия. Общее содержание добавляемых оксидов составляет 1-5%. Промотирующее влияние оказывают также некоторые оксиды лантанидов, например Pr6O11 или Nd2O3. В алюмохромовых катализаторах, по-лучаемых пропиткой -А12О3 оксид хрома находится в виде -Сr2О3, имеющего корундовую структуру, которая образуется при нагревании СrО3 в присутствии кислорода воздуха.
Окислительное дегидрирование бутана и бутиленов
Отличительная особенность окислительного дегидрирования заключается в том, что равновесие реакции практически полностью смещено вправо. Это
|
130 |
|
|
позволяет проводить процесс при относительно низких температурах – 753 К. Промышленное значение имеют следующие способы окислительного дегидри-рования бутана и изопентана до бутадиена и изопрена: дегидрирование в при-сутствии иода, кислорода и поглотителей иодида водорода (иодное дегидриро-вание); каталитическое дегидрирование в присутствии кислорода.
Иодное дегидрирование. Наибольший интерес представляет процесс иодного дегидрирования н-бутана:
н-C4H10 + 2I2 C4H6 + 4HI .
При этом очень важно создание надежных методов рекуперации (возвра-щене в технологический цикл в качестве реагента) и рециркуляции иода, стои-мость которого в десятки раз превышает стоимость мономеров. Эффективное решение этой задачи состоит в практически необратимом связывании НI в зоне реакции оксидами или гидроксидами щелочных металлов:
2HI + MO MI2 + H2O,
2HI + M(OH)2 MI2 + 2H2O.
В качестве поглотителя могут быть использованы оксиды марганца.
Регенерация иода осуществляется кислородом:
MI2 + 0,5O2 MO + I2,
MI2 + 0,5O2 + H2O M(OH)2 +I2.
Из побочных реакций следует отметить образование иодидов и крекинг углеводородов.
При иодном дегидрировании равновесные глубины превращения н-бутана значительно выше, чем при обычном дегидрировании. Так, при 823 К и одном и том же начальном парциальном давлении ~30,3 кПа (при иодном де-гидрировании такое парциальное давление создается при мольном соотноше-нии С4Н10:I2=1:2) равновесные расчетные составы имеют следующие значения:
н-С4Н10 н-С4Н8 С4Н6
При обычном дегидрировании, % (мол.) 28 64 8
При иодном дегидрировании, % (мол.) 9,5 63 27,5
Таким образом, при иодном дегидрировании, т.е. при связывании водоро-да в виде HI, равновесные выходы бутадиена существенно увеличиваются по сравнению с выходами при обычном дегидрировании, а равновесные выходы бутенов в обоих случаях сопоставимы. Увеличение соотношения I:С4Н10 при-
2
водит к резкому повышению равновесного выхода бутадиена: при увеличении этого соотношения от 1 до 4 при 823 К выход возрастает с 13 до 77%. Влияние остальных параметров аналогично их влиянию при обычном дегидрировании: равновесные выходы бутадиена увеличиваются с повышением температуры и с уменьшением парциального давления бутана.
|
131 |
|
|
Окислительное дегидрирование н-бутана можно осуществлять и в при-сутствии катализаторов, например молибдата кобальта. Однако предложенные на сегодня катализаторы пока недостаточно эффективны.
Каталитическое дегидрирование. Реакция окислительного дегидриро-вания бутенов в бутадиен практически необратима, и поэтому можно достиг-нуть практически полного превращения бутенов:
C4H8 + 0,5O2 C4H6 + H2O.
Основной побочной реакцией является предельное окисление (горение) углеводородов с образованием СО2 и Н2О. В процессе окислительного дегидри-рования бутенов протекают побочные реакции, приводящие к образованию ки-слородсодержащих соединений: фурана, формальдегида, ацетальдегида, акро-леина, метакролеинов, муравьиной, уксусной, пропионовой и малеиновой ки-слот. Реакцию осуществляют при 723-773 К.
Окислительное дегидрирование олефинов до диолефинов можно прово-дить в присутствии например кальцийникельфосфатных или оксидных катали-заторов или тех же катализаторов, что и при обычном дегидрировании, в каче-стве которых используют вольфрамат висмута и фосфат висмута, смесь окси-дов олова и сурьмы, висмутмолибденовые и другие.
Одностадийное дегидирование бутана в бутадиен
Одностадийный процесс дегидрирования алканов:
C4H10 C4H6 + 2H2
имеет очевидные преимущества перед двухстадийным процессом ввиду отсут-ствия необходимости разделения газовых смесей после каждой стадии и более низких энерго- и капитальных затрат. На рис. 4.2 представлена зависимость со-става равновесной смеси при дегидрировании бутана в бутены и бутадиен от температуры и давления.

Рис. 4.2. Зависимость состава равно-
в есной
смеси при дегидрировании бу-
есной
смеси при дегидрировании бу-
тана в бутены и бутадиен от темпера-
туры и давления
Сплошные линии - 0,1 МПа, штриховые
-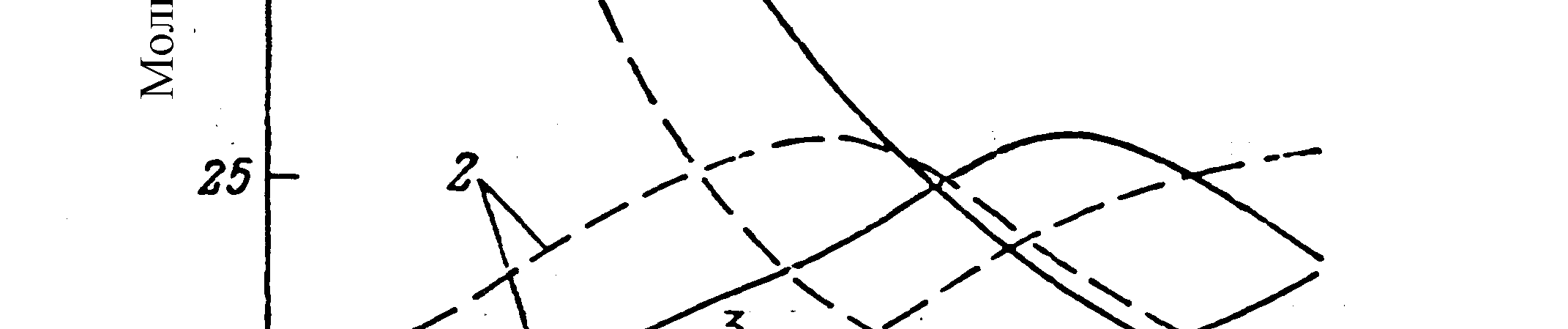 0,01 МПа.
0,01 МПа.
1 – бутан; 2 – бутены; 3 – бутадиен

|
132 |
|
|
Термодинамические расчеты показывают, что равновесный выход диена существенно возрастает с повышением температуры и с уменьшением парци-ального давления алкана. Поскольку повышение температуры связано с поте-рей селективности реакции, одностадийное получение диенов из алканов было реализовано в условиях вакуумного дегидрирования. В одностадийном процес-се дегидрирования используют алюмохромовые катализаторы, содержащие 18-30% оксида хрома.
Фирма "Гудри" (США) впервые реализовала процесс получения бутадие-на из бутана в одну стадию (аналогично процессу получения изопрена из изо-пентана). В присутствии алюмохромового катализатора протекают побочные превращения бутана, бутенов и бутадиена. Применение алюмохромового ката-лизатора исключает использование водяного пара в качестве разбавителя. Принципиальная технологическая схема этого процесса, который проводят под вакуумом (0,015-0,020 МПа) в стационарном слое катализатора, приведена на рис. 4.3.
![]()
![]()
![]()
![]()
![]()
![]()
![]()
Рис. 4.3. Принципиальная технологическая схема процесса одностадийно-
го дегидрирования бутана
1 - испаритель; 2 - трубчатая печь; 3 - топка; 4 - реакторы; 5 - котел-
утилизатор; 6 - скруббер; 7 - холодильник; 8 - турбокомпрес-
сор; 9 - абсорбер; 10 - десорбер; 11, 12 - ректификационные колонны;
13 - узел экстрактивной ректификации.
Потоки: I - свежий бутан; II - возвратная бутан-бутиленовая фракция;
III - воздух; IV - топливный газ; V - линия вакуума; VI - сброс в ат-
мосферу; VII - отдувкн в топливную сеть; VIII - углеводороды С3 на
сжигание; IX - фракция С4-С12; X - бутадиен
Сырье - смесь бутана и возвратной бутан-бутеновой фракции - испаряется в испарителе 1 и при 313 К поступает в трубчатую печь 2. Перегретые пары сы-
ч-1 направляют в реактор 4, где при 863-898 К и остаточ-рьясоскоростью 240
ном давлении 11,3-22,7 кПа происходит процесс дегидрирования. Реактор представляет собой горизонтальный цилиндрический аппарат диаметром 6 м и длиной 12 м. Полный рабочий цикл продолжается 21 мин. 30 с., дегидрирова-
|
133 |
|
|
ние - 8 мин. 15 с., продувка паром, опорожнение реактора - 2 мин. 35 с. Из ре-акторного блока контактный газ подают в орошаемый охлаждающим маслом скруббер 6, в котором его охлаждают до 328 К, и затем в блок выделения бута-диена.
Конверсия бутана в одностадийном процессе составляет ~20%, а выход бутадиена 50-55% на превращенное сырье. Контактный газ содержит 37-39% бутана, 23-25% бутенов, 12-13% бутадиена.
Основные параметры процессов дегидрирования алкенов С4-С5 приведе-ны ниже:
-
Фракция
Фракция
Параметр
бутенов
изопентенов
Температура в реакторе, К |
873-923 |
873-923 |
Объемная скорость подачи сырья, ч-1 |
130-180 |
150-220 |
Мольное соотношение алкен:водяной пар 1:20 1:20
Температура регенерации катализатора, К 873-923 873-923
Перепад давления по слою катализатора, МПа 0,05-0,09 0,04-0,09
Степень конверсии исходного сырья, % 40 40-43
Селективность образования диена, % 85 76
Выход диена в расчете на пропущенное сырье, % 33 32-33
Содержание в контактном газе, %
Алкенов 59 45
-
Диена
24
25
Выделение бутадиена
Во всех процессах бутадиен получается в смеси с другими углеводорода-ми, близкими к нему по летучести. Выделение из таких смесей концентриро-ванного бутадиена, используемого для производства каучука, является весьма сложной задачей. Для стереоспецифической полимеризации необходим бутади-ен, тщательно очищенный от примесей других углеводородов диенового и аце-тиленового ряда и соединений неуглеводородного характера. В России для сте-реоспецифической полимеризации применяется бутадиен с концентрацией не ниже 99% (масс.) и содержанием примесей в нем не выше (% мас.):
Ацетиленовые углеводороды……………………0,005
Алленовые углеводороды………………………..0,01-0,03
Циклопентадиен……………………………….….0,001
Карбонильные соединения……………………….0,01
Азотистые соединения…………………………0,001-0,002
(в расчете на азот)
В табл. 4.2 приведен углеводородный состав продуктов дегидрирования бутана, бутенов и фракции С4 пиролиза бензина.
|
134 |
|
|
Таблица 4.2. Углеводородный состав продуктов дегидрирования бутана, бутенов
и фракции С4 пиролиза бензина ( в % (мас.))
Дегидрирование бутана Дегидрирование бутенов Пиролиз бензина
обычное вакуумное окисли-обычное на окислительное средний жесткий
на алю-на алюмо-тельное с кальций-на фосфор-при при
Компонент
мохромо-хромовом иодом и никель-висмут-1033 К1123 К
вом ката-катализа-акцепто-фосфатном молибденовом
лизаторе торе ром катализаторекатализаторе
С1-С3 |
9,48 |
4,75 |
9,20 |
2,45 |
0,05 |
1,1 |
0,31 |
Изобутан |
22,45 |
2,05 |
0,10 |
0,40 |
0,25 |
2,5 |
|
|
|
|
|
|
|
|
6,68 |
н-Бутан |
50,60 |
47,35 |
14,50 |
7,30 |
8,50 |
9,3 |
|
Изобутен |
1,90 |
5,5 |
1,50 |
8,55 |
- |
29,0 |
23,98 |
Бутен-1 |
10,40 |
9,90 |
2,90 |
18,30 |
4,80 |
14,0 |
6,27 |
Бутен-2 |
23,30 |
15,75 |
7,80 |
29,32 |
16,80 |
10,0 |
7,75 |
Бутадиен |
1,50 |
14,00 |
63,10 |
32,95 |
68,80 |
32,7 |
50,08 |
С5 |
0,31 |
0,63 |
0,70 |
0,50 |
0,74 |
0,5 |
0,6 |
|
|
|
Вредные |
примеси |
|
|
|
Пропин |
0,002 |
0,005 |
0,20 |
0,013 |
0,003 |
0,24 |
0,86 |
Бутин-1 |
0,005 |
0,005 |
0,07 |
0,040 |
- |
0,11 |
- |
Аллен |
- |
0,003 |
0,04 |
0,015 |
0,008 |
0,17 |
- |
Метилаллен |
0,003 |
0,025 |
0,09 |
0,09 |
- |
0,04 |
- |
Циклопента-0,04 0,02 0,2 0,1 0,03 0,03 - диен
Для выделения бутадиена из различных бутадиенсодержащих фракций в промышленности используют два метода: экстрактивную ректификацию с раз-личными полярными агентами и хемосорбцию медноаммиачноацетатными рас-творами.
При экстрактивной ректификации в качестве разделяющих агентов ис-пользуют N-метилпирролидон, диметилформамид и диметилацетамид.
Хемосорбция основана на образовании комплексных соединений нена-сыщнных углеводородов (преимущественно диенов) с солями металлов пере-менной валентности. Промышленное применение для выделения бутадиена хе-мосорбцией нашел способ с использованием водноаммиачного раствора ацета-та одновалентной меди. Взаимодействие бутадиена и бутенов с медно-аммиачным раствором происходит с образованием комплексов:
(CH3COO)2Cu2(NH3)4 + C4H6 C4H6(NH3)3Cu2(CH3COO)2 + NH3.
Процесс связывания бутадиена носит характер вытеснения молекулы ам-
миака из внутренней координационной сферы центрального атома молеку-
лой углеводорода.
Технологические схемы установок хемосорбции включают три основные стадии:
|
135 |
|
|
- поглощение, на которой бутадиен вместе с небольшим количеством дру-гих ненасыщенных углеводородов растворяется в экстрагенте;
- обогащение, при котором бутены удаляются из раствора;
- десорбция, при которой бутадиен практически полностью отгоняется из раствора.
Обогащение бутадиена осуществляется за счет подачи части десорбиро-ванного бутадиена противотоком к насыщенному хемосорбенту, в результате чего поглощенные бутилены замещаются в комплексе на бутадиен.
Десорбция бутадиена может осуществляться за счет разрушения ком-плекса нагреванием или уменьшением парциального давления бутадиена в сис-теме путем создания вакуума или продувкой хемосорбента инертным газом или паром.
