
- •Полипептиды и их физиологическая роль
- •Врожденные и приобретенные нарушения аминокислотного обмена у человека
- •Влияние белковой недостаточности
- •Липиды Лекция № 1
- •Биологические функции липидов
- •Лекция № 2
- •Лекция № 3
- •Углеводы
- •Усваиваемые и не усваиваемые углеводы
- •Окисление, катализируемое ферментами
- •Процессы брожения
- •Функции моно-, олиго- и полисахаридов в пищевых продуктах
- •Целлюлоза.
- •Гемицеллюлоза
- •Пектиновые вещества
- •Методы определения углеводов в пищевых продуктах.
- •Вещества вторичного происхождения
- •Роль гликозидов в растении
- •Эфирные масла
- •Роль эфирных масел в растении
- •Получение эфирных масел
- •Использование эфирных масел
- •Политерпены
- •Биосинтез терпенов и терпеноидов
- •Алкалоиды
- •Протоалкалоиды
- •Псевдоалкалоиды (терпеноидные алкалоиды)
- •Биосинтез алкалоидов
- •Функции алкалоидов в растении
- •Минеральные вещества
- •Макроэлементы
- •Микроэлементы
- •Буферные системы организма и пищевые кислоты
- •Протолитический баланс
- •Кислоты, поступающие с пищей
- •Физические и химические свойства воды и льда
- •Структура и свойства молекулы воды
- •Свободная и связанная влага в пищевых продуктах
- •Активность воды
- •Образование водородных связей
- •Активность воды
- •Изотермы сорбции
- •Активность воды и стабильность пищевых продуктов
- •Роль льда в стабильности пищевых продуктов
- •Способы борьбы с вредителями запасов
- •Способы применения пестицидов (инсектицидов)
Пищевая химия
Население земного шара использует в пищу огромное многообразие продуктов питания, которое складывается из различных комбинаций пищевых веществ: белков, жиров, углеводов, витаминов, минеральных веществ, воды, вторичных продуктов питания. Все составляющие выполняют свою функцию, способствуя нормальной жизнедеятельности человека. Углеводы выполняют роль поставщиков энергии, жиры, и, особенно, белки, кроме этого являются необходимым материалом для постоянно протекающих процессов обновления клеточных и субклеточных структур.
Каждому компоненту питания соответствует своя сфера влияния. Например, скелетные мышцы, клетки нервной системы используют для своей жизнедеятельности в качестве источника энергии преимущественно глюкозу, тогда как для работы сердечной мышцы необходимы в значительном количестве жирные кислоты. Кальций необходим для нормальной структуры костей, усваивается он одновременно с фосфором, т.е. должен сохраняться кальциево-фосфатный баланс.
Тем не менее, основными компонентами питания являются белки, липиды и углеводы. К настоящему времени выяснено, что оптимальным в рационе практически здорового человека является соотношение белков, жиров, и углеводов близкое к 1:1,2:4. Это соотношение наиболее благоприятно для максимального удовлетворения как пластических, так и энергетических потребностей человека.
Пищевая химия – это наука о химическом составе продуктов питания, пищевых систем в целом (сырье, полупродукты, готовые продукты), изменениях химического состава пищи при хранении, переработке под воздействием различных факторов (физических, химических, биохимических). Важная роль отводится пониманию процессов, происходящих в живых биосистемах при усвоении пищи, а также иных функциях основных биополимеров, исключая питательные. Большое внимание уделяется процессам биохимическим, протекающим под влиянием ферментов. Необходимо познакомиться с факторами, определяющими пищевую ценность и сохранность продуктов, с влиянием структуры на пищевую ценность продуктов питания. В ходе изучения данного курса предстоит познакомиться с методами выделения, разделения и очистки пищевых веществ (белков, углеводов, липидов). Необходимо познакомиться с ролью воды в пищевых системах, влиянием пищевых кислот, макро- и микроэлементов на функционирование пищевых систем. При изучении данного курса рассматриваются методы анализа сырья и готовой продукции.
В задачи и цели данного предмета входит:
а) показать тесную взаимосвязь химии,биохимии и биоорганики по законам которых регулируется жизнедеятельность всех живых систем;
б) показать общность и особенность основных законов химии в приложении с биосистемой;
в) изучить химический состав пищевых систем, полноценность питания и его экологическую безопасность; рассмотреть и определить роль таких основных составляющих пищи как белки, липиды, углеводы, витамины, микро- и макроэлементы и какие процессы происходят с ними при хранении, переработке а также в процессе жизнидеятельности человека;
г) познакомиться с процессами выделения, разделения и очистки таких основных ингибиторов пищи как белки, углеводы, липиды;
д) рассмотреть экологические и санитарно-гигиенические аспекты получения,применения,хранения продуктов питания;
е) познакомиться с методами анализа сырья и готовой продукции;
ж) познакомиться с основными вредителями запасов пищевых продуктов, а также методами и средствами сохранения пищевых продуктов.
Аминокислоты, полипептиды, белки
Аминокислоты – это органические соединения, содержащие два типа функциональных групп с противоположными свойствами – аминогруппу (NH2-) и карбоксильную группу (-СООН). Они играют исключительно важную роль в жизни животных и растительных организмов. Замечательным свойством живой природы является способность соединять аминокислоты в различных комбинациях и последовательностях с образованием полипептидов и белков.
Благодаря наличию разноплановых групп аминокислоты способны к таутомерным превращениям:

1 - ТНС - таутомер с неионизованной структурой;
2 - ТБИ – таутомер биполярно-ионный.
В водных растворах и в твердом состоянии аминокислоты существуют в виде биполярного иона. Это проявляется в их физических свойствах. Так, аминокислоты – это бесцветные вещества с высокими Tпл . Но в реакциях также имеется неионизованная форма,а полностью ионизована когда находится в изоэлектрической точке.
Общее число встречающихся в природе аминокислот достаточно велико, их количество более 300. Основная часть представлена α-аминокислотами. При этом α-аминокислоты, в особенности биогенные аминокислоты, представлены в ассиметрическом виде. Во всех (кроме глицина) природных -аминокислотах -углеродный атом асимметричный и они существуют в виде двух (L- и D-) энантиомеров. Протеиногенные, т.е. участвующие в синтезе белков, аминокислоты существуют только в L-форме. В составе как растительных, так и животных белков найдено 20 аминокислот. Это: аланин, аргинин, аспарагин, аспарагиновая кислота, валин, гистидин, глицин, глютамин, глютаминовая кислота, изолейцин, лейцин, лизин, метионин, пролин, серин, тирозин, треонин, триптофан, фенилаланин, цистеин. Кроме того, эти аминокислоты могут находиться в клетке и в свободном состоянии.
В живой природе синтезируются и D-аминокислоты в виде свободных аминокислот или в составе коротких пептидов. Например, D-фенилаланин обнаружен в составе антибиотика грамицидина, D-пролин – в алкалоидах спорыньи, D-аспарагиновая кислота найдена в морских водорослях. Многочисленные исследования показали, что D-аминокислоты появляются в растениях в неблагоприятных условиях произрастания.
Интересно, что большинство аминокислот L-ряда имеют сладкий вкус, а D-ряда – горькие или безвкусные.
Таким образом, одна из классификаций аминокислот может быть представлена как:
1. аминокислоты, входящие в состав белка;
2. аминокислоты, образующиеся только в процессе синтеза белка;
3. свободные аминокислоты.
Основным источником -аминокислот для живых систем служат пищевые белки. Многие аминокислоты синтезируются в организме животных, но некоторые из них не синтезируются и должны поступать с пищей. Такие аминокислоты называются незаменимыми или эсенциальными. Таких аминокислот – восемь. Это: лейцин, изолейцин, валин, фенилаланин, триптофан, треонин, лизин, метионин. И две – частично заменимые. Это: аргинин и гистидин.
20 важнейших аминокислот можно сгруппировать на основе свойств заместителя R в четыре группы:
1 группа - -аминокислоты с неполярным (гидрофобным) заместителем R. Эти восемь аминокислот - аланин, валин, лейцин, изолейцин, пролин, фенилаланин, триптофан и метионин - трудно растворимы в воде.
2 группа, где R – неионизирующийся полярный заместитель, проявляющий гидрофильные свойства. В эту группу входят пять аминокислот: глицин, серин, треонин, аспарагин и глутамин, они лучше растворяются в воде.
3 группа, где R – полярный заместитель, проявляющий гидрофильные и кислотные свойства. Сюда относятся аспарагиновая и глутаминовая кислоты, цистеин и тирозин. Эти аминокислоты называют кислотными за счет диссоциации -СООН групп в аспарагиновой и глутаминовой кислотах, -ОН группы в тирозине (фенольного типа), -SH группы в цистеине.
4 группа, где R – полярный заместитель, проявляющий основные свойства. Сюда входит три аминокислоты: лизин, аргинин и гистидин. Основные свойства обеспечены присутствием NH2-групп в лизине и аргинине и азотсодержащего кольца в гистидине.
Помимо тех реакций, которые изучаются в курсе органической химии – кислотно-основное равновесие, алкилирование, ацилирование – есть реакции, которые имеют важное значение для биологических систем:
Тиол-дисульфидное равновесие протекает для аминокислот, содержащих SH-группу. Например, цистеин легко окисляется, образуя цистин-дисульфид цистеина:

Цистеин и цистин составляют сопряженную восстановительно-окислительную пару, для которой характерно тиол-дисульфидное равновесие. Этот процесс очень часто протекает в биологических системах. Значение нормального восстановительного потенциала для этой пары 0= -0,22В. Это свидетельствует о том, что восстановительные свойства преобладают. Поэтому в биологических системах цистеин выполняет роль эффективного антиоксиданта, является радиопротектором. Он также блокирует другие токсиканты, например, атомарный водород.
Антиоксиданты – вещества, обратимо реагирующие со свободными радикалами и окислителями и предохраняющие от их воздействия жизненно важные метаболиты.
Цистеин был первым препаратом, проявившим противолучевое действие. При радиационном воздействии в водных средах организма возникают сильные окислители: ОН, НО2, Н2О2, О2. Кроме этого, возникают и другие токсиканты – короткоживущие сильные восстановители, например, атомарный водород. Окислительно-восстановительная пара цистеин-цистин активно взаимодействует с этими и другими агрессивными токсичными частицами, нейтрализуя их. Легкое и быстрое, за счет фермента цистеинредуктазы, взаимодействие тиольных групп двух молекул цистеина с образованием дисульфидной связи и обратимость этой реакции играют важную роль в регуляции процессов в организме.
При исчерпывающем окислении тиольной группы цистеина, последний переходит в цистеиновую кислоту, появление которой способствует протеканию реакции декарбоксилирования с образованием таурина, который взаимодействует с холевой кислотой, давая таурохолевую кислоту, принимающую участие в эмульгировании и всасывании жиров.
таурин

таурохолевая кислота
Содержание аминов в живых организмах может резко возрастать при недостатке калия. Однако, в растительных организмах они обычно не накапливаются, а вовлекаются в обмен веществ. Основной путь их превращения – окисление под действием моноаминооксидаз:
O2
R-CH2-NH2 R-CHO + NH3
ферм.
Окисление диаминов катализируется диаминооксидазами. Дальнейший путь их превращения следующий:
нутресцин

пирролидин кадаверин пиперидин
Кроме того, из растительных аминов в растениях синтезируются различные гетероциклы, в том числе алкалоиды.
Из других реакций следует упомянуть:
а) декарбоксилирование, которое протекает под воздействием фермента декарбоксилазы и кофермента пиридоксальфосфата. В результате образуются биогенные амины:
серин – Н2NCH2CH2OH
цистеин – Н2NCH2CH2SH
лизин - Н2N(CH2)5NH2
гистидин (гистамин)

трипрофан (триптамин)

аспарагиновая кислота - -аланин
глутамин - -аминомасляная кислота
Ряд процессов декарбонилирования играет положительную роль, давая нейрогормоны, медитаторы рецепторов и т.д.; другие процессы (образование диаминов) вызывают аллергические реакции и нежелательны.
Триптомин и серотонин оказывают сосудоссужающее действие, помиимо этого, серотонин участвует в регуляции артериального давления,почечной фильтрации, и вместе с диамином является нейромедиатором.
Широким спектром биологической активности обладает гистамин: сосудорасширяющее действие, регулирование синтеза лейкоцитов. Активация и выработка соляной кислоты в желудочном соке.
Гистамин обладает аллергическим действием и синтез его интенсифицируется при травмах, стрессах, принятии лекарств и других ксенобиотиков.
б) дезаминирование и переаминирование аминокислот
Прямое дезаминирование:
Характерно для тех α-аминокислот ,у которых в β-положении содержится электроно-акцептерная группа, например: гидроксильная или тиольная.
Процесс проходит в присутствии перодоксальфосфата и характерен для серина,триамина или цистеина, и катализируется определенным ферментом:
Например:

I стадия - реакция отщепления и II стадия (ен-иминная таутомерия) сопровождается внутримолекулярным диспропорционированием (дисмутация внутримолекулярная).
Транспереаминирование:

В организме также имеют место различные реакции окислительного дезаминирования:
- частичное дезаминирование
В него вступают аргинин,взаимодействующий с молекулярным кислородом в присутствии фермента NO-синтазы и кофермента НАДФ(Н):
 Окись
азота очень быстро взаимодействует в
организме расходуясь на утилизацию
ксенобиотиков и регуляцию кровяного
давления,обладает свойством расслаблять
мышцы кровяных сосудов.
Окись
азота очень быстро взаимодействует в
организме расходуясь на утилизацию
ксенобиотиков и регуляцию кровяного
давления,обладает свойством расслаблять
мышцы кровяных сосудов.
Аланин, аспарагиновая и глутаминовая кислоты под действием ферментов дегидрогеназ в присутствии коферментов НАД(+) или НАДФ(+) способны подвергаться окислительному дезаминированию с образованием кетокислот:

Особенностью окислительного дезаминирования является способность протекания обратной реакции. Так, из 2-оксиглутатмата в присутствии гидрогеназ и ферментов НАД(Н) или НАДФ(Н) при реакции с ионом NH4+ образуется глутамат.
Серин, треанин и цистеин также способны вступать в реакции окислительного дезаминирования,специфически катализируемые дегидротазой:

Аспарагиновая кислота,котрая благодаря присутствию акцепторной СООН-группы под действием фермента аспартатаммиаклиазы, способна к реакциям внутримолекулярного дезаминирования:

В природных источниках реже протекают реакции восстановленного дезаминирования:

Восстановленное дезаминирование обнаружено в растительном мире,в биосистемах животного происхождения,основное – окислительное дезаминирование.
в) аминокислоты-медитаторы; медитаторы (от лат. mediator – посредник) – это вещества, с помощью которых в нервной системе осуществляется передача непрерывных сигналов от одной клетки к другой. Они обеспечивают функционирование нервной системы. Роль медиаторов выполняют такие аминокислоты как глутаминовая, аспарагиновая, глицин и непротеиногенная -аминомасляная кислота (ГАМК). Они выполняют много функций в организме – участвуют в терморегуляции, деятельности сердечно-нервной системы, регуляции сна и бодрствования;
г) пигменты (меланины, от греч. melus – черный); эти темноокрашенные пигменты образуются из тирозина. Происходит это в результате нескольких окислительных процессов непосредственно в организме.

T - тирозиназа; M – меланины.
Меланины придают окраску покровам животных. Они определяют пигментацию кожи, волос, роговицы глаз. Образование меланинов усиливается под действием ультрафиолетовых лучей (загар). Клетки, продуцирующие меланины могут давать начало злокачественным опухолям – меланомам. При врожденном отсутствии тирозиназы наблюдается альбинизм – отсутствие пигментации кожи, волос, светобоязнь;
е) аминокислоты-предшественники;
метионин – предшественник фосфолипидов;
глицин – предшественник пуринового кольца гемма крови, также взаимодействует с бензойной кислотой, давая гиппуровую кислоту (таким образом выводится из организма токсичная бензойная кислота):

Серосодержащие аминокислоты являются предшественниками серосодержащих соединений либо N и S-содержащих гетероциклических соединений,выполняющих роль фиксаторов и носителей ароматов для мясных продуктов:
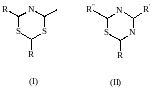
Т.е., производное 3,4,6-триалкил-1,3,5- диазонанов придают запах и вкус гавяжьему бульону. Обнаружены в мясе говядины, баранины, креветках и в некоторых растительных культурах: сое, красном перце. Представители двух структур также являются носителями запахов и ароматов.
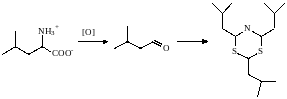
Образуются они в процессе переработки, и полагают, что он идет следующим образом:
 Запах бекона,образующийся
при готовке свинины дает продукт
разложения лейцина до изовалерьянового
альдегида,который далее вступает в
реакцию с NH3
и H2S:
Запах бекона,образующийся
при готовке свинины дает продукт
разложения лейцина до изовалерьянового
альдегида,который далее вступает в
реакцию с NH3
и H2S:
Аминокислоты могут использоваться в качестве лекарственных средств.
Так, глутаминовая кислота применяется в детской и взрослой психиатрии. У детей с частичном даутонизмом, а во взрослой психиатрии – при лечении эпелепсии. Также она применяется при комплексной терапии лечения язвенной болезни.
Получаемая из неё декарбоксилированием γ- аминомасляная кислота входит в состав лекарственного средства гаммалон,применяемого при нарушениях мозгового кравообращения, послеинсультной терапии при атеросклерозе, потери памяти. Аспарагиновая кислота способствует повышению насыщением кислорода сердечные мышцы (аспартам), также в кардиологии – панангин,который включает в себя аспартат К и Mg, применяется при профилактике и лечении аритмии и ишемической болезни сердца.
Метионин обладает радиопротекторными действиями, прописывается при отравлении эндоксинами бактериального свойства, выпускается в виде лекарственного средства- метионин.
Глицин в медицинской практике является универсальным средством способствующим к увеличению мозгового кравообращения, защиты печени, применяется в виде бетаина при лечении хронического алкоголизма.
Валин входит в состав комплексонов применяемых для выведения радионуклеидов из организма.
Из других функций свободных аминокислот следует обратить внимание на:
Образование активных пептидов,пуринов и нуклеотидов, которые входят в состав нуклеиновых кислот.
Участие в синтезе витаминов и коферментов.
Например: из аспарагиновой кислоты синтезируется никотиновая кислота, а β-аланин входит в состав витамина В3.

Метионин входит в состав S-аденозилметионина выполняющего роль главного метилируещего агента в растениях.
Глутаминовая кислота участвует в синтезе хлорофилла, а фитогормон ауксил образуется из триптофана.
Аминокислоты являются исходными соединениями в синтезе безазотистых производных, таких как флаваноиды, кумарины. Основные здесь – фенилаланин, тиразин, способные к реакциям дезаминирования и декарбоксилирования.
Многие из аминогенных аминокислот являясь непротеиногенными, тем не менее, выполняют важные функции в растениях.
1. Некоторые из них участвуют в образовании протеиногенных аминокислот. Например, из гомосерина образуется треонин и метионин, а из диаминопимелиновой кислоты – лизин:

лизин
2. Непротеиногенные аминокислоты могут служить запасной формой азота и серы. Так, аминокислоты, в молекулах которых содержится два и более атома азота, могут накапливаться в семенах в виде его запасной формы, а при прорастании отдавать азот на образование необходимых проростку аминокислот. Например:

орнитин цитруллин диаминомасляная кислота
3. Некоторые непротеиногенные аминокислоты являются транспортной формой азота. Их представители:

-гидроксиглютаминовая -метилглютаминовая -метиленглютаминовая
кислота кислота кислота
Они не накапливаются в семенах, но встречаются в проводящих тканях растений.
4. Защитная функция. Орнитин и цитруллин участвуют в обезвреживании аммиака в орнитиновом цикле. В неблагоприятных (стрессовых) условиях накапливается фитогормон этилен. Источником его служит метионин, а промежуточным продуктом является непротеиногенная аминокислота – аминоциклопропилкарбоновая. Она служит транспортной формой этилена.

метионин
Первичный синтез полного набора протеиногенных аминокислот, необходимых для синтеза белков, осуществляется только в растениях. В организме человека не могут синтезироваться эсенциальные аминокислоты. Образование аминокислот при фотосинтезе
В процессе фотосинтеза образуется пять аминокислот: серин, аланин, цистеин, глицин, аспарагиновая кислота по схеме:
фосфосерин

серин цистеин
- переаминирование
аланин

аспарагиновая кислота

Глицин
*- переаминирование
Получающиеся аминокислоты, как при переаминировании, так и в результате фотосинтеза, дают другие аминокислоты.
Полный набор протеиногенных аминокислот человек получает с пищей, и для полноценного синтеза белка он должен получать их из растительной или животной пищи в том соотношении, которое соответствует аминокислотному составу белков. Белки клеток, тканей, органов нашего организма постоянно обновляются, поэтому организму необходим постоянный приток строительного материала.
Трофическая цепь продолжается таким образом: травоядные животные переваривают растительные белки до аминокислот и затем используют полученные аминокислоты для синтеза животных белков. Синтезированные животными белки существенно отличаются по аминокислотному составу. Поэтому некоторые аминокислоты, получаемые из растительного сырья, оказываются в избыточном количестве и используются на энергетические нужды (дыхание).
Биологическая ценность белков, как источника необходимого набора аминокислот, зависит от степени их перевариваемости и усвоения. Растительные белки усваиваются на 60-80%, животные – на 90%. Пониженная усвояемость растительных белков связана с тем, что оболочка растительной клетки, построенной из клетчатки и близких к ней полисахаридов, плохо разрушается пищеварительными ферментами. Чтобы получить единицу полноценного животного белка, необходимо 6-8 единиц растительного белка. И, кроме того, аминокислотный состав животных белков близок к аминокислотному составу белка человека.
В целом, биосинтез аминокислот и белков у растений и животных можно представить схемой:
СО2 + Н2О + нитраты
hν, хлорофил
растительный белок → аминокислоты → белок человека
аминокислоты
животный белок
↓
аминокислоты
↓
белки хищников
В 1973 году совместным решением Всемирной организации здравоохранения (ВОЗ) и Всемирной продовольственной организации (ЕАО) введен показатель биологической ценности пищевых белков – аминокислотный скор. Пищевая ценность любого белка сравнивается с эталонным белком – абстрактным белком, аминокислотный состав которого сбалансирован и идеально соответствует потребностям человеческого организма. При расчете аминокислотного скора содержание аминокислоты в конкретном белке выражают в процентах по отношению содержания ее в эталоне, т.е.

Скор аминокислоты может равняться 100 при точном соответствии ее содержания эталону, больше 100 – избыточное содержание и меньше 100 – недостаточное содержание.
Аминокислота, скор которой имеет самое низкое значение, называется первой лимитирующей аминокислотой. Эта аминокислота будет определять степень использования данного белка в организме человека. В пищевом рационе необходимо комбинировать белки так, чтобы они дополняли друг друга по аминокислотному составу. Лучше всего сочетать животный и растительный белок. На долю животного белка должно приходиться 55%, а на долю растительного – 45%.
Из других функций свободных аминокислот следует упомянуть такие:
1. образование активных пептидов, пуринов, нуклеотидов, которые входят в состав НК (глицин, аспарагиновая кислота, глютамин);
2. синтез витаминов и коферментов. Так, из аспарагиновой кислоты синтезируется никотиновая кислота. -аланин входит в состав пантотеновой кислоты, обнаружен в дрожжах;
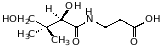
пантотеновая кислота, витамин В3
3. S-аденозилметионин – главный лимитирующий агент растений, образуется из метионина;
4. фитогормон ауксин образуется из триптофана, глутаминовая кислота участвует в синтезе хлорофилла;
5. из аминокислот образуются и безазотистые соединения – кумарины, флавоноиды (декарбоксилирование и дезаминирование фенилаланина и тирозина).
Белки
Наиважнейшей функцией аминокислот является биосинтез белка. Белки – это протеины, что в переводе с греческого означает важнейшие, первые. Белки играют наиважнейшую роль в процессах жизнедеятельности, являясь геномом, управляющим всеми метаболическими процессами в клетке. Белки – это полипептиды, которые не только способны при участии особых ферментов образовывать нативную первичную цепь в строгой последовательности аминокислот, но и стабилизировать свою пространственную структуру, т. е. существовать в определенной конформации. Отнесение к белкам или полипептидам условно. Как правило, белками называют полипептиды, содержащие не менее 50 аминокислотных остатков. Размер полипептидной цепи определяется матрицей, на которой осуществляется его синтез. Матрицей является ферментный комплекс, который катализирует биосинтез белка. Безграничное разнообразие белков в природе, наделенных разными функциями, определяется бесчисленными комбинациями расположения аминокислот в полипептидной цепи. В природе существует примерно 1010-1012 различных видов белков, которые составляют основу всех живых организмов, начиная от вирусов и заканчивая человеком.
В организме человека около 50 тысяч белковых молекул. В клетке кишечной палочки 3 тысячи структурных видов и не один из них не встречается в организме человека.
Каждый вид живых организмов характеризуется индивидуальным набором белков, определяемым наследственной информацией, закодированной в ДНК.
Таким образом, белки составляют основу всего живого на земле, начиная с вирусов и заканчивая человеком.
Белки являются обязательной составной частью любого организма. Главными их функциями являются:
а) структурная. Белки участвуют в построении всех структурных фрагментов: кератин – волос, ногтей; коллаген – соединительных тканей; эластин – связок, муцины слизистых выделений;
б) родственный класс составляют двигательные белки. Из них наиболее известны белки сократительного аппарата мышц – актин и миозин; белок, входящий в микротрубочки ресничек. Сюда же можно отнести белки бактерий;
в) транспортные белки, т.е. белки участвующие в переносе различных веществ. К ним относятся гемоглобин и миоглобин (перенос кислорода от легких к тканям и наоборот), сывороточный альбумин (транспорт жирных кислот крови и некоторого вида простагландинов), -липопротеин (транспорт липидов) и многие другие;
г) защитные белки объединяют все вещества белковой структуры, которые помогают организму бороться с возбудителями заболеваний (иммуноглобулины, антигены, антивирусные агенты, белки, способствующие свертываемости крови);
д) рецепторные белки, те белки, которые способны воспринимать информацию и передавать ее, например, родопсин зрительного аппарата, нейропептиды мозга, рецепторы клеточной поверхности эритроцитов, лимфоцитов и других клеток;
е) ферменты, выполняющие роль катализаторов биохимических реакций. Только одной этой их функции достаточно, чтобы считать белки важнейшими биорегуляторами. Ферменты участвуют в тысячах превращений, происходящих в живой клетке и составляющих основу ее метаболизма;
ж) гормоны, белки, которые регулируют синтез или метаболизм каких-либо веществ, например, инсулин, секретируемый поджелудочной железой;
з) нейропептиды мозга – пептиды памяти, сна и т.д.
и) антибиотики
токсины – ботулинический, столбнячный, дифтерийный, рицин, присутствующий в клещевине, зоотоксины змей, пауков, ракообразных, токсины пчел, шершней, морских организмов, грибов и т.д.
к) резервная. В семенах растений в большом количестве откладываются защитные белки, которые составляют существенную часть пищевого рациона человека и кормового рациона животных.
Для осуществления всех процессов, связанных с жизнедеятельностью организма, требуется большой набор индивидуальных белков с разными функциями. Количество индивидуальных белков в организме человека ориентировочно равно 50-100 тысяч.
Одной из особенностей белков является их способность к агрегации и способность к образованию сложных надмолекулярных структур, которые могут распадаться в ходе биохимических превращений и снова восстанавливать свою структуру. Самосборка подобных структур обеспечивает специфичность многих биологических процессов, таких, например, как типы «узнавания молекулярных структур»:
- антиген – антитело;
- протеаза – субстрат (белок);
- фермент – ингибитор фермента.
В курсе пищевой химии рассматриваются вопросы, связанные с ролью белков в питании человека, и те изменения, которые происходят при хранении и переработке этого сырья
Питательные функции белка
Белки – важнейшая составная часть пищи человека. Человеку необходимо в среднем 70 - 100г белка в сутки, в то время как согласно данным международной организации ВОЗ в настоящее время на каждого жителя планеты приходится около 60г белка в сутки. Из них 80% приходится на менее ценные растительные белки и лишь 20% - на животные. Животные белки, как наиболее сбалансированные по аминокислотному составу, полностью удовлетворяют организм человека в необходимом наборе аминокислот. Многие растительные белки содержат недостаточное количество некоторых незаменимых аминокислот, в основном, лизина, триптофана, метионина, в результате чего их питательная ценность снижается.
Таблица. Пищевая ценность белков разного происхождения
№ п/п |
Источник белка |
Лимитирующие аминокислоты и их скор |
|
первая |
вторая |
||
1 |
пшеница |
лиз (58) |
тре (87) |
2 |
рожь |
лиз (58) |
тре (76) |
3 |
рис |
лиз (70) |
тре (87) |
4 |
кукуруза |
лиз (44) |
тре (60) |
5 |
горох |
мет + цис (64) |
нет |
6 |
соя |
мет + цис (83) |
нет |
7 |
картофель |
мет + цис (70) |
нет |
8 |
молоко |
мет + цис (94) |
нет |
9 |
говядина |
нет |
нет |
10 |
птица |
нет |
нет |
11 |
рыба |
нет |
нет |
Если внимательно проанализировать данную таблицу, то видно, что практически во всех растительных источниках белках имеются аминокислоты, скор которых меньше 1, а в пшенице, ржи, рисе, кукурузе есть и вторая лимитирующая кислота (лизин – первая, треонин – вторая). Из этой же таблицы следует, что для мяса, рыбы – нет лимитирующих кислот. А вот следующая таблица показывает, как аминокислотный состав молока и пшеницы дополняют друг друга. Таким образом, можно составить рацион из неживотных белков, сбалансированный по аминокислотному составу.
Аминокислота |
Эталон, мг/г |
Пшеница |
Казеин молока |
|||
мг/г |
скор |
мг/г |
скор |
|||
лизин |
55 |
31 |
56 |
82 |
146 |
|
треонин |
40 |
31 |
77 |
45 |
112 |
|
триптофан |
10 |
9 |
90 |
12 |
120 |
|
метионин+цистеин |
35 |
43 |
123 |
31 |
89 |
|
фенилаланин |
60 |
81 |
135 |
55 |
92 |
|
валин |
50 |
47 |
94 |
72 |
144 |
|
лейцин |
70 |
72 |
103 |
|
|
|
изолейцин |
40 |
35 |
88 |
|
|
|
При сравнении становится очевидным, что недостаток лизина в пшенице (первая лимитирующая кислота) и треонина (вторая лимитирующая кислота) дополняется избытком их в молоке и, наоборот, недостаток метионина и цистеина в молоке компенсируется избытком их в пшенице. Можно составить и растительную диету, сбалансированную по аминокислотному составу. Например, смесь кукурузы с фасолью.
Значение сбалансированности аминокислотного состава белков можно упрощенно представить в виде «бочки Либиха»:

Вся ее емкость – это идеально сбалансированный по аминокислотному составу белок. Реальная его усвояемость определяется размерами самой низкой бочарной доски (первая лимитирующая аминокислота). То количество белка (60г), которое приходится на одного жителя планеты, распределяется неравномерно, и многие испытывают дефицит белка. Это значит, что данную проблему нужно как-то решать.
Проще решается проблема с растительным белком. Современные технологии позволяют выращивать достаточное количество зерна высокого качества. Например, при колоссальном приросте населения, Индия и Китай смогли обеспечить себя достаточным количеством белка.
Гораздо труднее обстоит дело с животным белком. В ходе трофической (пищевой) цепи происходят существенные потери растительного белка, как мы уже упоминали, избыток его кратен восьми, и чем больше (длиннее) трофическая цепь, тем эти потери больше. Причем на синтез белка используется то количество, которое определяется первой лимитирующей аминокислотой, остальное идет на энергетические нужды – дыхание. Следует учитывать и тот факт, что обмен азота у животных иной, чем у растений. Значительное количество белкового азота животных выводится из организма в виде мочевины.
Итак, для решения проблемы дефицита белка необходимо:
1. Увеличить посевы зерновых культур: современное интенсивное земледелие позволяет выращивать сырье в достаточных количествах и хорошего качества;
2. Развивать не пастбищное животноводство;
3. Создавать искусственные виды белковой пищи.
Характеристика белков сырья и пищевых продуктов
Белки, входящие в состав биологических объектов, можно разделить на простые и сложные.
Простые белки (протеины). Эти макромолекулы состоят только из аминокислотных остатков. Среди них можно выделить альбумины – водорастворимые глобулярные белки. Они содержатся и в животных и в растительных тканях, входят в состав сыворотки крови, цитоплазмы клеток животных и растений, молока. Наиболее известны альбумин куриного яйца, альбумин сыворотки крови, мышечной ткани, молочный альбумин. Альбумин сыворотки крови состоит из 575 аминокислотных остатков с повышенным содержанием аспарагиновой и глутаминовой кислоты. Полипептидная цепь образует девять петель, фиксированных за счет дисульфидных связей метионина. На долю сывороточного альбумина приходится 50% от массы всех содержащихся в сыворотке крови белков. Основная его функция – транспорт в организме низкомолекулярных веществ, например, жирных кислот, липидов, билирубина, ионов некоторых металлов, аминокислот. Альбумины нейтральны, трудно осаждаются растворами солей. Из-за наличия меркаптогруппы подвержены легкой свертываемости. В отличие от животных, растительные альбумины отличаются повышенным содержанием метионина и триптофана.
Альбумин, выделенный из яичного белка и молока, используется в кондитерской промышленности.
Глобулины – это фибриллярные белки, гетерогенные по своей природе, т.е. состоящие из агрегатов, включающих разные по природе белки. Полипептидные связи глобулинов соединены друг с другом водородными связями. Они имею более высокий, по сравнению с альбуминами, молекулярный вес, нерастворимы в воде, но растворяются в слабых растворах солей. Примерами глобулинов могут служить фибриноген, глобулины сыворотки крови, белка куриного яйца, сои. Они отличаются повышенным содержанием аргинина, аспарагина, глютамина.
Гистоны – ядерные белки, играющие важную роль в регуляции генной активности. Гистоны – белки основного характера, имеющие несвязанные аминогруппы. Они содержатся в лейкоцитах и красных кровяных тельцах.
Протамины – положительно заряженные ядерные белки. Примерно на 80% состоят из щелочных аминокислот, что дает им возможность взаимодействовать с нуклеиновыми кислотами посредством ионных связей. Протамины не содержат серы.
Проламины. Содержатся в зернах различных хлебных злаков. Они все растворимы в 80%-ном спирте, нерастворимы в воде. Характерным представителем этих белков может служить глиадин, составляющий главную часть клейковины.
Склеропротеины – нерастворимые белки, из которых состоят наружные покровы и соединительные ткани. К ним относятся кератин, коллаген, эластин, фиброин. Каждому представителю отведено собственное место в организме.
Кератин в большом количестве содержится в скорлупе куриного яйца, он богат серой.
Коллагены в основном содержатся в соединительных тканях.
Эластин содержится в сухожилиях.
Сложные белки (протеиды). В биообъектах связаны с липидами, металлами, фосфорной кислотой. В их состав входят:
- липопротеиды, помимо полипептида в их состав входят разные липиды, как нейтральные, так и фосфолипиды и холестерин. Полипептидная цепь связана с липидами водородной связью. Они концентрируются в плазме крови и молоке. С фосфорной кислотой связь ионная. С нейтральными липидами ван-дер-вальсовое взаимодействие.
- фосфопротеиды, в состав которых входит фосфорная кислота и они имеют кислотный характер. Главным представителем фосфопротеидов является казеин молока. Он обладает настолько выраженным кислотным характером, что выделяет СО2 из карбонатов и бикарбонатов. В молоке казеин содержится в виде кальциевой соли дополнительно связан с углеводами. В состав куриного желтка входит вителлин;
- нуклеопротеиды. Помимо белка они содержат нуклеиновые кислоты, при слабом гидролизе расщепляются на протеины и нуклеиновые кислоты. Это нужно, чтобы обеспечить легкую конформационную сборку белковой молекулы с участием нуклеиновой кислоты;
- хромопротеиды – это сложные белки, состоящие из протеинов и окрашенных веществ. Например, гемопротеин – гемоглобин - переносчик кислорода, СО2, осуществляет регуляцию pH крови;
- гликопротеиды – сочетание белков с олиго- и полисахаридами. Они образуются в слюнных железах, печени, желудке, кишечнике. Связь белка и углеводов ковалентная, О- или N-гликозидная связь небольших остатков углеводов и белков.
Белки злаков
Основная масса белков зерновых культур (до 80%) приходится на запасные белки. Они находятся там в различном виде, но основными являются две фракции – глиадин и глютенин, представленные примерно в одинаковых количествах. При набухании они формируют клейковину – гидратированный белковый комплекс.
Запасными белками принято называть белки, подвергающиеся гидролизу под действием воды и при участии протеолитических ферментов при прорастании семян до аминокислот, которые затем используются для синтеза новых белков развивающегося проростка. Это своеобразная форма депонирования аминокислот, которые понадобятся для формирования нового растения.
Глиадин (или проламин пшеницы) – это гетерогенная система, состоящая из большого числа индивидуальных белков с молекулярной массой от 30 до 70 тысяч. Основная часть приходится на глутаминовую кислоту (глу) и глутамин (глн), до 43% в сумме. Достаточно высока доля пролина – 15%. Индивидуальные белки глиадинового комплекса отличаются по молекулярной массе, аминокислотному составу, и, поэтому, по-разному ведут себя при разделении их методом электрофореза. Но все белки глиадинового комплекса, в зависимости от подвижности при электрофорезе, разделяются на четыре группы – фракции , , , . Каждый сорт зерна характеризуется индивидуальными особенностями белкового спектра, присущего только этому сорту. Сортность зерна можно соотнести с электрофоретическим спектром глиадина. Формируя глиадиновый комплекс путем генетической селекции можно создать новый сорт зерна.
Глютенин – это полимерное образование, состоящее из компонентов с низкой молекулярной массой, связанных между собой непрочными связями, распадающимися при обработке восстановителями на белки, идентичные по составу глиадину, глобулинам и альбуминам. Поэтому считают, что при образовании глютенина принимают участие низкомолекулярные белки разного типа, полипептидные цепочки которых скрепляются межмолекулярными дисульфидными связями по типу:

Различия между сортами пшеницы связаны с различным соотношением белков в зерне различных групп. Слабая клейковина характеризуется высоким соотношением глиадин: глютенин. Низкомолекулярные белки ослабляют силу теста, повышают его растяжимость. Высокомолекулярные белки удлиняют время замеси.
Помимо белков в клейковинном комплексе пшеницы (в запасных белках) обнаружены различные ферменты – протеаза, липоксигеназа, -амилаза. В образовавшихся сложных надмолекулярных структурах одновременно с резервными запасаются и биологически активные белки (ферменты и ингибиторы). Белки, ферменты и ингибиторы образуют сложный ассоциированный комплекс, поэтому в покоящемся семени не ферменты, не ингибиторы не проявляют своей активности. При попадании семян во влажные условия и при прорастании происходит распад комплекса, освобождение связанных ферментов сопровождается гидролизом белков до аминокислот, катализирующих образование новых белковых молекул из запасных кислот.
В созревающих семенах, наоборот, по механизму белок – белковое взаимодействие формируются надмолекулярные структуры, и зерно переходит в состояние покоя с затуханием процессов.
В технологическом потоке можно по-разному повлиять на свойства клейковины. Можно разрушить агрегацию и вызвать ослабление клейковины за счет высвобождения нейтральных протеаз. Высвобождение липоксигеназы, напротив, способствует укреплению клейковины. Необходимо учитывать и воздействие глутатиона дрожжей. Задача технолога – найти эффективные способы мягкого направленного действия на сложные биологические системы муки и зерна, с помощью которых можно ослабить чрезмерно крепкую клейковину и укрепить слабую.
Белки бобовых культур
В бобовых культурах, как и в зерновых, основная часть (до 80%) всего белкового комплекса приходится на запасные белки. А содержание белка в сое достигает 40%. Аминокислотный состав белков си сбалансирован. Белковый комплекс представлен в основном альбуминами и глобулинами, лимитирующими аминокислотами являются метионин и цистеин. Отличительной особенностью белков бобовых культур является содержание в них лектинов. Лектинами называются углеводсвязывающие белки. Они способны избирательно связываться с углеводными цепями гликоконьюгатов поверхности эритроцитов, вызывая их агглютинацию (выпадение в осадок). Причем, они способны связываться специфично. Определенный лектин проявляет сродство к определенному виду сахара или к близким по структуре сахарам. А так как коньюгаты отличаются для различных групп крови, то лектины можно использовать для ее определения. Оседание эритроцитов можно, соответственно, предотвратить добавлением определенного вида углевода, проявляющего большее сродство к данному виду лектина, чем эритроциты.
Медико-фармакологические исследования показали, что некоторые виды лектинов способны распознавать раковые клетки, и могут применяться для их диагностики.
Однако высокое содержание лектинов оказывает токсическое действие. Поэтому высокую активность белков бобовых культур необходимо уменьшать. Достигается это нагреванием до 80С.
Самой ценной культурой бобовых является соя. В ней содержится 40% белка и 20% жира. Однако питательная ценность белков сои, не прошедшей термическую обработку очень низкая. Это связано с высоким содержанием в бобах сои ингибиторов протеаз различного вида – пищеварительных и других. Поэтому сырые, необработанные полуфабрикаты из сои использовать нельзя, чтобы не вызвать токсические реакции в организме. В технологических процессах производства белковых продуктов из сои предусматривается обработка паром, микроволновым нагревом, вымачиванием, кипячением. Инактивация на 80-90% по сравнению с их активностью в исходном сырье уже позволяет отнести эти белковые продукты к пищевым, не обладающими отрицательным воздействием на организм.
Белки масличных культур
В семенах масличных культур белки составляют существенную долю сухой массы. Среднее их содержание в семенах отдельных масличных культур изменяется от 16 до 28%, большая часть их относится к глобулиновой фракции (80-97%), альбуминов и глютеинов по 0,5-1%. Проламинов практически нет. С увеличением масличности повышается содержание глутаминовой кислоты, метионина, аспарагиновой кислоты и лизина. Наиболее сбалансированы по аминокислотному составу подсолнечное и хлопковое масла.
Белки картофеля
Картофель, по сравнению с другими культурами, является низкобелковым продуктом (2%). Однако, если сравнивать урожайность картофеля и пшеницы (16% белка), то соотношение это 150-200ц картофеля и 20-25ц пшеницы с гектара. Учитывая, что потребляемое количество картофеля в среднем 330г в сутки, он удовлетворяет 6-8% потребности белка. Кроме того, белок картофеля (туберлин) является полноценным по составу. В нем содержатся все аминокислоты, в том числе незаменимые. Он приближается по составу к белкам сои. Если за 100% принять биологическую ценность куриного яйца, то для белка картофеля биологическая ценность составляет 85%, удовлетворяет 6-8% потребности в белке. Лимитирующими являются метионин и цистеин (скор = 70%). Белок картофеля представлен глобулинами и альбуминами в соотношении 7:3.
Белки мяса и молока
Мясные продукты – один из основных источников полноценного белка, содержание его составляет 11-21%. Белки мышечной ткани хорошо сбалансированы по аминокислотному составу, они разнообразны по биологическим функциям.
Два важных структурных фрагмента мышечной ткани – это миозин и актин, на миозин приходится 40% от всех белков мышечной ткани, на актин – 10-15%. Миозин – это фибриллярный белок, состоящий из навитых друг на друга -спиралей полипептидов, связанных поперечными водородными связями. Его молекулярная масса 450 тысяч. Актин состоит из двух фракций. Первая из них – глобулярный G-актин, а второй – фибриллярный F-актин, который фактически является надмолекулярной структурой: две нити G-актина, скрученные между собой.
Миоглобин – водорастворимый белок (лимфа крови). В полипептидную цепь миоглобина входит 153 аминокислоты, содержащие одну гемогруппу. Вторичная структура миоглобина - это фактически на 80% правая -спираль. Показано, что третичная структура миоглобина содержит восемь прямолинейных -спиральных участков, в изгибах находятся пролин, серин, треонин и аспарагин - эти аминокислоты не допускают образования спирали, если находятся рядом друг с другом за счет взаимодействия функциональных групп. Содержание миоглобина ~ 1% в мышечной ткани. Его функция состоит в передаче кислорода, доставляемого гемоглобином ферментным системам клетки к мышечным тканям. Он обладает большим сродством к кислороду, чем гемоглобин. Миоглобин образует комплекс с NO (роль фиксатора), который не разрушается после тепловой обработки и позволяет сохранять красный вид мяса, что улучшает товарный вид мясопродуктов.
Коллаген - белок соединительных тканей. Прочность волокон коллагена можно сравнить с прочностью стальной проволоки. Основой коллагена является глицин (35%), аламина содержится 11%. Отличительной особенностью его является высокое содержание пролина и оксипролина.
Качество мяса зависит от количества в нем соединительной ткани. Чем соединительной ткани больше, тем пищевая ценность мяса ниже. Содержание оксипролина часто используют как показатель содержания соединительной ткани, а отношение триптофан/оксипролин - как показатель качества мяса: чем он выше, тем качество лучше. Для повышения выхода пригодного для производства полуфабрикатов мяса, части с высоким содержанием соединительных тканей подвергают действию ферментов, содержащих протеазы, это позволяет повысить ценность полуфабрикатов с 15-17% до 40-43%.
Эластин - это второй важный белок соединительных тканей. В нем также много глицина и аланина, но меньше пролина, а вот содержание лизина в нем повышенное. Эластин более упруг.
При гидролизе коллагена при и эластина при длительном нагревании некоторые ковалентные связи разрушаются, и образуется желатин.
Белки молока
В состав коровьего молока входит около 20 белковых компонентов. Основные из них - -лактоглобулин, казеин и -лактоглобулин, причем при общем содержании белковых веществ в молоке 2,8-3,8%, на долю казеина приходится до 2,7%. Он выполняет очень важную роль связующего для ионов кальция. Кроме того, казеин коровьего молока богат лизином, метионином и триптофаном, а значит может служить полноценным их источником.
Проблема обогащения белков лимитирующими аминокислотами
Достаточно привлекательным на первый взгляд является подход, основанный на обогащении растительного сырья лимитирующими аминокислотами. В настоящее время технически разрешима задача производства любых аминокислот в необходимых количествах. Для этого используют различный набор методов - химический синтез, биотехнологию, микробиологические (ферментативные) методы. В наибольших количествах производится глутамат натрия, используемый как вкусовая приправа для первых блюд. Его мировое производство достигает 500 тысяч тонн в год. В значительных количествах производится лизин - самая дефицитная аминокислота в растительных белках.
Однако дополнительное введение свободных аминокислот в рацион не всегда может оказаться полезным, если не учитывать следующих факторов:
1. Аминокислоты, поступающие с пищей должны поступать в кровь максимально одновременно.
2. Свободные аминокислоты, использованные для обогащения пищи, минуя пищеварительный процесс, сразу поступают в кровь.
3. Переваривание же белков проходит в несколько этапов и занимает от 4 до 8 часов. Первые этапы полостного пищеварения в желудке и кишечнике проходят с расщеплением белков до низкомолекулярных пептидов. В клетках тонкого кишечника полипептиды расщепляются пептидазами до аминокислот (мембранное пищеварение). Образовавшиеся аминокислоты поступают в лимфу и кровь и используются в синтезе полипептидов и белков.
Разрыв во времени поступления в кровяное русло свободных аминокислот и аминокислот, образовавшихся при переваривании белков пищи, приводит к тому, что они подвергаются ферментативным реакциям разного типа. Среди продуктов биодеградации дополнительных аминокислот могут быть и токсические вещества за счет быстрого дезаминирования и поступления в организм большого количества высокотоксичных аммонийных солей. Наиболее высокой токсичностью обладают продукты дезаминирования метионина, тирозина и гистидина.
Новые формы белковой пищи
К новым формам белковой пищи относят продукты питания, получаемые на основе грубых белковых фракций продовольственного сырья. Основными сырьевыми источниками являются: зернобобовые - соя, горох, чечевица,люпин, фасоль, нут; хлебные и крупяные культуры - пшеница, тритикале, рожь, овёс, ячмень, кукуруза и побочные продукты их переработки - отруби, сечка, мучка, зародыш; масличные - подсолнечник, лён, рапс, кунжут; овощи - картофель, тыква; вегетативная масса растений - люцерна, клевер, люпин, сахарная свекла, косточки от фруктов и ягод.
Наиболее перспективным источником белка являются зернобобовые и, прежде всего, соя и соевые бобы. Соевые белки, применяемые в пищевом производстве, подразделяются на три основные группы, отличающиеся друг от друга по содержанию белка (от 40 до 90%). К этим группам относятся: соевая мука, белковые концентраты, соевые белковые изоляты.
Соевая мука - это обезжиренная мука и крупа зернобобовых. Она изготавливается путем размалывания и просева соевых лепестков (дольки). В них обычно содержится от 40 до 54% белка, и она является наименее очищенной формой соевых белковых продуктов, потребляемых человеком.
Функциональные свойства соевой муки - растворение белка, загустевание, связывание воды, адгезивные свойства, стабилизация жировых эмульсий, связывание свободного жира, отбеливание продуктов питания.
Области применения соевой муки - мясные изделия, макаронные изделия, кондитерские изделия, хлебопечении.
Соевые белковые концентраты. Они изготавливаются из лущеных и обезжиренных соевых бобов путем удаления большей части растворимых в воде небелковых составляющих. Содержание белка в концентратах 65-75%.
Существует три типа концентратов: традиционный, комбинированный и высокофункциональный.
Традиционные концентраты получают кислотной или водно-спиртовой экстракцией нежелательных компонентов из обезжиренной соевой муки или шрота.
Комбинированные концентраты - это смесь соевого концентрата, вырабатываемого по традиционной технологии, с полисахаридами - загустителями (гуаровая мука). Введение загустителя в состав концентрата позволяет увеличить его водоудерживающую способность, не изменяя другие функциональные свойства.
Высокофункциональные концентраты получают в результате дополнительной гидротермической обработки традиционных соевых концентратов. Гидротермическая обработка приводит к модификации белка, повышает его растворимость и водоудерживающие свойства. Помимо мясных, макаронных и хлебобулочных изделий соевые концентраты используются при изготовлении сыров и творога.
Соевые белковые изоляты. Изоляты - это наиболее очищенная и наиболее функциональная форма выпускаемого соевого белка. Они производятся из лущенных и обезжиренных бобов путем удаления большинства небелковых элементов. При полной дегидратации изоляты содержат не менее 90% белка.
Применяются во всех видах мясных продуктов, при производстве напитков, молочной и хлебобулочной продукции.
В ближайшем будущем возможна частичная замена некоторых видов зернобобовых на более доступные, дешевые культуры. Такими полноценными источниками белка могут быть люпин и люцерна. Зерно люпина содержит 35% и более белка, а в зеленой массе его свыше 15%, кроме того, для этой культуры нет ограничения по возделыванию по почвенным и климатическим условиям.
Зернопродукты. Широко используются в качестве добавок побочные продукты мукомольного производства - пшеничные отруби, зародыши пшеницы, пшеничная мука (16-18 % белка), овсяная мука грубого и тонкого помола (16-17 % белка), мамалыга (жмых кукурузы, смешанный с отрубями и крахмалом).
Отходы масличного производства. Побочным продуктом производства масла является мука из семян подсолнечника. Имеется три вида муки - с шелухой, частично и полностью очищенная от шелухи. Чем больше в муке шелухи, тем меньше в ней содержание белка, в среднем от 28-47% до 50-55%. Применяют также рапсовое семя (33-35% белка), мука из льняного семени (34-38%), арахисовая мука (~50 % белка).
В зависимости от назначения белковые продукты получают в различных видах.
Текстурированные белковые продукты - заменители мяса или казеина получают, подвергая пищевые волокна в процессе варки ориентации под напряжением сдвига. Сформированные волокна разрезают и сушат.
Модифицированные белки получают ферментативным методом, при этом разрушается надмолекулярная структура и изменяется длина полипептидной цепи. Их чаще всего используются как вкусовые добавки к пище.
Клейковина. После экстракции с водой небелковых компонентов, остаток сушат в определенном режиме и используют в качестве продукта с содержанием белка 75-80%. Соответственно, существует масса модификаций этих белковых продуктов различного назначения и с различными пищевыми добавками.
При получении искусственного белка необходимо учитывать следующие основные моменты:
1. Извлечение его из сырья с максимальным выходом при минимальных затратах и минимальных потерях других ценных компонентов;
2. Минимальные изменения функциональных свойств белка или направленное изменение в желаемую сторону;
3. Сохранение биологической пищевой ценности белка;
4. Очистка от нежелательных примесей.
Другие, кроме питательных, функциональные свойства белков
Прежде всего, сюда относятся жиросвязывающие, эмульгирующие, гелеобразующие свойства.
Для успешной реализации этих функциональных свойств белков важное значение имеет растворимость. Она имеет значение и при переработке и в пищеварении. Особые требования к растворимости предъявляются к белкам при использовании их в приготовлении напитков (в данном случае высокая растворимость - это хорошо) и макаронных изделий (в данном случае высокая растворимость - это плохо).
При использовании белков в качестве обогатителей, наполнителей, функциональных ингредиентов и аналогов мясных и рыбных изделий большое значение имеют такие свойства белковых суспензий, как ограниченная степень набухания и размер частиц, водо- и жиросвязывающая способность, адгезионные свойства, образование устойчивых гелей.
Способность белков удерживать жир и воду связана в основном с особенностями их аминокислотного остатка. Высокая способность белков удерживать воду и жиры положительно сказывается на текстуре готовых пищевых продуктов.
Большое значение имеют жироэмульгирующая и пенообразующая способность некоторых белков. Для этого необходимо присутствие в одной белковой цепи и гидрофильных и гидрофобных групп. За счет этого создаются прочные эмульсии, где белки являются связующими в системе «жир - вода – газ». Растительные и животные белки, обладающие жироэмульгирующими свойствами, используются при изготовлении низкокалорийных маргаринов, майонезов, паст, десертов, кремов. Гелеобразующим свойством обладает желатин, образующийся при варке субпродуктов с большим содержанием соединительных тканей. Ферменты и ингибиторы белковой природы
В биологических объектах с ненарушенной клеточной структурой протекают строго скоординированные обменные процессы, направленные на поддержание постоянства внутренней среды организма - гомеостаза, являющегося необходимым условием сохранения жизнеспособности.
Переработка пищевого сырья связана с разрушением клеточной структуры. Это приводит к коренному изменению характера и направленности биохимических процессов. Нарушается их координация, разрушаются сложные многокомпонентные комплексы, перестают функционировать жизненно важные системы.
В системах с разрушенной клеточной структурой интенсивно протекают окислительные и гидролитические процессы. И очевидно, что как ферменты, катализирующие эти реакции, так и их ингибиторы, будут играть существенную роль в процессе хранения и технологической переработки сырья. Механизм действия белковых ингибиторов связан со специфическим взаимодействием их с ферментом и с образованием устойчивого неактивного комплекса «фермент-ингибитор». Обычно белки ингибиторы имеют невысокую молекулярную массу и значительное количество дисульфидных связей, придающих повышенную стабильность их структурной организации. Среди них встречаются белки, выдерживающие нагревание без потери активности до 100С.
К ферментам, играющим наиболее важную роль при разрушении живой клетки, а также к их ингибиторам, можно отнести следующие:
1. окислительно-восстановительные ферменты – это, прежде всего, ферменты типа оксигеназ, катализирующие окисление органических веществ кислородом воздуха. Реакция окисления тирозина с образованием темно-окрашенных соединений, называемых меланинами. К таким процессам, например, относится потемнение среза клубня картофеля или яблока, цвет ржаного хлеба. Действующим в данном случае является фермент тирозиназа. Поскольку она вызывает нежелательное потемнение плодов и овощей при сушке и консервировании, то сырье предварительно бланшируют - обрабатывают кипящей водой или паром, это обеспечивает инактивацию окислительных ферментов;
2. фермент липоксигеназа катализирует окисление полиненасыщенных высокомолекулярных жирных кислот (линолевой и линоленовой) кислородом воздуха. Образующиеся продукты окисления способны оказывать дальнейшее влияние - сопряженное окисление ряда других компонентов (например, в муке - пигментов, сульфгидрильных групп клейковины), вызывая осветление. Однако лучше активировать липоксигеназный комплекс самого сырья (например, того же зерна), но дополнительное введение липоксигеназы требует особой осторожности, потому что переокисленные формы жиров - токсичны, кроме того, придают продукту прогорклый вкус и неприятный запах;
3. липазы препятствуют образованию свободных жирных кислот, способствуя протеканию процесса их этерификации и переэтерификации, влияя, таким образом, на жирно-кислотный состав. Липазы могут использоваться для получения жиров совершенно иного типа, например, масла какао из доступного сырья;
4. гидролазы способствуют гидролизу полисахаридов, некоторые из них способны осуществлять трансферазные реакции - переносить гликозидные остатки на олигосахариды и полисахариды, наращивая полисахаридные цепочки. Характерным примером является амилазный комплекс крахмала. Амилазный комплекс состоит из двух типов амилаз: -амилаза созревания и -амилаза прорастания. В созревающем зерне или других крахмалсодержащих в период созревания синтезируется -амилаза созревания. Первый этап гидролиза крахмала именно ей и осуществляется. Затем синтезируется новый фермент - -амилаза прорастания, синтез осуществляется только при влажности зерна выше 28%. Амилазы находятся в сырье в связанном состоянии, прежде чем они начнут действовать, их нужно высвободить, это достигается с помощью протеолитических ферментов.
Скорость расщепления углеводов регулируется системой белковых ингибиторов амилаз. Такие ингибиторы белковой природы избирательно взаимодействуют с амилазами и образуют неактивные комплексы «амилаза-ингибитор»;
5. протеолитические ферменты способствуют расщеплению запасных белков до аминокислот при прорастании семян. Протеолитические ферменты тесно связаны с белками клейковинного комплекса и находятся в комплексе с ингибиторами протеолитических ферментов. Уравновешенность системы «протеиназа - ингибитор протеиназы» определяет стабильность клейковинного комплекса и слабую выраженность автолитических процессов в тесте.
Превращение белков в технологическом потоке
Нативная трехмерная структура белков поддерживается разнообразием внутри- и межмолекулярных сил и поперечных связей. Любое изменение условий, происходящее в технологическом потоке оказывает влияние на нековалентные связи надмолекулярной структуры и приводит к разрушению четвертичной, третичной и вторичной структуры, что сопровождается потерей биологической активности. Этот процесс называется денатурацией белка, она проходит без затрагивания первичной структуры белка, т.е. не происходит деструкции основной полипептидной цепи. Однако денатурация сопровождается разрушением дисульфидных связей, гидрофобных и электростатических взаимодействий.
Денатурирующие агенты делятся на химические и физические. К последним относится, прежде всего, температурное воздействие. Большая часть белка денатурируется уже при 60-80С, однако встречаются некоторые более устойчивые белки, например, -лактоглобулин молока. К физическим воздействиям относятся: замораживание, давление, ультразвуковое воздействие, облучение и т.д. На денатурацию белка оказывают влияние многие факторы, а именно: кислотность среды, присутствие органических соединений, металлов, восстанавливающих сахаров.
Химическая денатурация - это действие органических растворителей и реагентов, она применяется в лабораторной практике.
Тепловая денатурация белка - это один из основных физико-химических процессов, лежащих в основе тепловой переработки пищи: выпечки хлеба, варки, жарения овощей, рыбы, мяса, консервирования, стерилизации. Данный вид превращений относится к полезным, так как ускоряет переваривание белка в желудочно-кишечном тракте человека, облегчая доступ к ним протеолитических ферментов. Кроме того, процесс денатурации улучшает потребительские свойства пищевых продуктов (текстуру, внешний вид, органолептические свойства). Однако степень денатурации белка существенно увеличивается при повышении температуры переработки: жарке, копчении, стерилизации при высоких температурах. А это уже процесс разрушения полипептидной цепи и образования иных продуктов: H2S, СНзS-СН3,

или


Мало того, что эти соединения хуже выводятся из организма, многие из них являются термическими мутагенами, вызывающими наследственные изменения в ДНК. Если нагревать белок выше 200C (например, при консервировании молока) могут проходить даже необратимые изменения с переориентацией оптически активного центра. Особенно нежелательна температурная обработка белка в щелочных условиях, потому что происходит поперечная сшивка белка и резко понижается его биологическая ценность. Например, если экстракция белка из сои проводить не при pH = 8,5, а при pH = 12,5, то количество лизина в нем уменьшается на 40%, треонина - на 26%, а валина - на 24%.
Даже такие факторы, как неправильное хранение зерна или бобов, обработка их ультрафиолетовым облучением или ультразвуком нарушает связь белка с липидами, последние окисляются и, в свою очередь, стимулируют поперечное сшитие белка, а значит и уменьшение его пищевой ценности.
Возможные нарушения в структуре белка вплоть до разрыва пептидных связей могут наблюдаться и при механических воздействиях - замес, гомогенизация, механическая обработка. В связи со всем вышесказанным, технолог должен очень грамотно подходить ко всем изменениям в технологическом процессе, чтобы сохранить не только вкусовые качества, но и пищевую ценность перерабатываемого белка.
Выделение и очистка белков
Изучение белков любого биологического объекта начинается с их выделения и хотя бы частичной очистки.
Основные этапы выделения и очистки белков следующие:
1. разрушение клеточной структуры материала. Разрушение структуры можно проводить различными способами. Выбор его зависит от объекта и задач исследования. Такими методами могут быть:
а) гомогенизация тщательным растиранием замороженного материала;
б) высокочастотные ультразвуковые методы;
в) метод высоких давлений;
г) метод разрушения наполнением клетки азотом и затем быстрым сбрасыванием давления (азотная бомба).
При выборе способа разрушения клеточной структуры следует помнить, что интенсивное механическое воздействие может привести к нежелательному разрушению структуры пептидной цепи.
После удаления клеточных структур диализом, освобождаются от различных малых молекул и, затем, собственно, начинается выделение и очистка белка;
2. экстракция белка - это процесс переведения белка в раствор. Выбирая различные экстрагенты и условия экстракции, можно селективно перевести различные белки в раствор. Например, экстракция водой позволяет выделить из биологических объектов альбумины; экстракция солевыми растворами (5-10% NaCl) - глобулины, спиртами - проламины, разбавленными растворами щелочей (0,1-0,2%) - глютеины. Экстракцию, как правило, повторяют несколько раз для полного извлечения биологического материала.
3. осаждение белков. Выбор способа и режима зависит от поставленной задачи:
а) осаждение трихмеруксусной кислотой - это метод отделения белкового азота от небелкового (белков от пеитидов и аминокислот). Но при этом происходит необратимая денатурация белка;
б) осаждение органическими растворителями (спиртом, ацетоном и т.д.). Нужная белковая фракция отделяется путем подбора нужной концентрации растворителя. Если проводить операцию осаждения при низкой температуре (4С), то удается в большинстве случаев сохранить нативную структуру белка;
в) высаливание. Осаждение белков из раствора под действием солей щелочных, щелочноземельных металлов и сульфата аммония называется высаливанием. Впервые высаливание было применено Меем в 1878г. Чаще всего высаливание проводят путем ступенчатого повышения концентраций соли (от 20 до 100%). При этом происходит последовательное выпадение белков различных классов. Глобулины выпадают в осадок при 50% насыщении, альбумины - при 100%, другие - при промежуточных степенях насыщения. Механизм осаждения высаливанием связан со способностью солей разрушать гидратную оболочку растворенных белковых макромолекул, что приводит к их агрегации и последующему осаждению;
г) осаждение в изоэлектрической точке. При изменении pH белкового раствора можно осуществить избирательное высаждение белков. При таком способе осаждения обычно сохраняется нативная структура белков, как в осадке, так и в надосадочной жидкости. Осаждение в изоэлектрической точке, также как и высаливание, относятся к мягким режимам выделения белка;
д) осаждение тепловой коагуляцией. Осаждение белков можно проводить, изменяя режим тепловой обработки белкового экстракта. При этом лабильные белки выпадают в осадок и инактивируются, а более термостабильные белки остаются в растворе.
После выделения белков, следует этап их концентрирования и далее очистка, причем наиболее эффективными являются различные хроматографические методы. К их преимуществам следует отнести:
- технологическую гибкость, заключающуюся в реализации различных межмолекулярных взаимодействий;
-динамичность, т.е. селективность взаимодействий хроматографического носителя с целевым веществом, содержащемся в многокомпонентной смеси;
- вещества в процессе хроматографического разделения, как правило, не подвергаются химическим изменениям.
Хроматографические методы, применяемые на стадии концентрирования
На стадии концентрирования получают сырец, содержащий 50-80% целевого вещества.
Адсорбционная хроматография основана на различном сродстве к твердому носителю.
Распределительная хроматография основана на различной растворимости (распределении) между неподвижной и подвижной фазами.
Ионообменная хроматография основана на электростатическом взаимодействии заряженных поверхностей белков и плотными кластерами заряженных групп ионообменника. Помимо ионных, белковые молекулы способны образовать с ионитами водородные и гидрофобные (Ван-дер-Ваальса) связи.
Фронтальная ионообменная хроматография - фильтрация раствора, содержащего несколько сорбирующихся веществ, через колонку с сорбентом. Из-за различной связи с сорбентом образуется ряд зон, двигающихся с различными скоростями. Фронтальная хроматография эффективна как для аналитических, так и для препаративных целей.
Методы очистки белков
Электрофорез - физический метод разделения белков в электрическом поле постоянного тока. Белковые молекулы являются амфотерными соединениями и в растворах имеют разные по величине и знаку заряды. В электрическом поле постоянного тока белки движутся к аноду или катоду в зависимости от знака своего заряда. Скорость определяется величиной заряда.
Изоэлектрическое фокусирование белков. В этом методе совмещены два подхода электрофорез и свойство белка быть нейтральным в определенной изоэлектрической точке (определенное значение pH). Белок движется под воздействием электрического тока по колонке по всей высоте которой создан градиент pH. Когда он достигает той области, где pH равен изоэлектрической точке, то заряд его становится равным нулю, белок теряет свою подвижность и концентрируется в этой узкой области. Разные белки локализуются в разных частях колонки, где pH равен их изоэлектрической точке. Характерной особенностью является высокая разрешающая способность метода. Современная аппаратура позволяет разделять белки отличающиеся по значению изоэлектрической точки на 0,02 единицы.
Хроматографические методы, применяемые на стадии тонкой очистки
Молекулярно-ситовая хроматография. При данном виде хроматографии используется способность материалов с контролируемой пористостью сортировать и разделять компоненты смеси в соответствии с размерами и формой их молекул. Этот метод еще носит название гель-хроматографии. Для осуществления процесса используются гели декстранов (сефадексы и сефакрилы), поперечно-сшитые полиакриламидные гранулы (биогели), смешанные гели - агарные и полиамидные (ультрагели) и более жесткие поперечно-сшитые полимеры (СL-агарозы, сефакрилы-S). Степень удерживания растворенного вещества зависит от его способности проникать в гели. Поэтому при гельфильтрации сначала выходят высокомолекулярные соединения, а затем вещества в порядке убывания их молекулярных масс, т.е. гель выполняет роль молекулярного сита.
Афинная хроматография. Данный метод заключается в использовании иммобилизованного на матрице специфического соединения - лиганда, способного специфически и необратимо связываться только с белками и ферментами, имеющими сродство к данному лиганду. Все белки, не проявляющие сродство к данному ферменту, свободно проходят через колонку. Специфическими реагентами связанный белок затем вытесняется .
Иммуноадсорбция. Абсолютно специфическим агентом по отношению к какому-либо белку является антитело к этому белку. Этот метод, как высокоспецифичный, используется для очистки ферментов.
Высокоэффективная жидкостная хроматография (ВЭЖХ) - это вариант колоночного типа, с её помощью можно выделять высокоочищенные вещества из сложной многокомпонентной смеси. К преимуществам ВЭЖХ можно отнести:
- высокую скорость процесса;
- минимальную степень размывания хроматографических зон;
- высокую степень автоматизации при отборе проб.
К недостаткам ВЭЖХ следует отнести дороговизну этого метода.
Существует различные варианты ВЭЖХ:
Нормально-фазовая хроматография. В этом случае подвижная фаза менее полярна, чем неподвижная, и основной фактор, определяющий удерживание - это взаимодействие разделяемых веществ с поверхностью или внутренним объемом сорбента.
Обращенно-фазовая хроматография. При этом варианте ВЭЖХ подвижная фаза более полярна, чем неподвижная.
Ионообменная (ионо-парная) хроматография. При данном виде ВЭЖХ в подвижную фазу добавляют противоион, изменяющий сорбционные характеристики системы.
Гель-фильтрация. Гель состоит из открытой поперечно-сшитой полимерной структуры, сформированной в виде шариков (гранул). Поры внутри гранул имеют такие размеры, что некоторые из них не доступны для крупных молекул.
Применение белков в медицинской практике
В клинической практике широко применяются белковые гидролизаты. При помощи кислотного или ферментативного гидролиза казеина получают гидролизаты медицинского назначения. Например, препарат амиген применяют при кровопотерях, для парентерального питания применяют гидролизаты белков (аминопептид, амикин, фибриносол). Препарат церебролизин, состоящий из смеси незаменимых аминокислот, назначают при нарушении мозгового кровообращения, потере памяти, умственной отсталости.
Полипептиды и их физиологическая роль
Полипептиды аналоги белковых молекул, они играют самостоятельную роль в функционировании живого организма. Структура и конформационные состояния полипептидов определяются теми же силами и взаимодействиями, что и для белков. Полипептиды различны по своему происхождению. Полипептиды могут получаться в результате расщепления белка (неполного) и нести остатки информации, заложенной в нем, т.е в таком случае в их нативную цепь входят протеиногенные кислоты. Они могут синтезироваться и самостоятельно и иметь свою индивидуальную структуру, в таком сучае в них могут содержаться и непротеиногенные кислоты.. Оказалось, что в некоторые полипептиды могут входить аминокислоты даже имеющие D-конфигурацию аминогруппы. Оказалось, что и свойства их в организме очень разнообразны.
регуляторны транспортные гормоны



 токсины
пептиды нейропептиды
токсины
пептиды нейропептиды



антибиотики алканоиды вкусовые пептиды
Нейропеитиды. К таким пептидам относят пептиды, обнаруженные в мозге и способные влиять на функции центральной нервной системы. К этой же группе относятся пептиды гипоталамуса и гипофиза. Многие из них регулируют поведенческие реакции животных и человека, например, такие, как пищевая насыщаемость, жажда, сон, обучаемость, удовольствие, двигательная активность и др.
Обнаружены морфиноподобные или опиоидные пептиды, которые снижают болевые ощущения. Они представляют собой группу аналогичных по строению соединений, общего направления воздействия и близких по структуре. Несколько нейропеитидов, как правило, могут происходить от одного предшественника, путем последовательного отщепления фрагментов.
В качестве примера можно показать образование группы опиоидных нейропептидов (эндорфинов):
Исходный пептид (200 а.к.) -липотропин (91 а.к.) -эндорфин (31 а.к.) -мет-энкефалин (5 а.к.).
Гидролиз осуществляется за счет ферментов пептидаз. Эндорфины должны синтезироваться в организме в контролируемых количествах. Увеличенный синтез эндорфинов в организме снижает обучаемость и память. Подобные пептиды опойного действия обнаружены среди продуктов неполного гидролиза молока и хлеба.
Другой пример нейропеитида - это соматотропин - нейрогормон роста. Этот гормон был впервые синтезирован К.Итакура и Г.Ц.Бойер, генной инженерией. Используется при задержке роста, а так же при лечении диабета.
Многие из нейропеитидов имеют несложную структуру и легко могут быть получены синтетическим путем. А это, в свою очередь, позволяет воздействовать на психику людей.
Транспортные полипептиды. Относятся природным комплексным соединениям. Полипептидная цепь замкнута в циклическую структуру и имеет полости определенных размеров. В таких полостях содержится несколько гидроксильных групп, которые путем донорно-акцепторного взаимодействия могут связать те металлы, размеры которых соответствуют плоскостям. Получившийся вторичный комплекс играет роль транспортов ионов через мембрану (ионофоры).
Известны ионофоры соответствующие ионам кальция Са2+, он осуществляет транспорт кальция через мембрану разделяющую внутри- и межклеточную жидкость. Другой пример политранстпорных пептидов – ионы натрия Na+, он работает по эстафетному механизму, имеет спиралевидную форму кислородсодержащих групп. Сечение соответствует иону натрия Na+ , и натрий по эстафете передается от одной кислородсодержащей группы к другой.
Пептидные токсины. Белково-пептидную природу имеют самые мощные токсины микробного происхождения – например, ботулинистический токсин, продуцируемый clostridium botulinum. Он вызывает тяжелейшие, часто смертельные пищевые отравления. Чаще всего, причиной отравления этим токсином являются продукты домашнего консервирования. Пептидную природу имеют токсины змей, скорпионов, пчел. Очень много подобных токсинов в бледной поганке (0,4мг на 1г массы при смертельной дозе для человека 5-7мг).
Вкусовые пептиды. Большое внимание пищевиков привлекают пептиды с ярко выраженными вкусовыми качествами. Широко известен пептидный подсластитель аспартам, он в 200 раз слаще сахарозы. Его структура:

При неправильной обработке из казеина молока может образоваться гептапептид горького вкуса: Арг - Гли - Про - Фен - Иле - Вал.
Регуляторные пептиды. Они могут регулировать разные функции, например, регуляторы иммунитета. Полипептид циклоспорин - антибиотик, способен ингибировать отторжение пересаживаемых органов и тканей.
Здесь нельзя не упомянуть -глутамилцистеинилглицин (глутатион). Он содержится в каждой живой клетке. Он регулирует окислительно-восстановительные реакции по схеме:

Защищает S-Н группы белков от окисления, активируя тиоловые (цистеиновые) ферменты по схеме:
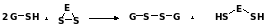
Глутатион защищает от окисления аскорбиновую кислоту и другие биологически активные соединения, выполняет функции радиопротектора, участвует в транспорте аминокислот через биологическую мембрану клетки.
Глутатион является важнейшим детоксицирующим агентом. Он обезвреживает соединения ртути, фосфорорганические соединения, ароматические углеводороды, токсические перекисные соединения. Нарушения обмена глутатиона в организме нарушает функции костного мозга.
Главным источником глутатиона являются дрожжи, он активно влияет на все процессы происходящие при брожении. За 4 часа брожения выделяются от 80 до 300 мкг/г глутатиона.
Пептиды-гормоны по механизму действия они близки к белковым гормонам и лишь по формальным признакам относятся к пептидным, это тканевые гормоны. В коре почек содержится гормон ренин, образующийся при расщеплении сывороточного -глобулина. Его функции в организме связаны с регулированием кровяного давления и солевого обмена. Он выделяется в кровь в ответ на понижение давления и снижения концентрации Na+. Другой гормон коллидин, напротив, способствует понижению кровяного давления. Кальцитонин снижает концентрацию кальция в крови. Глюкагон, наряду с инсулином, регулирует углеводный обмен, гастрин активно участвует в процессах пищеварения, выполняя множество функций.
Полипептиды ответственны за возникновение пищевых аллергий (непереносимость отдельных продуктов питания - молоко, белок куриного яйца, рыба, мясо). Это является следствием нарушения процесса пищеварения, что приводит к неполному расщеплению белков, образующиеся полипептиды являются антигенами для организма человека и вызывают аллергические реакции, поскольку они несут частичную информацию белка, от которого они происходят. Если таких антигенов немного, то это только полезно для тренировки иммунной системы. Избыточное количество вредно.
