
Волгоградский Государственный Технический Университет
Термодинамическая возможность коррозии. Диаграмма Пурбе.
Выполнил:
Проверил:
Гаевский Ю.К.
Волгоград 2008 г.
Коррозия — разрушение металлов в результате химической или электрохимической реакции. В некоторых случаях химическое воздействие сопровождается физическим разрушением и называется коррозионной эрозией, коррозионным износом или фреттинг-коррозией. Ржавлением называется коррозия железа и его сплавов с образованием продуктов коррозии, состоящих в основном из гидратированных оксидов железа.
Изменение энергии Гиббса.
Возможность протекания любой химической реакции, включая реакцию металла с окружающей средой, определяется изменением энергии Гиббса ∆G. Чем выше отрицательное значение ∆G, тем больше термодинамическая возможность реакции.
Для примера рассмотрим следующие реакцию при 25 °С:
Mg + Н2О (ж.) + 1/2 О2 (г.) —>Mg (OH)2 (тв.), ∆G = — 142 600 кал.
Cu + Н2О (ж.) + 1/2 О2 (г.) —>Cu (OH)2 (тв.), ∆G = — 28 600 кал.
Au + 3/2Н2О (ж.) + 3/4 О2 (г.) —>Au (OH)3 (тв.), ∆G = — 15 700 кал.
В последней реакции изменение энергии Гиббса положительно — это свидетельствует о невозможности протекания этого процесса, т. е, о том, что золото в водной среде не, коррозирует с образованием Аu(ОН)3. Следует отметить, что термодинамическая возможность коррозии не является мерой скорости коррозионного процесса. Высокому отрицательному значению ∆G не всегда соответствует высокая скорость коррозии, но если ∆G положительно, можно утверждать, что в данных условиях реакция не пойдет. При отрицательном ∆G, реакция может идти и с высокой и с низкой скоростью — в зависимости от различных факторов.
С точки зрения электрохимического механизма коррозии, термодинамическая возможность процесса может быть описана электродвижущей, силой (э. д. с.) коррозионных элементов, суммарное действие которых и есть коррозионный процесс.
Зависимость между ∆G в джоулях и э. д. с. в вольтах выражается уравнением: ∆ G= —EnF;
где Е — э. д. с; п — число электронов или химических эквивалентов, участвующих в реакции; F—число Фарадея (96 500 Кл/моль),
Таким образом, чем больше э. д. с. любого гальванического элемента, тем больше термодинамическая возможность протекания его суммарной реакции.
Э. д. с. элемента в лаборатории или в полевых условиях измеряют компенсационным методом, сравнивая ее с известной э. д. с. в отсутствие тока в элементе.
Для этого используют измерительную схему:
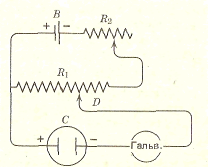
Калиброванное равномерное сопротивление R1 соединено с батареей В на 1,5—4 В через реостат R2. Каждое положение контакта D отвечает определенному значению напряжения, лежащему между нулем (при крайнем левом положении) и максимальным значением (крайнее правое положение). Сначала элемент С замещается нормальным элементом Вестона, э. д. с. которого известна.
С помощью регулируемого сопротивления R2 добиваются исчезновения тока в гальванометре, при этом контакт D находится в положении, соответствующем э. д. с, нормального элемента. Затем в цепь включают элемент о неизвестной э. д. c. и c помощью сопротивления R2 снова добиваются исчезновения тока в цепи. Соответствующий отсчет положения контакта D в вольтах дает значение э. д. с. элемента.
Чувствительные гальванометры с высоким входным сопротивлением удобны для измерения э. д. с, так как позволяют получить правильные значения даже при отсутствии точной компенсация. Эти гальванометры имеют следующие недостатки: во-первых, они требуют тщательной изоляции всех подводящих проводов, особенно в сырую погоду, и, во-вторых, необходимо экранировать все провода и контакты для защиты от внешних электрических наводок, вызванных, например, находящимися вблизи высокочастотными генераторами, коммутационными устройствами.
