
- •Глава 8. Порушення обміну сполучної тканини і остеопороз о.Я. Гречаніна, о.В. Бугайова, р.В. Богатирьова
- •Клінічні типи сед, які діагностовані у обстежених хворих
- •Клінічні ознаки класичного типу сед
- •Клінічні ознаки гіпермобільного типу сед
- •Клінічні ознаки васкулярного типу сед
- •Клінічні ознаки кіфосколіотичного типу сед
- •Клінічні ознаки артрохалазисного типу сед
- •Клінічні ознаки шкіряного типу сед
- •Диференційно-діагностичі ознаки різних типів сед і сед з вираженою венозною мальформацією нижніх кінцівок, остеопорозом та вторинною мітоходріопатією
- •Диференційно-діагностичі ознаки різних типів сед і сед з ураженням серцево-судинної системи, скелету і розвитком екзостозів
- •Спостереження 3 (рис. 9-12; табл. 10).
- •Список літератури
Глава 8. Порушення обміну сполучної тканини і остеопороз о.Я. Гречаніна, о.В. Бугайова, р.В. Богатирьова
Сполучна тканина (СT) розвивається з мезенхіми, яка дає початок зовні не схожим одна на одну тканинам: шкірі та кісткам, крові та лімфі, гладким м'язам і хрящам. Названі тканини поєднує не тільки загальне походження, але й спільність структури та функції. Різноманіття та складність морфології та функції СТ припускає активну участь основних її елементів у розвитку багатьох видів патології. Величезне число ланок, що становлять систему СТ, кожне з яких контролюється генами й може мати ушкодження останніх, створює умови для генетичної гетерогенності аномалій розвитку й захворювань, що протікають із ураженням сполучнотканинних структур [32, 40, 41].
Спадкову патологію СТ, що проявляється зниженням її міцності, прийнято позначати терміном «дисплазія». Сполучнотканинна дисплазія (СТД) – це унікальна онтогенетична аномалія розвитку організму, що відноситься до числа складних, ще невивчених питань сучасної медицини. Під цим терміном варто розуміти аномалію тканинної структури, яка проявляється в зменшенні вмісту окремих видів колагену або порушенні їхнього співвідношення, яке приводить до зниження міцності СТ багатьох органів і систем [25]. Наслідком цього є розлад гомеостазу на тканинному, органному та організменному рівнях, що супроводжується різними морфо-функціональними порушеннями вісцеральних і локомоторних систем із прогредієнтним плином.
Відомо, що патологія СТ є основою формування хронічних захворювань у дітей і підлітків [18, 29, 38, 48]. Однак описано, що носійство СТД підвищує ризик розвитку й гострих життєвонебезпечних станів для організму таких, як аневризма аорти, тромбоемболії, інфекційний ендокардит і аритмії, які можуть стати причиною раптової смерті хворих [16, 35]. Це визначає значимість і перспективи розробки проблем патології СТ для практичної медицини.
Особливий вид сполучної тканини - кістка. Найбільш виражені порушення кісткової тканини спостерігаються при недосконалому остеогенезі та остеопорозі. Дослідження хряща, виділеного з гребеня клубової кістки, в цьому випадку показали підвищений вміст протеогликанів та несульфатованих ГАГ у матриксі хряща, що порушує трофіку хондроцитів [22, 26]. Гістологічно це виявляється зменшенням об'єму та зміною форми хондроцитів: уплощенням, слабою проліферацією, відсутністю характерної архітектоніки. Крім того, у хондроцитах виявляються набряклі мітохондрії та розширені цистерни ендоплазматичної сіті, а в міжклітинній речовині - аномальний колаген. Мабуть, змінені хондроцити синтезують недостатню кількість лужної фосфатази, що сприяє порушенню процесу кальцифікації хряща. Нерівномірність розподілу та зниження ступеня загальної мінералізації кісток та хряща мають місце при синдромі Марфана, недосконалому остеогенезі, остеопорозі [33, 58]. Неповноцінність укладання колагенових фібрил та мінералізації при недосконалому остеогенезі та остеопорозі порушують опорну функцію кістки, знижуючи її густину, еластичність та пружність, що супроводжується виникненням переломів кісток.
Молекулярні дефекти при спадкових хворобах сполучної тканини (СХСТ) породжують зміни колагенових та еластичних фібрил, глікопротеїдів, протеогликанів, фібробластів та інших компонентів сполучної тканини [27, 60, 78]. Структурні трансформації фібрил ведуть до порушень на рівні тканин та органів, що реалізується у гетерогенному фенотипі та поліморфній органній патології.
Успіхи в області молекулярної генетики дозволили досягти значного прогресу у вивченні генетичної природи спадкових захворювань сполучної тканини. Так, з’ясовано, що колаген належить до сімейства позаклітинних матриксних білків. На даний час ідентифіковано 19 типів колагенових білків, що включають більш ніж 30 видів поліпептидних ланцюгів, гени яких розподілені на 12-ти хромосомах. [60, 72].
Колагенові білки підрозділяють на два класи. Перший клас (до нього відносять близько 95 % колагенових білків) представлений інтерстеціальним колагеном (I, II, III, V типів), який формує крупні волокна [51, 56, 59]. Другий клас - нефібрілярний (мінорний) колаген (IV, VI-XIX типів), створюючий дрібні волокна, вистилаючі базальні мембрани (колаген IV типу), десцементні мембрани (колаген VIII типу) [67]. Колаген типу I і V називають також перицелюлярними (клітинно-зв'язаними). Вони відкладаються навкруги клітин та утворюють для них опору по типу екзоцитоскелета [56, 57, 69].
СХСТ пов'язані з мутаціями в генах, відповідальних за формування первинної структури колагену, компонентів екстрацелюлярного матриксу, а також численних ферментів, що беруть участь у внутрі-та позаклітинному дозріванні колагену, фібрилогенезі, утворенні колагенових волокон. Мутації в колагенових генах або дефіцит активності пострансляційцних ензимів колагенового синтезу викликають такі спадкові хвороби, як недосконалий остеогенез, синдром Альпорта, ряд хондродисплазій, деякі типи синдрому Елерса-Данлоса, дистрофічної форми бульозного епідермолізу та інші. Мутації в генах колагену I, II, III типів знайдені при таких відносно нерідких захворюваннях, як остеопороз, остеоартроз, аневризма аорти, що дозволяє розцінити їх як сприяючі чинники до розвитку вказаних хвороб. На даний час хромосомна локалізація генів визначена для більш ніж 30-ти захворювань. Проте секвенована тільки третина генів [23]. Таким чином, молекулярно-генетичні дослідження структури колагену знаходяться ще на початкових стадіях.
На прикладі СХСТ добре простежуються кореляції між типами мутацій і клінічними особливостями перебігу захворювань. При цьому вирішальне значення мають характер точкових мутацій в кодонах, відповідних певним амінокислотам та ведучих до заміни амінокислот в білці колагену - супресорний або активуючий тип мутацій; наявність супутніх мутацій в генах, контролюючих структуру інших макромолекулярних компонентів екстрацелюлярного матриксу. Подовження (інсерція) або укорочення (делеція) ланцюга колагену, різноманітні точкові мутації, що супроводжуються заміною навіть однієї амінокислоти, викликають порушення утворення поперечних зв'язків в молекулі колагену, зменшення його термічної стабільності, уповільнення спіралетворення, зміна посттрансляційних модифікацій та посилення внутріклітинної деградації. «Аномальний» колаген гіперчутливий не тільки до підйому температури, але й до зміни рН, збільшеним механічним навантаженням. Зменшення міцності колагену прискорює його позаклітинну деградацію, що клінічно характеризується проградієнтністю течії, обумовленої порушеннями на рівні тканин або органів [78].
На вираженість та тип клінічних проявів впливають аномалії структурних білків та білково-вуглеводних комплексів. Так, при остеопорозі та недосконалому остеогенезі знайдені зниження змісту остеонектину, протеогліканів, сіалопротеїдів [22].
Біохімічні дослідження показали, що в основі гіпереластичності шкіри, деформації грудної клітки та хребта, надмірній мобільності суглобів лежать генетично обумовлені порушення структури та функції колагену, еластину, фібронектину, протеогліканів [34, 47].
Як класична патоморфологічна ознака пролапсу митрального клапана описується накопичення в міксематозно змінених стулках кислих мукополісахаридів, колагенових та еластичних волокон [19].
Клініко-морфологічні порушення при СХСТ свідчать про системність поразки, що пов'язано з "повсюдністю" сполучної тканини, що становить строму всіх органів та тканин. Генетичні дефекти компонентів сполучної тканини обумовлюють зниження її стабільності та ведуть до виникнення клінічних порушень органів та тканин, в яких нормальний розвиток сполучної тканини має особливо важливе значення.
Морфологічні зміни в тканинах та органах неспецифічні, а їх прояви схожі при різних СХСТ. Вони виявляються вже у антенатальному та прогресивно розвиваються в подальших періодах життя організму [22].
Фенотипічні та органні прояви залежать від того, яка сполучна тканина уражена більше - щільна або рихла [48]. Саме даним співвідношенням пояснюються порушення формоутворення кісткової та хрящової тканин, дефекти шкіри, судинні та клапанні ураження серця, очей, центральної нервової системи, шлунко-кишкового тракту, нирок та інших органів.
Ураження щільної оформленої сполучної тканини у пацієнтів з різними варіантами СХСТ маніфестує скелетними змінами та включає астенічну статуру, доліхостеномелію, арахнодактилію, кілевидну та воронкоподібну деформацію грудної клітки, сколіози, кіфози та лордози хребта, синдром "прямої спини", плоскостопість та інші. Вказані зміни багато в чому пов'язані з порушенням будови хряща. У пацієнтів із СХСТ визначається затримка дозрівання епіфізарної зони зростання хряща, що клінічно виражається подовженням трубчастих кісток. Неповноцінність ребрових хрящів (дистрофічні зміни хондроцитів, порушення формування хондринових волокон - відсутність пучковості, поява подовжніх щілин, стоншення) - причина деформацій грудної клітини. При біохімічному дослідженні основної речовини ребрових хрящів виявляються порушення сульфатованих ГАГ у вигляді зниження кількості хондроїтин-4- та хондроїтин-6-сульфатів, виражене зростання кількості гликопротеїдів, наявність колагену III та IV типів, які в нормі в хрящі не зустрічаються, а також збільшення змісту та перерозподіл у клітинному матриксі колагену V типу. Вказані порушення приводять до розвитку дистрофічних процесів в клітинах та основній речовині ребрового хряща. Зміна будови певних типів колагену, а також їх взаємостосунків з глікозаміногліканів (ГАГ) та глікопротеідів (ГП) може викликати утворення нестабільних колагенових структур та впливати на біохімічну міцність ребрового хряща, сприяючи деформації грудної клітини [22, 26].
В даний час більшість фахівців підрозділяє спадкові захворювання сполучної тканини на дві групи:
Захворювання, обумовлені порушенням синтезу або катаболізму волоконних компонентів сполучної тканини.
Захворювання, обумовлені порушенням синтезу або катаболізму основної речовини сполучної тканини .
При цьому, кажучи про спадково обумовлену патологію сполучної тканини, частіше за все мають на увазі саме першу групу захворювань.
З нашої точки зору, на сьогоднішній день спадкову патологію сполучної тканини можна розділяти на дві групи, як це зробили М.П. Бочков та Ю.Є. Вельтищев, ще у 1992 році [32]:
Захворювання монофакторного характеру (хромосомного або генного)
Захворювання мультифакторіальної природи.
З клінічної практики відомо, що ознаки ураження сполучної тканини зустрічаються при багатьох хромосомних хворобах, що виникли унаслідок кількісних або структурних аномалій аутосом (наприклад, при хворобі Дауна, синдромі трисомії 8-ї хромосоми та інших), а також статевих хромосом (при синдромі Шерешевського-Тернера, Клайнфельтера, трисомії по Х-хромосомі та інших).
СХСТ генної етіології, у свою чергу, можна розділити на дві групи:
Хвороби зі встановленим генним дефектом
Хвороби з невстановленим генним дефектом.
В групу хвороб зі встановленим генним дефектом доцільно віднести відомі диференційовані сполученотканинні дисплазії, обумовлені порушенням:
синтезу колагену (недосконалий остеогенез, синдром Елерса-Данлоса, синдром Марфана, різні варіанти хондродисплазій, бульозний епідермоліз та інші);
розпаду колагену (фібрози легенів, нирок, печінки);
синтезу еластичних волокон (синдром "млявої шкіри", синдром Вільямса та інші);
розпаду протеогликанів, ГАГ, муколіпідів, сфинголіпідів, олігосахарів (манози, фруктоза) та інші, при яких зміни скелета нерідко супроводяться "Гурлер-" або "Моркіо-"подібними фенотипами.
В групу хвороб сполучної тканини мультифакторіальної природи (або хвороб із спадковою схильністю), в реалізації яких грають роль мутації великої кількості генів і дію різноманітних чинників зовнішнього середовища, можна віднести такі захворювання, як ревматоїдний та реактивний артрити, дисплазія тазостегнового суглоба, сколіоз, значне число природжених вад розвитку скелета та інші.
СХСТ можна класифікувати з урахуванням генетичного дефекту на шляхах синтезу або розпаду колагену:
Спадкові колагенопатії, обумовлені мутаціями в колагенових генах на етапах синтезу колагену, а саме:
колагену I типу (недосконалий остеогенез, синдром Елерса-Данлоса 7 типа, синдром Марфана, остеопороз);
колагену II типу (ахондроплазія, гіпохондроплазія, спонділоепіфізарна дисплазія, синдром Стіклера та інші);
колагену III типу (синдром Елерса-Данлоса 4 типу, аневризма аорти та інші);
колагену IV типу (синдром Альпорта);
колагену V типу (синдром Елерса-Данлоса 1 і 2 типів);
колагену VII типу (простий бульозний епідермоліз, дистрофічна бульозна форма епідермолізу та інші);
колагену X типа (спонділометафізарна дисплазія) та інші.
Спадкові колагенопатії (ферментопатії), обумовлені мутаціями в генах, що "працюють" на етапах внутрі- та позаклітинного дозрівання колагену (дефіцити лізілгідроксилази при синдромі Елерса-Данлоса 6 типу, лізілоксилази при синдромі Елерса-Данлоса 9 типу) і інші.
Спадкові колагенопатії (ферментопатії), обумовлені мутаціями в генах, відповідальних за синтез ферментів, що беруть участь в процесі розпаду колагену(цирози легенів, печінки та нирок).
Зрозуміло, група спадково обумовлених колагенопатій розширятиметься у міру вдосконалення знань в області молекулярної діагностики СХСТ. Аналогічно, в недалекому майбутньому, ймовірно, вдасться класифікувати й хвороби, пов'язані з дефектом синтезу еластичних та інших волокон [27].
СТД – це багаторівневий процес, пов'язаний як з кількісними, так і з якісними змінами основних її структур. Провідне значення в розвитку клінічної картини СТД мають мутації генів, які кодують синтез і просторову організацію колагену, відповідальних за формування компонентів екстрацелюлярного матриксу, а також численних ферментів, які беруть участь усередині- і позаклітинному дозріванні колагену та процесах фібрілогенезу.
Водночас з'явилися відомості про роль екзогенних факторів у розвитку дезорганізації СТ. Так, B. Steinmann із співавт. показали, що різноманіття клінічних проявів СТД можна пояснити не тільки мутацією різних генів або варіабельною експресивністю одного з них, але і дією середовищних факторів. Показано, що, наприклад, мінливість фенотипу при синдромі Елерса-Данлоса (СЕД) лише в 11,5 % випадків обумовлена генетичними дефектами, а в інших - пов'язана із впливом факторів зовнішнього середовища. Диспластичні зміни СТ можуть бути обумовлені несприятливою екологічною обстановкою, неадекватним харчуванням, стресами, які впливали на організм у процесі онтогенезу.
Досить точних відомостей про поширеність СТД нараз не існує. Можна лише думати, що частота виявлення цього синдрому досить велика, а дані, отримані різними авторами з цього питання, багато в чому залежать від використовуваних ними методичних підходів і технічної оснащеності [16].
Спадкові захворювання СТ підрозділяють на диференційовані та недиференційовані СТД. Диференційовані дисплазії СТ характеризуються певним типом успадкування, чітко окресленою клінічною картиною, а в низці випадків - установленими та досить добре вивченими генними або біохімічними дефектами. У цій групі дисплазій найчастіше зустрічаються недосконалий остеогенез, СЕД і синдром Марфана. Ці захворювання відносяться до спадкових хвороб колагену - колагенопатіям.
Недиференційовані форми СТД широко поширені та діагностуються тоді, коли в пацієнта набір фенотипових ознак не укладається в клінічну картину жодної з колагенопатій. Для позначення цих захворювань у літературі використовуються терміни «недиференційована», «первинна», «малі форми дисплазії», «легка генералізована патологія». M. J. Glesby і R. E. Pyertz пропонують говорити про існування СТД із змішаним фенотипом, застосовуючи акумулятивний «MASS-фенотип» за першими буквами найбільш частих фенотипових ознак (Mitral valve, Aorta, Skeleton, Skin). Е. В. Земцовський виділяє цю групу захворювань як нозологічно самостійний синдром СТД полігено-мультифакторіальної природи, що проявляється зовнішніми фенотиповими ознаками з диспластичними змінами СТ і клінічно значимої дисфункцією одного або декількох внутрішніх органів [20].
Недиференційована СТД - це, без сумніву, не єдина нозологічна одиниця, а генетично гетерогенна група, яка є основою формування різних хронічних захворювань. Вони можуть мати спадкову природу, причому частіше з ознаками аутосомно-домінантного типу успадкування. Уважний лікарський огляд членів родини пробанду, клініко-інструментальні та лабораторні дослідження, виконані за єдиною програмою, дозволяють виявити у родичів хворого I або II ступеня споріднення симптоми ураження СТ, які не відповідають жодному з диференційованих захворювань.
Існують придбані та недиференційовані дисплазії СТ, які виникають у результаті впливу різноманітних несприятливих факторів на плід у період його внутрішньоутробного розвитку, що призводить, при певній генетичній схильності, до порушення нормального ембріогенезу. Поліорганість ураження при цьому варіанті дисплазії обумовлена тим, що тератогенний термінаційний період для багатьох органів і систем приблизно однаковий (7-12 тиждень). При клінічному обстеженні родичів пацієнтів з подібними захворюваннями в них не виявляється типових ознак ураження СТ, тоді як дані родоводів свідчать про «накопичення» у родинах хворих такої патології, як остеохондроз, остеоартроз, варикозне розширення вен, геморой.
Аналіз анамнестичних даних пацієнтів виявляє несприятливий перебіг раннього внутрішньоутробного періоду: захворювання матері в першому триместрі вагітності, прийом медикаментів або наявність професійних шкідливостей. Клінічні спостереження дозволяють вести мову про сімейні неспадкові форми недиференційованої СТД, причиною розвитку яких є вплив факторів зовнішнього середовища: незбалансований характер харчування, несприятлива екологічна ситуація, особливо, в ендемічних зонах.
Недиференційована патологія СТ може проявлятися диспластичними змінами як в одному, так і в декількох органах або системах. Системність ураження багато в чому обумовлена широким поширенням в організмі самої СТ, що становить строму всіх органів. Характер ураження органів обумовлений їх власними паренхиматозно-стромальними взаємовідносинами. Морфологічні зміни в тканинах і органах неспецифічні та проявляються подібним чином при різних дисплазіях, що мають різний ступінь виразності.
Генетично визначені дефекти різних компонентів СТ обумовлюють зниження її стабільності, стійкості, міцності, ведуть до формування клінічних проявів у тих органах і тканинах, де розвиток і цілісність СТ мають максимальне значення. Певні фенотипові ознаки дозволяють запідозрити СТД уже на стадії клінічного огляду. Наприклад, зниження міцності зв'язкового апарата призводить до гіперрухливості суглобів, шкіри - до її гіпереластичності. Порушення синтезу колагену в кістковій, а особливо - у хрящовій тканині призводить до таких порушень як воронкоподібна або килеподібна грудна клітина, деформація хребта.
Всі клінічні ознаки, властиві СТД, можна розділити на три групи, що відповідають первинній закладці органів в ембріогенезі, - мезо-, екто- і ендодермальних аномалій. Мезодермальні аномалії проявляються змінами з боку кістяка (деформації грудної клітини, хребта, черепа, «готичне піднебіння», уповільнення росту верхньої та нижньої щелепи, гіпермобільність суглобів), шкіри та м'яких тканин (гіперрозтяжність і стоншення шкіри, гіпоплазія мускулатури та жирової тканини), внутрішніх органів (вади серця, пролапси клапанів, збільшення діаметра аорти та легеневої артерії), очей (виражена міопія, анірідія, блакитні склери), судин (неповноцінність ендотелія, підвищена проникність і крихкість).
Зміни з боку зубів (аномальне розташування, неправильне формування та раннє випадання, гіпоплазія емалі, множинний карієс, резорбція ясен), очей (ектопія та рухливість кришталика, афакія, колобома), центральної нервової системи (ЦНС) (анізокорія, асиметрія сухожильних рефлексів, ністагм, пірамідні розлади) мають ектодермальне походження, а довгий і гіпопластичний кишечник - ендодермальне.
Фенотипові та органні прояви залежать від того, яка СТ уражена більше - щільна або пухка. Так, ураження щільної оформленої СТ маніфестує кістяковими змінами та включає астенічну статуру, доліхостеномелію, арахнодактилію, килеподібну та воронкоподібну деформацію грудної клітини, сколіози, кіфози та лордози хребта, синдром «прямої спини», асиметрію в довжині кінцівок, плоскостопість та ін.
Кістякові зміни багато в чому пов'язані з порушенням будови хряща [26]. У хворих із СТД визначається затримка дозрівання епіфізарної зони росту хряща, що клінічно виражається подовженням трубчастих костей. Досить інформативними ознаками СТД є порушення співвідношення довжини 1-го та 2-го пальців стопи з утворенням сандалеподібної щілини. Причиною деформацій грудної клітини є неповноцінність реберних хрящів (дистрофічні зміни хондроцитів, порушення формування хондринових волокон - відсутність пучковости, поява поздовжніх щілин, потоншення).
При біохімічному дослідженні основної речовини реберних хрящів виявляються порушення сульфатування глікозаміногліканів у вигляді зниження вмісту хондроїтін-4- і хондроїтін-6-сульфатів, виразне зростання кількості глікопротеїдів, поява колагену III і IV типів, які за нормою в хрящі не зустрічаються, а також надлишок і перерозподіл у клітинному матриксі колагену V типу.
Характерним симптомом системної неповноцінності СТ є гіпермобільність суглобів [13, 52]. За даними Г. А. Суханової , вона виявляється більш ніж у половини осіб із СТД. Поширеність цієї патології в європейській популяції становить у середньому 10 %, в африканській і азіатській - 15-25 %. K. Andren і N. Borglin встановили зв'язок гіпермобільності суглобів з дією статевих гормонів.
Вважається, що у жінок гіпермобільность суглобів спостерігається частіше та виражена більше, ніж у чоловіків. С. С. Попова у своїх роботах показала, що в жінок з некласичними формами вродженої дисфункції кори наднирників, яка посідає провідний стан серед причин гіперандрогенії у жінок і формування полікістозу яєчників, характерними фенотиповими особливостями є ознаки СТД. З них найчастіше зустрічається, як виявилося, гіпермобільність суглобів.
Рухливість суглобів досягає максимуму у віці 3 років і зустрічається приблизно у 50% дітей цього віку, а надалі, у міру дозрівання сполучної тканини, відбувається зменшення її частоти. Розвиток гіпермобільності суглобів пов'язують зі зміною структури та співвідношенням різних типів колагену. N. D. Light при дослідженні типів колагену шкіри у пацієнтів з гіпермобільністю суглобів виявив достовірне збільшення співвідношення типів колагену III/III+I у порівнянні з контролем. При електронному мікроскопіюванні була відзначена значна зміна кількості «товстих» (зменшення) і «тонких» (збільшення) колагенових волокон, а також підвищення вмісту основної речовини, еластину та фіброцитів у ретикулярній стромі.
Як наслідок слабості зв'язкового апарата розвивається гіперлаксація у всіх або декількох суглобах, формується неправильна осанка, кіфоз, гіперлордоз, дископатія, сколіоз, плоскостопість та ін. У хворих із синдромом гіпермобільності суглобів відзначено підвищену експресію антигену В35 системи HLA, що спостерігається так само при пролапсі мітрального клапана, пієлонефриті, гломерулонефриті.
Зміна шкіри при СТД проявляється тонкою, просвічуваною, вразливоюранимою, надмірно сухою або гіпереластичною шкірою, келоїдними рубцями, які нагадують «папіросний папір»; стриями. Характерні пігментні та депігментовані плями, ластовиння, численні родимки. На ліктях, колінах, п'ятах видно псевдопухлини, на гомілках - дрібні вузлики під шкірою, підшкірні сферули (аномалії росту жирової тканини). Можуть бути перетинки між пальцями, деформація вушних раковин, епікант.
При СТД надзвичайно поширена патологія органів зору. Вона представлена міопією різного ступеня виразності, гіпертелоризмом, гіпер- і гіпометропією, епікантдислокацією кришталика, відшаруванням сітківки, дегенеративними змінами на очному дні, збільшенням довжини очного яблука, плоскою роговицею, блакитними склерами, косоокістю. У дослідженнях О. Д. Остроумової в 43-65,5 % випадків відзначено сполучення пролапсу мітрального клапана та міопії.
Досить частий клінічний прояв СТД - варикозне розширення вен нижніх кінцівок. При морфологічному дослідженні цих вен у початковій стадії патологічного процесу відзначається скупчення фібронектину на внутрішній оболонці судин. Надалі ушкоджуються міоцити, еластичні волокна, зростає кількість колагену I типу з наступним виходом у фіброз.
Г. А. Суханова у своїх дослідженнях повідомляє про геморагічний синдром у хворих із СТД. Вона спостерігала повторні носові кровотечі, петехіально-плямисті елементи висипки, тривалі та/або рясні менструації, підвищену кровотечу ясен, тривалі кровотечі при порізах. З. С. Баркаган вважає, що геморагічний синдром служить одним із проявів мезенхімальних аномалій і, отже, може розглядатися в рамках синдрому СТД. У літературі наводяться також дані про порушення в різних ланках системи гемостазу при цьому синдромі: зміни агрегаційної функції тромбоцитів, зниження активності фактора Віллебранда в плазмі, порушення кінцевого етапу згортування крові, що є можливою причиною тромбофілічних станів у пацієнтів із СТД.
За даними В. М. Яковлєва із співавт. функціональний стан СТ тісно взаємозалежний з діяльністю імунної системи. Так, при клініко-інструментальному обстеженні пацієнтів із СТД установлено, що при фенотипово більш яскравих формах дисплазії СТ частіше розвиваються супутні захворювання внутрішніх органів. Порушення в імунній системі хворих виявляються імунодефіцитом, що на клінічному рівні проявляється рецидивними та хронічними запальними процесами верхніх дихальних шляхів, ЛОР-органів, легенів, нирок і шкіри. Антигени гістосумісності I і II класів не тільки асоційовані із схильністю до розвитку СТД і з особливостями її клінічних проявів, але й визначають наявність відхилень в імунній системі, що вказує на важливу роль генетичних факторів у патогенезі цих захворювань [49].
Самостійна клінічна значимість патології СТД підтверджується даними про високу частоту нейровегетивних розладів, змін ЦНС (енурез, дефекти мови, вегето-судинна дистонія) і психіки у осіб із цими захворюваннями. О. Б. Степура виділяє психологічні особливості пацієнтів - зниження самооцінки, рівня домагань, емоційної стійкості, підвищений рівень тривожності, аутизація. У 8,9 % випадків акцентуація особистості зустрічається за шизоїдним типом. Це, однак, не означає, що зміни психіки обов'язково супроводжують СТД. Не можна також виключити, що в значній частині випадків зміни особистості носять вторинний характер і пов'язані з формуванням «комплексу неповноцінності» у осіб, які мають ті або інші фізичні дефекти.
Наявність усіх вище перерахованих зовнішніх особливостей у пацієнта свідчить про дисплазії СТ і, чим більше фенотипових ознак виявляється при огляді, тим більше підстав очікувати патологічні зміни і у внутрішніх органах. Проаналізовані нами літературні дані дозволяють затвердити, що існує досить тісний взаємозв'язок між числом зовнішніх фенотипових СТД і частотою виявлення аналогічних змін внутрішніх органів.
При дисплазії СТ широко поширені та досить різноманітні серцево-судинні зміни. З 1990 р. у класифікації захворювань серцево-судинної системи Нью-Йоркської асоціації кардіологів виділено синдром дисплазії СТ серця. Цей синдром включає: пролапси клапанів серця, аномально розташовані хорди лівого шлуночка, аневризми міжпредсерцевої перегородки та синусів Вальсальви, розширення кореня аорти та легеневої артерії, бікуспідальну аорту. Дисплазія СТ серця розглядається як ізольований синдром, який включає в себе симптомокомплекс кардіальних і екстракардіальних проявів.
Ряд дослідників указують на тісний зв'язок пролапса мітрального клапана з певними антигенами гістосумісності. Більшість авторів відзначили при ньому достовірне збільшення частоти зустрічальності антигену HLA B35 (45,2-72,5 %). Крім того, при синдромі дисплазії СТ серця виявлені підвищена частота та інші антигени гістосумісності (HLA A3,В12, В27).
Бронхолегеневі ураження при СТД характеризуються як генетично обумовлені порушення архітектоніки легеневої тканини, що ведуть (при підвищеній розтяжності та зниженій еластичності) до формування прогресуючої та бульозної емфіземи, полікістозу легенів, спонтанного пневмотораксу, бронхоектазів, гіпоплазії легенів. При гістологічному дослідженні виявляються деструкція міжальвеолярних перегородок і апікальні булли. Нерідко зустрічаються трахеобронхомегалія, трахеобронхомаляція, трахеобронхіальна дискінезія, викликані патологією обміну СТ.
Абу-Джабаль Гасан у своїх спостереженнях відзначає високу частоту фенотипових маркерів СТД у дітей з патологією гастродуоденальної зони, провідне місце серед яких посідає синдром гіпермобільності суглобів. Для цього контингенту хворих характерна також висока частота мікроаномалій розвитку, насамперед жовчного міхура, властиві нервово-емоційні розлади, астено-невротичні реакції. Дослідження О. В. Васильєвої показали, що для 64,7 % хворих із проявами екзокринної недостатності підшлункової залози і симптомами панкреатиту характерна наявність фенотипових ознак СТД.
Крім того, такі пацієнти схильні до запальних захворювань слизових оболонок шлунково-кишкового тракту (ШКТ), які часто ускладнюються перфораціями та кровотечами. Т. Н. Лебеденко, М. Д. Шестакова у своїх роботах відзначають значні клінічні ознаки у хворих із хронічним гастритом на тлі СТД із переважними ознаками слабко вираженої шлункової диспепсії. Репаративні процеси у цих пацієнтів характеризуються переважним утворенням колагену III типу з розвитком ліпоматозу власної пластинки та атрофії слизової оболонки.
Підсумовуючи вищевикладені дані про стани судинної, бронхолегеневої системи та органів ШКТ у хворих із проявами СТД, можна зробити припущення про наявність ендотеліальної дисфункції та порушень фолатного циклу при патології СТ. Це питання ще не висвітлене у світовій літературі, про що свідчить відсутність подібних відомостей у сучасних монографіях всесвітньо відомих метаболістів, таких як G. F. Hoffman, W. L. Nyhan, J. Zschocke. Тому, на наш погляд, перспективними є подальші дослідження, спрямовані на пошук біохімічних змін при патології СТ і вивчення їхнього впливу на стан всіх органів і систем організму.
Відомо, що СТД часто поєднується з патологією нирок. Приблизно в кожного третього пацієнта із проявами СТД спостерігаються симптоми, характерні для ураження сечовивідної системи: часте сечовипускання, почуття неповного спорожнювання сечового міхура, ніктурія, енурез, симптоми дизметаболічної нефропатії, а при поглибленому обстеженні виявляється: полікістоз, дивертикульоз сечового міхура, нефроптоз, атонія чашечно-мискової системи, подвоєння нирки та/або сечовивідних шляхів.
При ангіографічному дослідженні судин нирок у хворих із СТД нерідко спостерігається ураження артерій середнього та дрібного калібру - множинні великі аневризми ниркових судин з високим ризиком розвитку вазоренальної гіпертензії. При проведенні повного нефрологічного обстеження дітей, які мають 5 і більше фенотипових ознак СТД, захворювання нирок виявляється у 3 % дітей, а поєднання високої стигматизації з патологією органів сечової системи в сімейному анамнезі свідчить про захворювання нирок у дитини у 90 % випадків.
Частіше при нефропатіях зустрічається високе (готичне) піднебіння, розширене перенісся. При дисплазіях ниркової тканини та при спадковому нефриті часто відзначаються аномалії будови вушних раковин, епікант, кісткові аномалії, досить характерна варусна деформація мізинця. Ступінь виразності генетично детермінованих порушень онтогенезу залежить від ступеня пенетрантності та експресивності відповідних генів, а виразність уроджених порушень обумовлюється силою та строками мутагенного впливу.
Уроджена неспроможність СТ може бути діагностована вже на етапі фізікального обстеження хворого при комплексній оцінці фенотипових маркерів її дисплазії. За даними В. А. Таболіна та Н. П. Шабалова для діагностики СТД критичною кількістю ознак є наявність 6 і більше стигм дисембріогенеза.
При обстеженні хворого необхідно враховувати не тільки число фенотипових проявів, але також ступінь їхньої виразності та клінічну значимість. Для скринінг-діагностики СТД (на етапі клініко-анамнестичного обстеження) застосовані критерії Т. Мілковська-Димитрової і А. Каркашова. Вони виділяють головні та другорядні фенотипові ознаки СТД. До головних ознак відносяться: плоскостопість, розширення вен, готичне піднебіння, гіпермобільність суглобів, патологія органа зору, деформації грудної клітини та хребта, збільшена розтяжність і дряблість шкіри, довгі тонкі пальці. Другорядні ознаки це: аномалії вушних раковин і зубів, минущі суглобні болі, вивихи та підвивихи суглобів, синдактилія та ін.
Легка (1 ступінь) СТД діагностується при наявності двох головних ознак, середня (2 ступінь) - при 3 головних і 2-3 другорядних або 3-4 головних і 1-2 другорядних. Важка (3 ступінь) визначається при наявності 5 головних і 3 другорядних ознак.
У діагностиці СТД мають значення біохімічні методи дослідження, які дозволяють оцінити стан обміну СТ, уточнити діагноз, прогнозувати перебіг захворювання та судити про ефективність реабілітаційної терапії. Найбільш інформативним є визначення рівня оксипроліна та глікозоаміногліканів (ГАГ) у добовій сечі, лізина, проліна, оксипроліна в сироватці крові.
Генетичні дефекти синтезу колагену приводять до зменшення його поперечних зв'язків та зростанню кількості легкорозчинних фракцій. Саме тому у хворих з вродженою дисплазією СТ відзначається достовірне підвищення оксипроліну в добовій сечі, виразність якого корелює з тяжкістю патологічного процесу. За даними Т. І. Кадуріної, непрямим маркером гіперкатаболізму колагену можна вважати підвищений вміст гідроксипроліну, лізину та проліну в крові, зростання рівня яких корелює з підвищенням кількості оксипроліну в добовій сечі.
Про катаболізм міжклітинної речовини судять і по величині екскреції ГАГ. У хворих з різними клінічними варіантами СТД спостерігається підвищене їхнє виведення із сечею.
З огляду на наявність характерних змін у співвідношенні колагенів різних типів і порушення структури колагенового волокна при СТД, заключним етапом діагностики патології СТ є молекулярне підтвердження діагнозу СТД. Типування колагену проводиться методом непрямої імунофлюоресценції по L. A. Sternberg за допомогою поліклональних антитіл до фібронектину та колагену I, III, IV, V і інших типів. Сучасною та перспективною є ДНК-діагностика СТД, яка припускає застосування молекулярних методів виявлення конкретних генних мутацій для кожної нозологічної форми патології СТ.
З огляду на те, що більшість біохімічних і молекулярно-генетичних методів діагностики СТД трудомісткі та вимагають дорогого устаткування, для проведення скринінгового обстеження пацієнтів з ознаками патології СТ необхідний системний генетичний підхід, який включає проведення соматогенетичного дослідження із синдромологічним аналізом, а також клініко-генеалогічний аналіз родоводів пробандів. Такий підхід дозволяє вчасно діагностувати СТД у пацієнта та розробити план додаткового обстеження для індивідуального зіставлення клінічного та біохімічного фенотипу кожного хворого, а також рішення питання про доцільність проведення йому підтверджувальної молекулярної діагностики.
Уважне вивчення зовнішніх фенотипових ознак СТД, а також зіставлення їх з біохімічними характеристиками та функціональним станом внутрішніх органів дозволяє прогнозувати плин основного захворювання, розробити індивідуальну тактику ведення пацієнта для проведення адекватної патогенетичної терапії, реабілітації та профілактики ускладнень.
Синдром Елерса-Данлоса (СЕД) включає групу спадкових захворювань СТ, фенотипова варіабельність яких обумовлена генетичною гетерогенністю. Частковий клінічний опис цього синдрому вперше було зроблено ще в 1657 р. голландським хірургом Д. ван Мекреном із замальовкою хворого. Докладний опис клінічних ознак складений в 1901 р. дерматологом Е. Елерсом й істотно доповнений в 1908 р. Х. А. Данло, за ім'ям яких і названо цей синдром первинного ураження СТ.
Дані про частоту СЕД варіюють від 1:5000 до 1:560000, при цьому деякі автори допускають, що цей синдром є найпоширенішим серед спадкових захворювань СТ. Однак, з питаннями діагностики, тактики ведення, профілактики ускладнень і реабілітації пацієнтів із СЕД у більшості випадків практикуючі лікарі недостатньо ознайомлені.
Різноманіття клінічних проявів СЕД призвело до створення безлічі його класифікацій, жодна з яких на сьогоднішній день не є досконалою. У різні періоди вивчення даного синдрому застосовувалися різні класифікації, згідно яким виділяли від 3 до 11 типів синдрому. Донедавна за клініко-генетичними характеристиками СЕД підрозділяли на 11 типів:
«Важкий» тип, класична форма (МІМ: 130000);
«М'який» тип (МІМ: 130010);
Гіпермобільний синдром (МІМ: 130020);
«Артеріальний» тип (МІМ: 255360);
СЕД 5-го типу (МІМ: 305200);
«Око-кіфосколіотичний» тип (МІМ: 225400);
«Артрохалазисний» тип (МІМ: 130060);
«Періодонтитний» (МІМ: 130080);
Потиличного «рогу» синдром (МІМ: 304150);
«Дисфібринонектинемічнй» тип (МІМ: 225310);
Сімейна гіпермобільність суглобів (МІМ: 147900).
Для кожного типу синдрому описані основні клінічні прояви та визначено ген, який кодує біохімічний дефект.
Необхідно, однак, відзначити, що зазначені типи синдрому не вважаються остаточно встановленими. У міру уточнення етіології захворювання спостерігається тенденція до подальшого дроблення синдрому шляхом виділення додаткових підтипів. Наприклад, виявлено чотири підтипи СЕД 4 ( 4-А; 4-В; 4-С; 4-D), два підтипи СЕД 6 (6-А зі зміненою активністю лізілгідроксілази та 6-В з нормальним рівнем даного ферменту). Пропонується виділення чотирьох підтипів СЕД 7 (7-A1; 7-А2; 7-В; 7-С). І навпаки, результати молекулярних досліджень дозволили об'єднати 1 і 2 типи синдрому в один і розглядати їх як алельні варіанти.
Водночас Beighton і співавт., провівши перегляд нозологічних типів синдрому, запропонували утриматися від надмірної деталізації та виділити тільки 6 специфічних варіантів захворювання: "класичний" (СЕД 1 і 2), "гіпермобільний" (СЕД 3), "судинний" (СЕД 4), "кіфосколіотичний" (СЕД 6), "артрохалазисний" (СЕД 7-А; 7-В) з різкою гіпермобільністю та вродженими вивихами суглобів, а також "шкірний" (СЕД 7-С), для якого характерна виражена ламкість шкіри [61]. Інші варіанти автори пропонують називати неспецифічними варіантами СЕД. У дану групу, певно, можуть бути також віднесені СЕД неспецифічний аутосомно-домінантний (MIM: 130090) і аутосомно-рецесивний (MIM: 225320), а також прогероїдна форма СЕД (MIM: 130070), обумовлена дефіцитом 4-β-галактозілтрансферази (ген картований на 5q35.1-q35.3).
Таким чином, у міру накопичення молекулярно-генетичних даних виникла необхідність і можливість переглянути колишні варіанти підрозділу СЕД, і в 1997 р. була запропонована сучасна класифікація, яка включає 6 типів синдрому. Дана класифікація на сьогоднішній день максимально наближена до етіологічних факторів.
Класичний тип успадковується за аутосомно-домінантним типом. Основними діагностичними критеріями є: гіперрозтяжність шкіри, характерні атрофічні рубці, гіпермобільність суглобів. Додаткові діагностичні критерії: гладкість, бархатистість шкіри, підшкірні псевдопухлини, підшкірні вузлики, ускладнення гіпермобільності суглобів (розтягання, вивихи та підвивихи, плоскостопість), м'язова гіпотонія та затримка моторного розвитку, легке виникнення екхімозів, прояви підвищеної розтяжності та крихкості тканин (грижі, цервікальна недостатність, опущення внутрішніх органів та ін.), хірургічні ускладнення (наприклад, післяопераційні грижі, розбіжність швів, кровотечі під час і після операцій). Крім того, діагностичну цінність має наявність родичів з аналогічними клінічними проявами. Зміни з боку шкіри варіюють за ступенем складності (важкі, середньої важкості, помірні). Повторні підвивихи найбільш характерні для плечових, скронево-нижньощелепних суглобів і надколінків. Частою скаргою є підвищена стомлюваність.
Незважаючи на те, що класичний тип становить близько 90% серед випадків СЕД всіх типів, етіологія цього захворювання донині остаточно не встановлена. За останні роки з'явилися повідомлення про виявлення мутацій у генах колагену V типу, що грає важливу роль у фібрилогенезі та регуляції діаметра колагену I типу.
Крім мутацій у генах колагену, причиною захворювання, за даними A. C. Peeters et al. (2004), можуть бути мутації в генах білків екстраклітинного матрикса, серед яких - декорин, люмікан, тенасцин-Х. Таким чином, на сьогодні можна констатувати генетичну гетерогенність класичного типу СЕД.
Гіпермобільний тип успадковується по аутосомно-домінантному типу. Основними діагностичними критеріями є: прояви з боку шкіри (гіперрозтяжність і/або гладка, бархатиста шкіра) і генералізована гіпермобільність суглобів. Додаткові діагностичні критерії: повторні вивихи суглобів, хронічні болі в суглобах або кінцівках; виявлення сімейних випадків. Відповідно до колишньої класифікації, цей підтип називався "доброякісний гіпермобільний тип", що підкреслює домінування вираженої гіпермобільності суглобів при відсутності кістякових і відносно незначних шкірних проявів [180, 183]. Шкірна розтяжність варіабільна, атрофічні рубці не характерні. Болі в суглобах і м'язах починаються рано, носять хронічний і виснажливий характер. Молекулярний дефект, який лежить в основі цього типу, на сьогоднішній день остаточно невідомий. Передбачається залучення I і III колагену.
Васкулярний тип успадковується за аутосомно-домінантним типом. Основними діагностичними критеріями є тонка, прозора шкіра, розриви стінки артерій, кишковнику та/або матки, великі крововиливи. Додаткові діагностичні критерії: гіпермобільність дрібних суглобів, розрив сухожиль і м'язів, клишоногість, варикозне розширення вен з ранньою маніфестацією, артеріовенозні каротидно-кавернозні фістули, пневмоторакс / пневмогідроторакс, атрофія ясневого краю; позитивний сімейний анамнез, випадки раптової смерті у близьких родичів (багато пацієнтів не доживають до 50 років через розрив артерій або, що рідше, кишковника).
Наявність двох та більше головних критеріїв з великою ймовірністю вказує на діагноз васкулярного типу СЕД та є показанням для лабораторної діагностики. Нерідко відзначається характерний фенотип (вузький ніс, тонкі губи, натягнута шкіра, запалі щоки та екзофтальм, обумовлений, в основному, зниженням підшкірно-жирового шару). Треба відзначити, що такий фенотип характерний для дорослих хворих, а у дітей він практично не виражений. Гіпермобільність суглобів звичайно обмежена суглобами пальців.
Максимальна частота спонтанних артеріальних розривів припадає на третю-четверту декади життя, але вони можуть виникати і раніше. Найчастіше залучені артерії середнього калібру. Вагітність і пологи можуть ускладнюватися розривом матки та кровотечами, а також розривом піхви та промежини. Саме артеріальні розриви є найчастішою причиною раптової смерті. Тому рекомендуються як діагностичні заходи, по можливості, неінвазивні процедури. При цьому типі СЕД порівняно добре вивчені зміни на молекулярно-білковому рівні. Етіологічним фактором є мутації в гені колагену III типу.
Кіфосколіотичний тип успадковується за аутосомно-рецесивним типом. Основними діагностичними критеріями є генералізована гіпермобільність суглобів, виражена м'язова гіпотонія при народженні, яка прогресує, сколіоз, кіфоз, крихкість склер, розриви очного яблука. Додаткові діагностичні критерії: крихкість тканин, іноді атрофічні рубці, схильність до крововиливів, розриви артерій, марфаноподібний фенотип, мікрокорнеа, рентгенографічно виражена остеопенія, позитивний сімейний анамнез (у тому числі хворі сибсі).
Наявність трьох основних критеріїв є підставою для припущення діагнозу та вимагає лабораторного обстеження. При цьому м'язова гіпотонія може бути дуже вираженою та обумовлює затримку моторного розвитку. Виражений сколіоз призводить до того, що в другій-третій декаді життя хворі втрачають здатність пересуватися самостійно. Крихкість тканин ока є причиною розриву очного яблука при найменшій травмі. Згідно з останніми даними, важкі очні ускладнення зустрічаються набагато рідше, ніж передбачалося раніше.
При цьому типі СЕД дефект у синтезі колагену полягає в зміні ферменту лізилгідроксілази, яка каталізує гідроксілірування бічних лізинових ланцюгів, необхідних для перехресних зв'язків між сусідніми колагеновими молекулами при формуванні потрійної спіралі.
Артрохалазисний тип успадковується за аутосомно-домінантним типом. Основними діагностичними критеріями є важка генералізована гіпермобільність суглобів з повторними вивихами (підвивихами), вроджений вивих стегна. Додаткові критерії: гіперрозтяжність шкіри, крихкість тканин, атрофічні рубці, часті крововиливи, м'язова гіпотонія, кіфосколіоз, рентгенологічне виявляємо помірковано виражена остеопенія. Вроджений вивих стегна був присутній у всіх хворих з біохімічним підтвердженням діагнозу. Низький ріст є наслідком вираженого кіфосколіозу та/або вивиху стегна.
Причиною даного варіанта СЕД є мутації в генах α1 і α2 ланцюгів колагену I типу, які виникають відповідно при А и В підтипах. У результаті структурної мутації гена колагена стає неможливим функціонування N-термінальної пептидази, що призводить до аномального фібрилогенезу колагену I типу.
Шкірний тип (дерматоспараксис) успадковується по Х-зчепленому типу. Основними діагностичними критеріями є виражена крихкість шкіри, надлишкова шкіра, яка відшаровується. Додаткові діагностичні критерії: м'яка, тістоподібна консистенція шкіри, легке утворення крововиливів, передчасний розрив плодових оболонок, грижі (пупкові, пахові), як правило великих розмірів. Крихкість шкіри та утворення крововиливів яскраво виражені, у той час як загоєння ран відбувається звичайно, без атрофічних рубців. Надлишок шкіри на обличчі приводить до фенотипу, що нагадує «cutis laxa».
Назва цього підтипу була взята за аналогією зі захворюваннями у великої рогатої худоби, овець та інших тварин з аналогічною зміною шкіри. До теперішнього часу описана невелика кількість пацієнтів, і клінічний спектр, певне, може розширюватися. Захворювання пов'язане з мутаціями в гені, що кодує N-термінальну пептидазу проколагену I, і призводить до дефіциту даного ферменту та порушенню фібрилогенезу.
Поряд з перерахованими вище типами СЕД існує безліч стертих і перехідних форм даного синдрому, які істотно змінюють клініку та прогноз асоційованих із СТД захворювань внутрішніх органів.
Різні автори, що займаються проблемою клінічного поліморфізму СТД указують у своїх роботах на те, що біля половини осіб, які направляються на консультацію з метою уточнення діагнозу, не мають чітких клінічно-генеалогічних критеріїв, характерних для певної диференційованої патології обміну СТ. У ряді випадків набір фенотипових ознак у таких пацієнтів з недиференційованими формами СТД нагадує прояви СЕД. У подібних ситуаціях прийнято говорити про «елерсоподібний» фенотип і розцінювати його як фенокопію зазначеного захворювання.
При недиференційованій СТД із елерсоподібним фенотипом (ЕПФ) відзначається сполучення ознак генералізованої дисплазії СТ з тенденцією до гіперрозтяжності шкіри та різним ступенем виразності гіпермобільності суглобів.
Для оцінки ступеня гіпермобільності суглобів прийнято використовувати метод Бейтона, заснований на виявленні таких ознак: пасивне тильне згинання мізинця кистей рук на 90º; пасивне згинання першого пальця кістей рук у бік передпліччя при згинанні в променевозап'ястковому суглобі; перерозгинання обох ліктьових суглобів більш ніж на 10º; перерозгинання обох колінних суглобів більш ніж на 10º; при нахилі вперед при фіксованих колінних суглобах долоні пацієнтів цілком торкаються підлоги. При цьому наявність кожного з перших чотирьох ознак оцінюється в 1 бал при виявленні їх з кожного боку. Чим більше виражена гіпермобільність суглобів, тим важче загальний стан таких пацієнтів.
Пацієнти з ЕПФ при недиференційованій СТД становлять групу високого ризику з поліорганною патологією. На наш погляд, вони повинні по можливості спостерігатися та лікуватися у одного лікаря-генетика з залученням вузьких фахівців тільки як консультантів, що дає можливість проведення оптимальної реабілітації кожного хворого.
Перспективним напрямком у вивченні різних форм СЕД є розробка саме недиференційованих СТД зі ЕПФ для пошуку порушеної біохімічної ланки та первинного генного дефекту, що дасть можливість провести своєчасну патогенетичну терапію та запобігти розвитку життєвонебезпечних ускладнень.
Підбиваючи підсумки аналізу сучасних джерел літератури, у яких описуються різні прояви СТД і клінічні варіанти СЕД, можна зробити висновок про клінічний поліморфізм і генетичну гетерогенність таких нозологічних форм. З огляду на різноманіття клінічних проявів і поширеність даної патології в популяції, хворі з ознаками СТД взагалі та СЕД зокрема потрапляють у поле зору лікарів усіх без винятку спеціальностей.
Багаторічний досвід медико-генетичного консультування хворих із СТД дозволив нам висловити припущення, що кожен новий прояв елерсоподібного фенотипу може стати клінічним варіантом СЕД при умові поглибленого клінічного, біохімічного та молекулярного дослідження хворого. Тому необхідно інтегрувати сучасні молекулярно-генетичні знання у клінічну медицину та у повсякденну роботу не тільки лікарів-генетиків, а й терапевтів, педіатрів, хірургів, акушерів-гінекологів, офтальмологів, травматологів, ортопедів, дерматологів.
Розуміння того, що діагностика описаних на сьогоднішній день клінічних типів СЕД - лише верхівка айсберга, під якою ховається величезний шар недиференційованих форм СТД, дозволить нам знайти нові фенотипові варіанти СЕД. А зіставлення клінічних і біохімічних фенотипів пацієнтів зі СЕД допоможе глибше вивчити етіопатогенез даного захворювання, удосконалити існуючі методи його діагностики та лікування.
Індивідуальний підхід до кожного пацієнта з елерсоподібними фенотиповими особливостями є невід'ємною складовою трьохрівневої профілактики спадкової патології при проведенні медико-генетичного консультування сімей з патологією СТ.
Клінічне обстеження пробандів було зосереджено на пошуку симптомів, що дозволяли встановити діагноз СЕД. Для визначення кардинальних симптомів була використана розроблена нами схема обстеження хворих з ознаками СЕД (рис. 1).
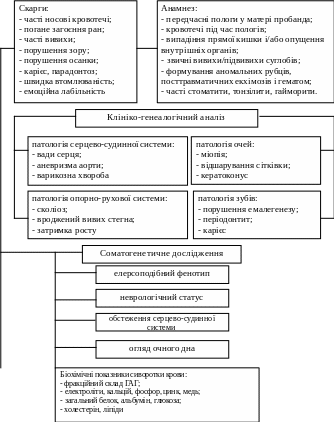

Рис. 1. Cхема обстеження пацієнтів із СЕД
П

 ошук
малих аномалій розвитку (МАР) ми вважали
важливим діагностичним етапом, тому що
він дозволив розпізнати стани, які
пов’язані з метаболічними порушеннями
при СЕД. Оскільки
за даними аналізу архівного матеріалу
серед 7502 хворих із СТД у 6398 (85,3%) були
запідозрені метаболічні розлади, які
супроводжувались МАР, в процесі виконання
роботи для диференційної діагностики
ми використовували сучасні методи
дослідження на тлі глибокого
соматогенетичного дослідження. Такий
підхід був прийнятий нами з метою
розвитку так званої клінічної
протеогеномики, за якою стоїть система
дослідження пробанда водночас
лікарем-клініцистом, генетиком, біохіміком
та молекулярним генетиком.
ошук
малих аномалій розвитку (МАР) ми вважали
важливим діагностичним етапом, тому що
він дозволив розпізнати стани, які
пов’язані з метаболічними порушеннями
при СЕД. Оскільки
за даними аналізу архівного матеріалу
серед 7502 хворих із СТД у 6398 (85,3%) були
запідозрені метаболічні розлади, які
супроводжувались МАР, в процесі виконання
роботи для диференційної діагностики
ми використовували сучасні методи
дослідження на тлі глибокого
соматогенетичного дослідження. Такий
підхід був прийнятий нами з метою
розвитку так званої клінічної
протеогеномики, за якою стоїть система
дослідження пробанда водночас
лікарем-клініцистом, генетиком, біохіміком
та молекулярним генетиком.
Класичними ознаками СЕД вважались гіперрозтяжність шкіри, гіпермобільність суглобів і симптоми геморагічного діатезу. Нам удалося підтвердити, що у хворих із СЕД існує значна кількіть спільних ознак для всіх типів синдрому і вони зустрічаються з різною частотою при тому, чи іншому його варіанті. Разом з тим нам вдалося знайти варіанти СЕД, при яких сполучення ознак було незвичайним.
Для диференційної діагностики типів СЕД у відповідності до даних літератури нами були розроблені диференційно-діагностичні критерії, які відображені в схемі обстеження (рис. 1), виділені основні та додаткові діагностичні критерії та біохімічні показники. Використання розробленої нами схеми дозволило уточнити діагноз і виділити, грунтуючись на клініко-лабораторних даних, різні клінічні варіанти СЕД (табл. 1) у відповідності із існуючою новою класифікацією 1997 року.
Таблиця 1
