3)Концентрация
При постоянной конц фермента [Е] мере увеличения конц субстрата [S] скорость реакции растёт,но опред предела.Сначала скорость реакции возрастает пропорционально росту концентрации субстрата.Однако затем эта пропорциональность нарушается,скорость реакции достигает макс уровня и уже перестаёт зависеть от конц субстрата.Конц субстрата наз насыщенной конц субстрата.Явление насыщения фермента субстратом-важная особенность ферментативных реакций,несвойственная обычным хим реакциям.
Седьмой вопрос
Влияние активаторов и ингибиторов на активность ферментов
Действие ферментов можно усилить или ослабить некоторыми хим реагентами.Вещества, в присутствии кот акт ферментов возрастает, называют активаторами;вещества, снижающие каталитическое действие ферментов, называют ингибиторами.Важнейшими природными активаторами явл аминокислота цистеини восс глутатион -- цистеинсодержащий трипептид.Они содержат свободную сульфгидрильную группу (SH-группу) и поэтому способны активировать тиоловые ферменты, в активном центре кот тоже содержатся сульфгидрильная группа. При окислении этой группы тиоловые ферменты теряют свое каталитическое действие и вновь начинают работать после ее восс. Активирующее воздействие восс глутатиона и цистеина состоит в том, что они, окисляясь, способны восстанавливать SH-группу тиоловых ферментов
Активирующее воздействие на многие ферменты могут оказывать также ионы различных металлов в низких конц, такие как Mg, Са, Zn,Fe,Cu,Mn,Co.
Ингибиторы специфически замедляют либо полностью прекращают протекание ферментативной реакции. Если снижение или полная потеря каталитической акт фермента вызваны какими-либо денатурирующими воздействиями, например большими конц солей тяжелых металлов, трихлоруксуснои кислотой, орг растворителями и др., то такой процесс называют не ингибированием, а инактивацией фермента, т. к. такого рода воздействия подавляют действие любого фермента и, следовательно, явл неспецифическими.
В завис от прочности соед ингибитора с ферментом различ 2 вида ингибирования:обрат и необрат.
При необрат ингибитор ков связ с функциональной группой молекулы фермента,необходимой для проявл его кат акт,в результате чего фермент перестаёт функционировать.Необрат ингибирование вызывает диизопропилфторфосфат (ДФФ),кот может необрат связ с ОН-гр а/к серина,располаг в акт центре сериновых ферментов.
К сериновым ферментам принадлежат трипсин,катализ гидролиз ППЦ,а также ацетилхолинэстераза,катализ гидролитический распад ацетилхолина на холин и уксусную к-ту.
Другим примеромтакого ингибирования явл действие НСN и её солей.Ингиб воздействие этих веществ объясн тем,что СN-гр необрат связ с ме блок акт цент ферментов.
При обрат ингиб ингибитор связывается с ферментом менее прочно,чем при необрат.2 типа ингиб(конкурентное и неконкурентное).Конкур ингиб заключ в том,что ингибитор обратимо связ с тем же местом в молекуле фермента,с кот обычно связ субстрат,т.е. с акт центром.
При неконкур ингиб ингибитор связывается с ферментом не в области акт центра,где связ субстрат,а на некотором удалении от него,в др области молекулы фермента.При этом образ кат неактивный комплекс фермент-ингибитор.Важным примером неконк ингиб явл аллостерическое ингиб .Белковые молекулы этих ферментов обладают 4 ст,т.е. состоят из нескольких субъединиц,что обуслав пространс обособленность друг от друга акт и аллостерических центров.
Восьмой вопрос
Согласно международной классификации вьделяют следующие 6 классов ферментов:
1. Оксидоредуктазы.К этому классу принадлежат все ферменты, катализирующие ок-восс реакции.
2.Трансферазы.Ферменты этого класса катализируют реакции переноса той или иной хим группы от одного соединения (донора группы) к другому соединению (акцептору этой группы).
3. Гидролазы.Эти ферменты катализируют реакции гидролитического расщепления различных хим связей: сложноэфирных,гликозидных, пептидных и иных.
4. Лиазы.Ферменты этого класса катализируют реакции негидролитического расщепления различных хим связей, сопровождающиеся образованием двойной связи, или, наоборот, реакции присоединения определенной хим группы к двойной связи.
5. Изомеразы.Эти ферменты катализируют геометрические или структурные изменении в пределах одной молекулы.
6. Лигазы (синтетазы). К этому классу принадлежат ферменты, катализирующие реакции соединения друг с другом двух молекул, сопряженные с гидролизом высокоэнергетической связи в молекуле АТФ или другого нуклеозидтрифосфата.
Следовательно, на реакции, катализируемые ферментами данного класса, клетка затрачивает энергию, аккумулированную в АТФ или других НТФ.
Рассматривая далее каталитическое действие важнейших представителей определённых классов ферментов, можно убедиться в том, что большинство ферментов обладает ярко выраженной специфичностью, т. е. действует только на один субстрат или на опред хим связи в различных субстратах.
Девятый вопрос
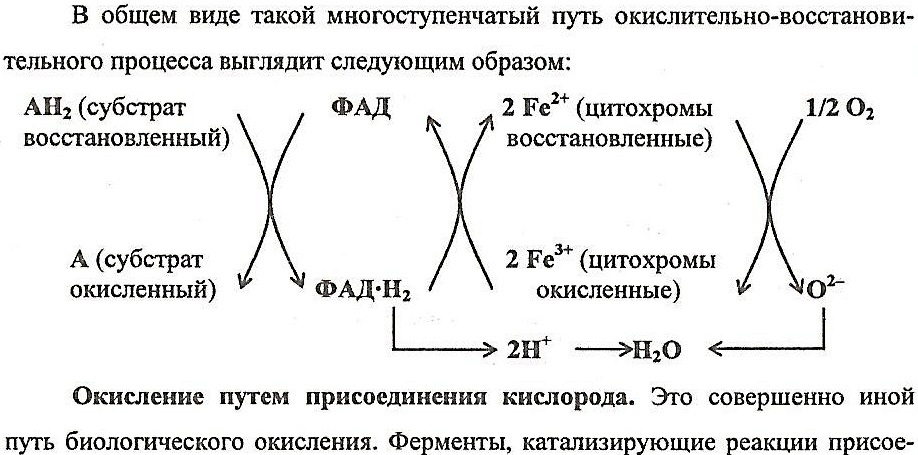
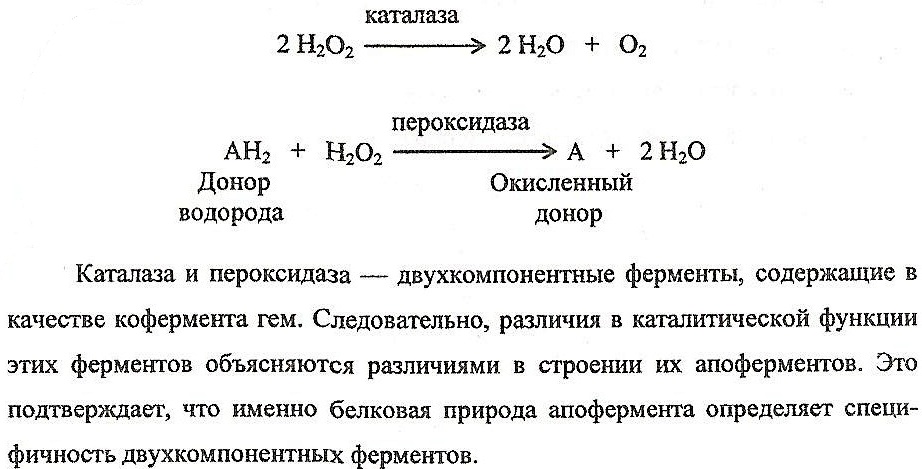
Оксидоредуктазы-это ферменты, катализирующие ок-восс реакции, происходящие в клетке. Окисление веществ в орг может осуществляться тремя разными путями:отнятием водорода либо
электронов и присоединением кислорода.









Десятый вопрос
Трансферазы-это ферменты, катализирующие реакции переноса хим группировок от одного соединения к другому. В зависимости от хим природы и строения переносимых групп ферменты этого класса подразделяют на более мелкие классификационные единицы, среди которых наиболее важными явл фосфотрансферазы, аминотрансферазы, гликозилтрансферазы,ацилтрансферазы.


Одиннадцатый вопрос
Гидролазы -это ферменты, катализирующие реакции гидролиза, заключающиеся в расщеплении сложных орг соединений с присоединением молекулы воды по месту расщепляемой связи. К этому классу относятся многие ферменты, имеющие промышленное значение, а также большинство пищеварительных ферментов.


Двенадцатый вопрос
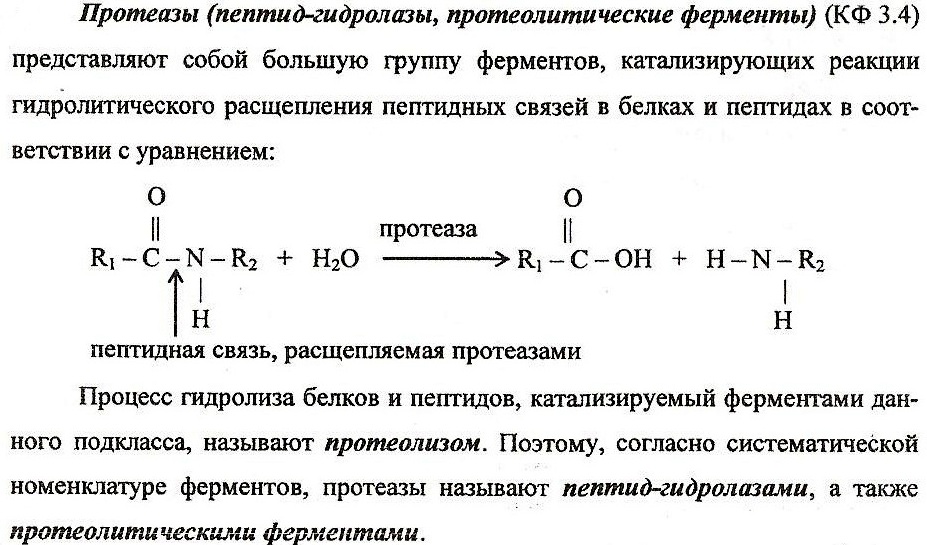
Пептидгидролазы,специфичность их действия.








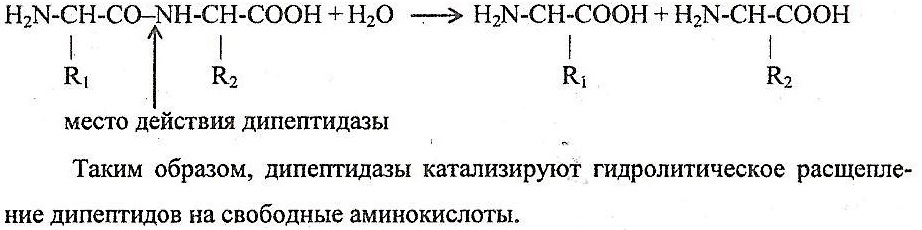
Тринадцатый вопрос
Лиазы -это ферменты, катализирующие отщепление от субстратов негидролитическим путем какой-либо хим группы с образованием двойной связи (или присоединение группы к двойной связи). Наиболее важными ферментами данного класса являются пируватдекарбоксилаза, альдолаза, енолаза и некоторые другие.



Четырнадцатый вопрос
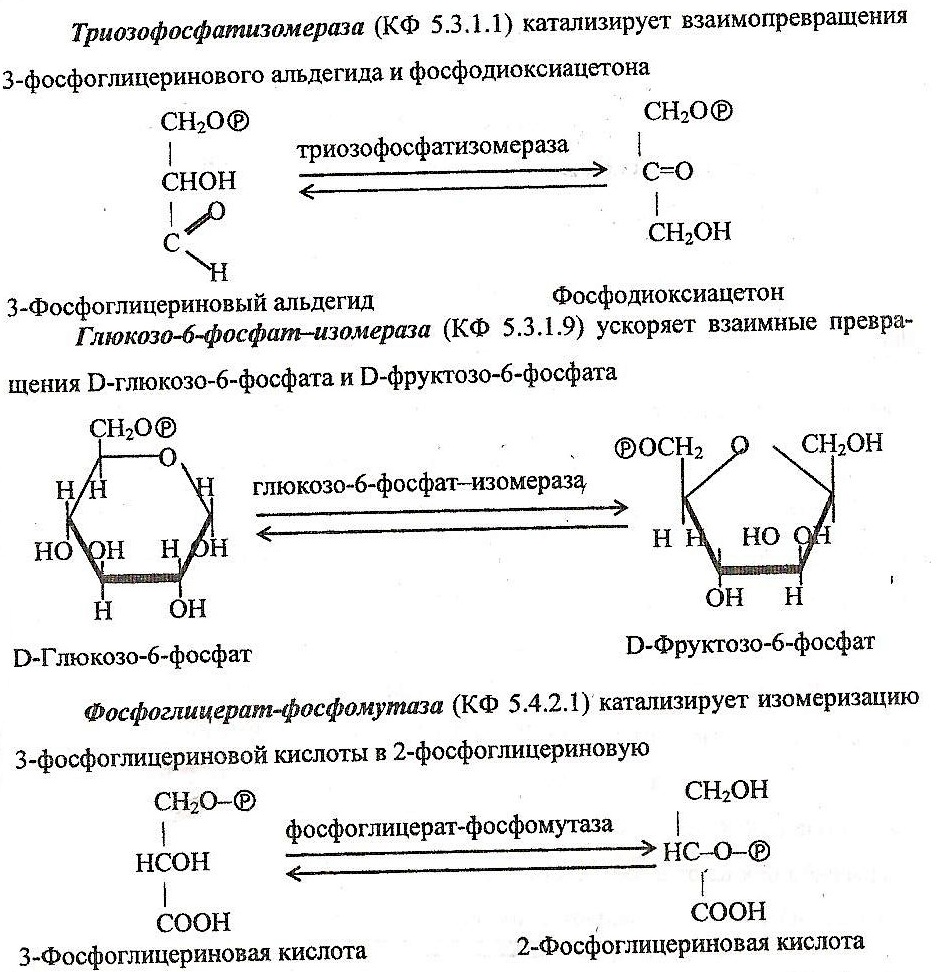
Изомеразы -- это ферменты, катализирующие изомеризацию различных орг соединений. Среди ферментов этого класса важнейшее значение имеют триозофосфатизомераза, глюкоза-6-фосфат -изомераза и фосфоглицератфосфомутаза.