
- •Краткие теоретические сведения
- •Ход выполнения работы:
- •Процессы, происходящие при титровании
- •Оформление экспериментальных данных:
- •Оформление результатов работы
- •Контрольные вопросы:
- •Лабораторный практикум (вода)
- •Краткие теоретические сведения
- •Фотометрический анализ
- •Основной закон светопоглощения (закон Ламберта-Бугера-Бера)
- •Графическое отображение закона Ламберта-Бугера-Бера
- •Ход выполнения работы:
- •2) Количественный фотоколориметрический метод
- •Оформление результатов работы
- •Контрольные вопросы:
- •Ход выполнения работы
- •Построение калибровочного графика
- •Краткие теоретические сведения:
- •Ход выполнения работы:
- •Оформление экспериментальных данных
- •Краткие теоретические сведения:
- •Ход выполнения работы:
- •Оформление экспериментальных данных
- •Краткие теоретические сведения
- •Ход выполнения работы
- •Построение градуировочного графика.
- •Контрольные вопросы:
Оформление экспериментальных данных:
Данные титрования записать в таблицу:
1-е титрование |
Na2B4O7 взято мл |
H2SO4 мл |
2-е титрование |
мл |
мл |
Среднее значение |
мл |
мл |
Если расхождение результатов титрования не превышает 0,1 мл, то по ним определить среднее значение.
Оформление результатов работы
Определить титр и нормальность раствора H2SO4:
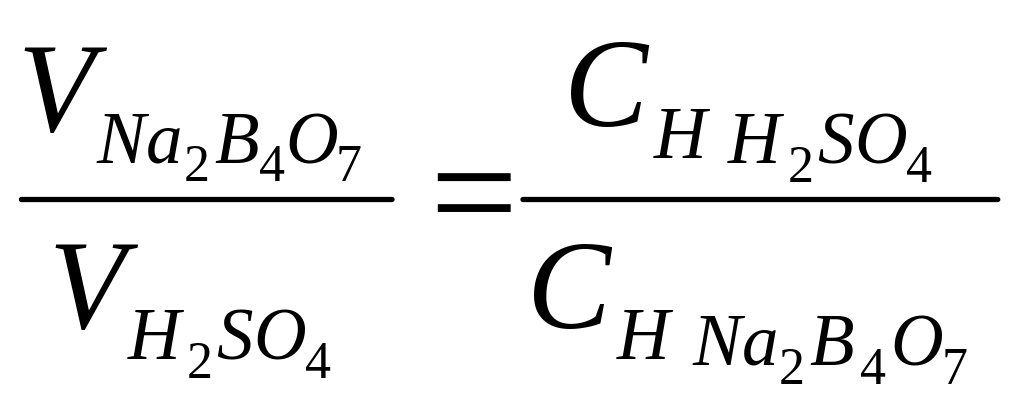

![]()
Контрольные вопросы:
Что называется раствором?
Растворитель, растворенное вещество.
Концентрации (массовые и объемные).
Какая зависимость существует между нормальной концентрацией и титром?
Какая зависимость существует между нормальными концентрациями и объемами реагирующих растворов?
Как можно рассчитать Мeq кислоты, основания, соли?
Лабораторный практикум (вода)
Лабораторная работа № 2
Тема: «Определение ионов аммония в природных и сточных водах»
Цель работы: научится определять наличие и количество ионов аммония с использованием реактива Несслера в природных и сточных водах
Посуда |
Реактивы |
Приборы |
|
|
|
Краткие теоретические сведения
Азот является основным компонентом живых организмов. В природе, например, в водоемах, постоянно происходит круговорот соединений азота при участии различных процессов, которые происходят как в живой так и неживой природе. Вследствие, распада белков в водоемах образуется аммиак, который со временем окисляется до нитратов и нитритов.
Фермы по разведению животных являются самыми большими загрязнителями природных вод аммиаком, нитратами - поверхностные воды с полей и сточные воды производств. Они создают благоприятные условия для развития сине-зеленых водорослей и нарушают функционирование природных экосистем.
Наличие тех или иных соединений азота позволяет установить время поступления загрязненных аммиачными соединениями сточных вод:
наличие аммиака и отсутствие нитритов и нитратов – загрязнение произошло недавно
одновременное наличие и восстановленных, и окисленных соединений азота- со времени сброса сточных вод прошло некоторое время
высокое содержание нитритов и особенно нитратов при отсутствии соединений аммония – загрязнение произошло давно – аммиак успел окислится׃
![]()
Содержание нитратов в питьевой воде не должен превышать 45мг/л, нитритов – 3,3 мг/л.
Метод определения аммиака основан на образовании комплексного соединения йодида оксимеркуратаммония (йодистая соль основания Милона, которая при не большом содержании ионов аммония и измерении светопоглощения при λ=425 нм у кюветах с толщиной слоя 20 см) красно-коричневого цвета во время взаимодействия иона аммония или аммиака с реактивом Несслера:
Hg
/ \
![]() [О
NH2]I
+ 7 KI
+ 2H2O
[О
NH2]I
+ 7 KI
+ 2H2O
\ /
Hg
Методика является нормативной для аналитической службы органов государственного контроля по уровню загрязнения и состоянием окружающей среды Украины.
Определению ионов аммония могут мешать различные факторы, способы нейтрализации их воздействия приведены в таблице 1.
Таблица 1
№ п/п |
Мешающий фактор |
Способ нейтрализации фактора |
1 |
Амины, хлорамины, ацетон, альдегиды, спирты, фенолы |
Предварительная отгонка пробы, при рН=7,4 с добавлением фосфатного буферного раствора |
2 |
Жесткость воды |
Добавлением раствора 0,5-1,0см3 сегнетовой соли либо трилона Б на 50см3 пробы |
3 |
Взвешенные вещества |
Центрифугированием либо фильтрованием |
4 |
Железо, сульфиды |
Добавлением 1см3 тиосульфата цинка (100г/дм3) |
5 |
Хлор |
Добавлением тиосульфата (3,5г/дм3) или метаарсенита натрия (1г/дм3) |
6 |
Гуминовые вещества |
Отгонкой либо добавлением 2-5см3 суспензии гидроксида алюминия в 300см3 пробы |
Анализ отобранной пробы выполняют либо в день отбора проб или консервируют с добавлением 1см3 концентрированной серной кислоты на 1 дм3. Консервированную пробу можно сохранять двое суток.
Для выполнения измерений готовят такие растворы:
основной раствор аммония хлористого: 2,9650 г аммония хлористого растворяют в мерной колбе 1000 см3 в небольшом объеме воды, а потом доводят до метки. 1см3 содержит 1мг аммоний-ионов. Приготовленный раствор сохраняют в банке с темного стекла на протяжении одного года. Или используют стандартный образец (СО);
рабочий раствор аммония хлористого: 1 см3 основного раствора или СО доводят до метки безаммиачной водой в мерной колбе до 200 см3.
Калий-натрий виннокислый (сегнетовая соль): 50г калия-натрия виннокислого 4-водного растворяют в бидистиллированной воде, доводят до 100 см3 и добавляют 0,2-0,5 см3 реактива Несслера
