
2 курс / Гистология / Быков общий
.pdfСуправитальная окраска основана па связывании некоторых красителей с компонентами живых клеток, извлеченных из организма. Так, митохондрии окрашиваются янусом зеленым, нервные клетки и волокна - метиленовыми синим, фагосомы нейтрофильных гранулоцитов крови - нейтральным красным. Незрелые эритроциты (ретикулоциты) идентифицируются путем сунравитальной окраски крезиловым или метиленовым синим (см. главу 7). Метод применяется в специальных целях.
КУЛЬТИВИРОВАНИЕ КЛЕТОК, ТКАНЕЙ И ОРГАНОВ ВНЕ ОРГАНИЗМА
Культивирование (эксплантация) клеток, тканей и органов (или их фрагментов) в условиях in vitro производится для изучения вли-ния различных факторов на их рост, дифференцировку, синтетические, секреторные и др. процессы. Совместное культивирование эксплантатов различных тканей или эмбриональных зачатков (кокулыпивирование) позволяет проанализировать их индуцирующее влияние друг на друга.
Культивирование осуществляется в специальных приборах в условиях стерильности с использованием питательных сред и определенного газового состава. Для получения культуры клеток их предварительно выделяют из органов и тканей путем дозированной ферментной и механической обработки. Клетки в культуре могут находиться во взвешенном состоянии (суспензионные культуры) или расти по твердому субстрату. Первичные культуры клеток, непосредственно выделенных из различных органов, обычно гибнут в течение нескольких недель. Получены стандартные перевиваемые (стабильные) линии генетически измененных (трансформированных) клеток (например, клеточная линия HeLa), которые могут сохраняться при пересеве в течение десятков лет ч служить удобным объектом для цитологических, фармакологических, юксикологических, микробиологических и др. исследований. В последние годы клеточные и тканевые культуры стали использовать в целях биотехнологии и биоинженерии (получение клеточного или тканевого материала для трансплантации, синтез биологически активных веществ, продукция моноклональных антител и др).
МЕТОДЫ МИКРОСКОПИРОВАНИЯ ГИСТОЛОГИЧЕСКИХ И ЦИТОЛОГИЧЕСКИХ ПРЕПАРАТОВ
Световая микроскопия
Стандартная световая микроскопия осуществляется путем изучения препарата в проходящем свете. Свет в световом (светооптичес-
- 21 -
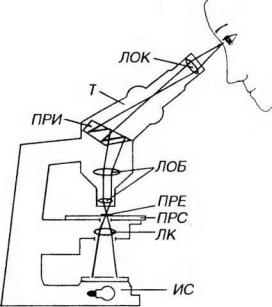
ком) микроскопе собирается в конденсоре и пропускается через препарат, изменяясь за счет различия свойств образующих его структур. Далее свет входит в объектив, в фокальной плоскости которого формируется изображение. Окуляр увеличивает это изображение и направляет его в глаз (рис. 2-3). Главными характеристиками микроскопа служат его разрешающая способность и увеличение.
Рис. 2-3. Оптическая схема светового микроскопа. Свет, излучаемый источником света (ИС) - обычно электрической лампочкой - собирается линзами конденсора (ЛК) и пропускается через изучаемый препарат (ПРЕ), который располагается на предметном столике (ПРС). Далее свет направляется
влинзы объектива (ЛОБ), в фокальной плоскости которого формируется изображение. Преломляясь в призме (ПРИ), лучи через тубус (Т) проецируются
влинзы окуляра (ЛОК), который увеличивает сформированное изображение и направляет его в глаз.
Разрешающая способность (разрешение) микроскопа - минимальное расстояние между двумя точками объекта, которые видны в нем раздельно. Она обусловливается объективом и зависит от длины световой волны (повышаясь с ее укорочением) и от особой оптической характеристики объектива - числовой апертуры (увеличиваясь по мере ее нарастания). Теоретические разрешение светового микроскопа составляет 0.2 мкм, практически оно обычно равно 0.4 мкм.
- 22 -
Увеличение микроскопа оценивается соотношением между линейными размерами создаваемого им изображения изучаемого объекта и самого объекта. Оно рассчитывается как произведение увеличений объектива и окуляра. Общее увеличение светооптического микроскопа равно 2000-2500, однако полезное увеличение (способствующее выявле¬нию деталей объекта) составляет до 1500 раз.
Специальные методы световой микроскопии
Темнопольная микроскопия (микроскопия в темном поле) основана на использовании специального конденсора, обеспечивающего освещение препарата косыми лучами, не попадающими в объектив. В отсутствие объектов поле зрения представляется темным. При их наличии часть света отражается ими в объектив, в результате чего их изображение обнаруживается в окуляре. Метод позволяет выявить структуры, размеры которых лежат за пределами разрешения светового микроскопа. Он может использоваться для изучения живых клеток.
Фазово-контрастная микроскопия основана на неодинаковом изменении фазы световых лучей при их прохождении через различные структуры изучаемого объекта. Фазово-контрастный микроскоп преобразует незаметные для человеческого глаза фазовые различия в амплитудные. Этот метод дает возможность непосредственного изучения живых клеток без их фиксации и окрашивания.
Поляризационная микроскопия используется для изучения структур, обладающих свойствами анизотропии или двойного лучепреломления. В поляризационном микроскопе на объект направляется поляризованный пучок света, который в дальнейшем пропускается через анализатор (расположенный между объективом и окуляром) - устройство, определяющее отклонения плоскости поляризации света вследствие его прохождения через объект. Тем самым выявляется закономерное пространственное расположение молекул в объекте.
Ультрафиолетовая микроскопия связана с освещением изучаемого объекта ультрафиолетовыми лучами, которые избирательно поглощаются его структурными компонентами. Благодаря тому, что ультрафиолетовые лучи имеют более короткую длину волны по сравнению лучами видимой части спектра, разрешающая способность микроскопа повышается примерно вдвое. Невидимое изображение в ультрафиолетовом микроскопе преобразуется в видимое с помощью люминесцентного экрана или других устройств.
- 23 -
Флюоресцентная (люминесцентная) микроскопия использует способность некоторых веществ излучать видимый свет при освещении объекта ультрафиолетовыми лучами (аутофлюоресценция). В некоторых случаях (например, при выявлении катехоламинов методом Фалька) флюоресценция возникает после предварительной химической обработки ткани. Применяют также флюоресцентные красители (флюорохромы), связывающиеся с различными структурами или веществами в клетках и межклеточном веществе. Так, акридиновый оранжевый, связываясь с ДНК, даст свечение желто-зеленого цвета, а с РНК - красно-оранжевого. Флюоресцентные красители связывают (конъюгируют) со специфическими антителами для выявления соответствующих антигенов в тканях иммуногистохимическими методами (см. выше).
КОЛИЧЕСТВЕННАЯ ОЦЕНКА КЛЕТОЧНЫХ И ТКАНЕВЫХ СТРУКТУР
Морфометрические методы
Морфометрические методы представляют собой совокупность приемов, позволяющих дать количественную оценку параметров клеточных и тканевых структур на гистологических или цитологических препаратах (или их фотографиях). Путем использования этих методов определяют такие параметры, как, например, диаметр, высоту, толщину, площадь сечения, количество объектов на единице площади, их форму и др. При морфометрии объектов на гистологических препаратах необходимо учитывать, что оцениваемые параметры относятся не к собственно тканевым компонентам, а к их сечениям на срезах. Морфометрические методы могут использоваться при изучении объектов не только под световым микроскопом, но и на электронномикроскопическом уровне (см.ниже).
Стереологические методы, в отличие от стандартных морфометрических, позволяют путем специальных приемов и расчетов определить истинные (трехмерные) параметры объектов (например, их относительный объем, содержание в единице объема и др.), исходя из оценки на срезах их линейных и плоскостных параметров.
Ручная морфометрия основана на проведении подсчетов визуально, непосредственно под микроскопом или на микрофотографиях с использованием линеек, сеток (в том числе в виде окулярных вставок) и других приспособлений.
Методы полуавтоматического и автоматического анализа изображения с применением компьютеров получили широкое распространение благодаря своей высокой производительности. Они позволяют
- 24 -
быстро количественно оценить большое число признаков на изучаемом препарате и по их совокупности идентифицировать различные структуры (например, типы клеток по распределению хроматина в их ядрах).
Приборные микроскопические методы для количественной оценки гистохимических и иммуногистохимических реакций
Цитофотометрия - количественный приборный метод, дающий возможность оценить содержание исследуемого вещества в структурных элементах тканей и клеток. Измерения производятся на специальном приборе - цитофотометре - путем оценки оптической плотности окрашенного продукта гистохимической реакции выявления изучаемого вещества в пределах определенной площади препарата (зонда) при длине световой волны, соответствующей максимуму поглощения использованного красителя. При измерении содержания ДНК полученные данные сопоставляют с результатами измерений в заведомо диплоидных клетках (например, в покоящихся лимфоцитах), что позволяет оценивать результаты в единицах плоидности.
Проточная цитометрия, или флоуцитометрия (от англ. flow поток) -
высокоэффективный приборный количественный метод оценки содержания веществ в клетках, находящихся в суспензиях.
Подготовка клеток к анализу заключается в их окрашивании с использованием флюоресцирующих красителей в цитохимических или иммуноцитохимических реакциях (см. выше). В последнем случае красители конъюгированы со специфическими антителами. При работе тканями их предварительно обрабатывают ферментами для разрушения межклеточных связей и получения клеточных суспензий.
Окраска клеток флюоресцирующими красителями используется для маркировки искомого вещества. Некоторые вещества можно непосредственно выявить путем цитохимической реакции с избирательно связывающимся с ними красителем (например, ДНК с помощью бромида (этидия). Для маркировки других веществ клетки обрабатывают спецефическими антителами, с которыми конъюгированы флюоресцирующие красители. При этом маркированные антитела связываются с соответствующими клеточными антигенами (веществами) в результате иммуноцитохимической реакции.
Проточный цитометр (флоу-цитометр) с высокой скоростью пропускает суспензию окрашенных клеток через узкую капиллярную трубку, освещенную лучом лазера. Уровень флюоресценции каждой клетки или ее ядра (соответствующий содержанию исследуемого вещес-
- 25 -
тва) последовательно регистрируется с помощью специальных детекторов со скоростью до нескольких десятков тысяч клеток в 1 мин. с построением соответствующих гистограмм (графиков распределения) содержания вещества. В некоторых случаях через капилляр пропускают неокрашенные клетки (форменные элементы крови) и оценивают распределение их размеров и формы.
Клеточная сортировка позволяет выделить клетки с определенными маркерными признаками (или их сочетанием) из клеточной суспензии. Процедура реализуется с использованием специального прибора - сортера (клеточного анализатора), работающего по принципу про-точного цитометра, но с возможностью формирования мелких капель, содержащих отдельные клетки, которые, в зависимости от наличия маркировочного сигнала, сортируются и направляются в различные контейнеры.
МЕТОДЫ ИЗУЧЕНИЯ ОГАНОВ, ТКАНЕЙ И КЛЕТОК ПОД ЭЛЕКТРОННЫМ МИКРОСКОПОМ
В настоящее время в научных исследованиях и клинической диагностике широкое применение нашли два метода электронной микроскопии - трансмиссионная (просвечивающая) электронная микроскопия и сканирующая (растровая) электронная микроскопия, использующие соответствующие микроскопы - ТЭМ (ПЭМ) и СЭМ (РЭМ).
ТРАНСМИССИОННАЯ ЭЛЕКТРОННАЯ МИКРОСКОПИЯ
Трансмиссионная (просвечивающая) электронная микроскопия
основана на использовании пучка электронов, излучаемого электронной пушкой внутри колонны микроскопа в условиях высокого ускоряющего напряжения (40-100 кВ) и глубокого вакуума (10-4 мм рт. ст.). Фокусировка пучка осуществляется электромагнитными линзами, играющими роль конденсора, объектива и проектора. После прохождения через изучаемый объект, помещенный в колонну и обладающий в различных своих участках неравномерной электронной плотностью, пучок электронов направляется на флюорецируюший экран и создает плоскостное изображение объекта, которое фотографируется на пластинку или пленку (рис. 2-4).
- 26 -
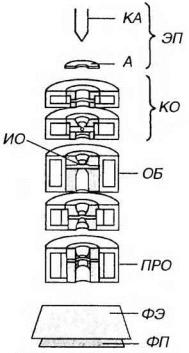
Рис. 2-4. Схема устройства трансмиссионного электронного микроскопа. пучок электронов излучается электронной пушкой (ЭП), включающей катод (КА) анод (А), фокусируется электромагнитными линзами конденсора (КО), объективе ОБ) и проектора (ПРО). После прохождения через изучаемый объект (ИО) пучок электронов направляется на флюоресцирующий экран (ФЭ), создавая изображение объекта, которое регистрируется на фотопластинке или фотопленке (ФП).
ТЭМ дает возможность изучения объектов, размеры которых лежат как в пределах разрешения светового микроскопа, так и далеко за ними вплоть до уровня макромолекул). Его разрешение теоретически достигает 0.002 им, однако практически составляет 0.2-0.5 им, а для большинства биологических объектов - 1-2 нм. Увеличение ТЭМ равно 100-1000 тыс. раз.
Высоковольтный ТЭМ (с ускоряющим напряжением до 1000 кВ) обеспечивает более высокую скорость движения электронов, которые глубже проникают в объект. Этот микроскоп дает очень высокое разрешение и позволяет использовать более толстые срезы (до нескольких микрометров).
- 27 -
Взятие и обработка материала для исследования в трансмиссионном электронном микроскопе
Взятие материала для электронно-микроскопического исследования осуществляется так же, как и для описанного выше гистологического. Однако кусочки ткани имеют очень мелкие размеры (обычно 1-2 мм); после извлечения они должны немедленно помещаться в фиксатор во избежание аутолитических изменений и высыхания.
Фиксация материала производится чаще всего глутаралъдегидом; предпочтительно использование перфузионного метода. Дополнительная фиксация (постфиксация) производится четырехокисью осмия, который одновременно окрашивает клеточные структуры.
Заливка материала осуществляется в нолимеризуюпшеся синтетические эпоксидные смолы.
Резка залитого материала производится на специальном приборе - ультратоме с помощью стеклянных или алмазных ножей. Толщина получаемых ультратонких срезов составляет 30-50 нм (необходимость получения очень тонких срезов обусловлена низкой проникающей способностью электронов).
Полутонкие срезы (толщиной 0.5-1 мкм), обычно изготовляют на ультратоме перед получением ультратонких срезов. Их окрашивают толуидиновым синим и изучают под светооптическим микроскопом для ориентировки в изучаемом объекте. Поскольку такие препараты по качеству значительно превосходят обычные, полученные путем резки на микротоме залитого в парафин материала, поэтому их нередко специально готовят для использования в исследованиях, выполняемых на уровне светового микроскопа.
Окрашивание (контрастирование) срезов выполняют с помощью солей тяжелых металлов (свинца, осмия, урана и др.), которые в раз-личной степени связываются с отдельными структурными компонентами, придавая им неодинаковую электронную плотность. Окрашенные ультра тонкие срезы помещают на металлическую сетку и изучают в ТЭМ.
СКАНИРУЮЩАЯ ЭЛЕКТРОННАЯ МИКРОСКОПИЯ
Сканирующая (растровая) электронная микроскопия основана на сканировании электронным пучком поверхности изучаемого объекта, что достигается благодаря его отклонению специальным устройством (дефлектором). Вторичные электроны, рассеиваемые или излучаемые поверхностью объекта, воспринимаются детектором и фокусируются на экране СЭМ, создавая ее трехмерное изображение (рис. 2-5). Разре-
- 28 -
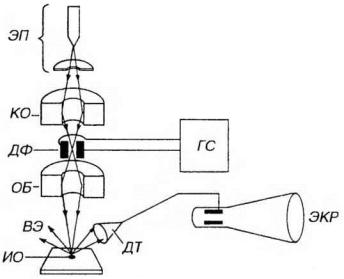
шение СЭМ ниже, чем ТЭМ и составляет около 3-10 нм, его увеличение равно 20 тыс. раз.
Обработка материала для исследования в СЭМ включает его фиксацию, высушивание и напыление на его поверхность металлов (золота, палладия или др.).
Рис. 2-5. Схема устройства сканирующего электронного микроскопа Пучок электронов, излучаемых электронной пушкой (ЭП), фокусируется электромагнитными линзами конденсора (КО) и объектива (ОБ). Он сканирует поверхность изучаемого объекта (ИО) благодаря его отклонению дефлектором (ДФ), который получает сигнал от генератора сканирования (ГС). Вторичные электроны (ВЭ), излучаемые поверхностью ИО, воспринимаются детектором (ДТ) и фокусируются на экране (ЭКР), создавая ее трехмерное изображение.
СПЕЦИАЛЬНЫЕ МЕТОДЫ ЭЛЕКТРОННОЙ МИКРОСКОПИИ
Электронно-микроскопическая цитохимия, электронномикроскопическая иммуноцитохимия и электронно-микроскопическая авторадиография представляют собой адаптацию соответствующих методов, начально разработанных для светооптической микроскопии, к использованию на электронно-микроскопическом уровне. Они позволяют выявлять различные вещества и изучал, процессы метаболизма на уровне отдельных клеток и их компонентов. Очевидно, что для выявле-
- 29 -
ния продуктов цитохимических реакций и маркеров, используемых в иммуноцитохимических реакциях, выполняемых на электронномикросконическом уровне, они должны обладать высокой электронной плотностью.
Электронно-микроскопический микроанализ (рентгеновский микроанализ) - метод, обеспечивающий выявление и количественную оценку содержания различных химических элементов в ультратонких или гистологических срезах, а также образцах, подготовленных для СЭМ. Основан на бомбардировке объекта узким пучком электронов, которая вызывает излучение им вторичных электронов и рентгеновских лучей. Последние улавливаются специальным детектором, который определяет их спектр, характерный для каждого химического элемента.
Методы замораживания-скалывания и замораживания-скалывания-
травления дают возможность изучения внутренней структуры мембран и поверхности мембранных структур клетки.
Метод замораживания-скалывания основан на быстром замораживании клеток в присутствии криопротектора при температуре жидкого азота (-196°С) и раскалывании в вакууме с помощью ножа. На поверхность скола, который часто проходит через гидрофобную середину билипидного слоя мембран, напыляют платину, органический материал удаляют, а полученный препарат (реплику) изучают под электронным микроскопом.
Метод замораживания-скалывания-травления используется для изучения наружной поверхности клеточных мембранных структур. В соответствии с этим методом, после быстрого замораживания и раскалывания блока производится его травление - сушка в вакууме для удаления воды. На протравленную поверхность напыляют платину и полученную реплику изучают под электронным микроскопом.
- 30 -
