
2 курс / Гистология / Быков общий
.pdfрующий фактор, циклины). Вместе с тем, имеется ряд факторов, обеспечивающих общий контроль активности деления клеток, к которым относятся протоонкогены и антионкогены.
Протоонкогены (от греч. protos - первый и onkos - опухоль) - группа генов-активаторов, контролирующих нормальное клеточное деление и дифференпировку. Продукты экспрессии этих генов (особые белки) воздействуют на разные механизмы регуляции деления клетки: на уровне активирующего сигнала, его рецептора в мембране, второго посредника или транскрипции. К настоящему времени идентифицировано более 50 протоонкогенов.
Активация функции протоонкогенов и развитие опухолей. Установлено,
что изменения структуры и усиление активности экспрессии протоонкогенов вызывает развитие опухолей (что определило их название). Повышение активности протоонкогенов может быть связано с изменениями строения ДНК (в результате мутаций), увеличением количества генов (генной амплификации) или их реаранжировкой, при которой гены размещаются вблизи активного промотора. Измененные мутацией, но активные формы протоонкогенов носят название онкогенов. Злокачественная трансформация клетки может возникнуть не только вследствие повышения активности протоонкогенов, но и в результате снижения активности другой группы генов, называемых антионкогенами.
Антионкогены - гены, продукты которых - супрессоры опухолевого роста - угнетают митотическую активность клеток. Из них наиболее подробно изучены гены RB (ретинобластомы), DCC, APC, WT1, NF1 и, особенно, ген р53.
Ген р53 - один из наиболее мощных и универсальных антионкогенов (естественный онкосупрессор) - обеспечивает поддержание стабильности генетического аппарата (благодаря чему его называют "охранителем" клеточного генома) и контролирует клеточный цикл. Его экспрессия, умеренная в нормальных условиях, резко усиливается при повреждении ДНК.
Активация гена р53 приводит к остановке клеточного цикла для репарации ДНК (см. рис. 3-23), в которой активное участие принимает продукт этого гена - белок р53 - благодаря способности связываться с поврежденным участком ДНК и регулировать восстановление его структуры. При тяжелых повреждениях, не устранимых путем репарации ДНК, р53 запускает программу апоптоза (см. ниже). Оба вида ре-
- 91 -
акций защищают организм от репликации и амплификации генетически поврежденного материала. Продукт гена р53 (белок р53) индуцирует синтез продуктов генов р21, р15 и р1б, которые блокируют фермента циклинзависимые киназы (СПК), обеспечивающие переход G1->S и прохождение других периодов клеточного цикла.
Инактивация функции антионкогенов и развитие опухолей. Потеря функции гена р53 (в результате мутации или делении) приводит к утрате контроля над клеточным циклом: клетки-мутанты продолжают активно пролиферировать, несмотря на повреждения ДНК. Выявлена четкая связь между утратой функции гена р53 и развитием более 50 видов злокачественных опухолей у человека. Так, изменения гена р53 обнаружены в 55-70% случаев рака лихого, в 25-30% - рака молочной железы. Опухши с потерей функции гена р53 характеризуются наиболее злокачественным течением. В некоторых видах опухолей (в 60% меланом и лейкозов, в 80% глиом) обнаруживаются изменения гена р16; описаны опухоли, связанные с дефектами гена р15. Клетки рака шейки матки часто содержат инактивированные гены RB и р53. Мутация гена RB обнаруживается при ретинобластоме, опухолях костей, мочевого пузыря, легкого и молочной железы. Деления гена DCC характерна для опухолей толстой и прямой кишки, АРС - для аденоматозного полипоза толстой кишки.
Факторы роста являются важными стимуляторами клеточного деления. Они представляю! собой белки, усиливающие митотическую активность в определенных тканях (тканях-мишенях). Их действие опосредуется специфическим рецепторами на плазмолемме клеток. К ним относятся фактор роста нервов (ФРН), эпидермальный фактор роста, (ЭФР), тромбоцитарный фактор роста (ТРФР), инсулиноподобные факторы роста (ИФР), фактор роста фибробластов (ФРФ), колониеатшулирующие факторы (КСФ) - стимуляторы отдельных этапов гематопоэза, интерлейкины (ИЛ) -1, -2 и -3. Список факторов роста постоянно расширяется. Высказывается предположение, что большинство типов клеток реагирует не на один специфический фактор роста, а на их комбинации. Некоторые факторы роста циркулируют в крови, но большинство действует в тканях локально (паракринно). Описаны также факторы, подавляющие клеточное деление.
Кейлоны (от греч. chalao - успокаивать) представляют собой класс гормоноподобных регуляторов, угнетающих клеточное размножение. Они являются полипептидами или гликопротеинами и обладают тканевой и меточной специфичностью. Кейлоны образуются всеми зрелыми дифференцированными клетками и локально воздействуют на незрелые
- 92 -
клетки этой же ткани, способные к делению. Они обеспечивают гомеостаз численности клеточной популяции, а их выделение контролируется механизмом отрицательной обратной связи. Уменьшение численности популяции клеток (например, потеря клеток эпидермиса при ранении или лейкоцитов при кровотечении) вызывает снижение ингибирующего воздествия кейлонов и подъем митотической активности в соответствующей ткани. Кейлоны участвуют в регуляции роста тканей, заживления ран, иммунных реакций и других процессах.
Блокирование клеточного цикла с целью задержки размножения быстро растущих раковых клеток лежит в основе действия ряда препаратов, используемых для лечения опухолей. К сожалению, эти препараты действуют также на нормальные клетки и оказывают на них вредное влияние - побочное действие препарата. Последнее особенно выражено в отношении быстро обновляющихся популяций, так как значительная часть их клеток находится в цикле. В наибольшей степени при введении противоопухолевых препаратов нарушается образование форменных элементов крови (с развитием анемии), а также клеток кишечного эпителия (с возможным возникновением его изъязвлений).
РЕАКЦИЯ КЛЕТОК НА СТРЕСС
На воздействие различных видов стресса (повышение температуры, угнетение энергетического обмена, заражение вирусами, нехватка кислорода или глюкозы, повреждение окислителями, химическими препаратами, тяжелыми металлами и др.) все клетки, в том числе клетки млекопитающих и человека, отвечают стереотипной реакцией, охватывающей ядерный аппарат и компоненты цитоплазмы. В основе этой реакции лежит резкое изменение характера экспрессии генов. Она проявляется усилением синтеза особой группы защитных стрессорных белков при подавлении продукции остальных.
Стрессорные белки первоначально были обнаружены при изучении реакции клетки на повышение температуры, поэтому их назвали белками теплового шока, или HSP (сокращение от англ. Heat Shock Proteins). В дальнейшем был установлен их универсальный характер. HSP представляют собой группу белков, важнейшим из которых является HSP70. Различные представители группы HSP действуют на уровне ядра и отдельных компонентов щттоплазмы и выполняют роль молекулярных спутников, обеспечивая сборку, поддержание нативной конформации (свертывание, развертывание и упаковку) других белков, их взаимодействие между собой и направленный транспорт. Они предот-
- 93 -
вращают агрегацию белков и их дальнейшее повреждение в условиях нарушенного метаболизма клетки, способствуют разборке и расщеплению возникших белковых агрегатов.
Повышенная экспрессия стрессорных белков защищает клетки от повреждений и препятствует развитию их гибели механизмом апоптоза (см. ниже). Предполагают, что известный эффект возрастания резистентности организма при лихорадке может быть связан с усиленной выработкой белков группы НБР в условиях повышенной температуры. Характерно, что экспрессия главного стрессорного белка, Н5Р70, резко снижается с возрастом. Опухолевые клетки часто экспрессируют повышенные уровни Н8Р70, который защищает их от гибели.
СТАРЕНИЕ И ГИБЕЛЬ КЛЕТОК
Старение клеток
После функционирования в течение определенного периода времени клетка гибнет, причем ее гибели часто предшествует период старения. У соматических клеток имеется запрограммированный предел возможности деления, причем их пролиферативный потенциал обратно пропорционален возрасту организма и прямо пропорционален максимальной продолжительности жизни индивидуумов данного вида. При старении клетка утрачивает способность к репликации ДНК и задерживается в G1-фазе клеточного цикла, переходя в G0-фазу; в отличие от нормальной покоящейся клетки на нее не действуют митогены.
Механизмы и смысл клеточного старения, как явления, остаются предметом дискуссии. Согласно одной гипотезе, клеточное старение - результат катастрофического накопления ошибок биосинтетических механизмов клетки, согласно другой - оно является способом защиты организма от рака путем ограничения возможностей роста клеток. Возможно, старение клеток служит механизмом стабилизации размеров взрослого организма.
Морфологические признаки старения и приближающейся гибели клетки включают уменьшение ее объема, редукцию большинства органелл, увеличение содержания крупных лизосом (нередко и элементов цитоскелета), накопление пигментных и жировых включений, нарастание проницаемости клеточных мембран, вакуолизация цитоплазмы и ядра.
- 94 -
Гибель клеток
Число клеток в организме, органах и тканях регулируется гомеостатическими механизмами и определяется динамическим равновесием между образованием клеток путем пролиферации и их гибелью. Поэтому гибель клеток, наряду с их размножением и дифференцировкой, является одним из ключевых процессов и факторов в обеспечении нормальной жизнедеятельности различных тканей. При гибели клеток могут наблюдаться два вида морфологических изменений, которые соответствуют различным механизмам ее развития - некроз и апоптоз.
Некроз (от греч. nekrosis - умирание) возникает под действием резко выраженных повреждающих факторов - перегревания (гипертермии), переохлаждения (гипотермии), недостатка кислорода (гипоксии), нарушения кровоснабжения (ишемии), метаболических ядов, химических препаратов, механической травмы и др. Некроз представляет собой "смерть в результате несчастного случая" и часто охватывает различные по численности группы клеток.
Структурно-функциональные изменения клеток при некрозе на начальных этапах его развития проявляются набуханием цитоплазмы и отдельных органелл (в особенности, митохондрий). Отмечается дисперсия рибосом, расширение цистерн ЭПС. Эти морфологические изменения обусловлены нарушением избирательной проницаемости плазмолеммы и развиваются в ответ на прекращение деятельности мембранных ионных насосов (из-за непосредственного повреждения мембраны или вследствие отсутствия необходимой энергии). Повышение концентращш Са2+ в гаалоилазме вызывает активацию связанных с мембраной фосфолииаз, которые разрушают мембранные фосфолипиды и вызывают обширные повреждения мембран. Разрушение клеточных структур резко ускоряется на поздних стадиях некроза после выделения гидролаз и других ферментов из поврежденных лизосом.
Изменения ядра при некрозе связаны с расщеплением ядерной ДНК лизосомальной ДНКазой на фрагменты различной длины (без ка-кой-либо закономерности). Первоначально гетерохроматин конденсируется в виде крупных глыбок под кариолеммой, однако он не образует четко очерченных скоплений полулунной формы, которые характерны для ядер клеток, подвергающихся апоптозу (см. ниже). В дальнейшем ядро уменьшается, уплотняется (явление кариопикноза - от греч. karyon - ядро и pycnosis - уплотнение греч.), распадается (подвергается кариорексису - от греч. karyon - ядро и rhexis - разрыв) и лизируется (явление кариолизиса - от греч. karyon - ядро и lysis - разрыв).
- 95 -
Поздние явления при некрозе включают разрыв ядерной оболочки, плазмолеммы и мембран органелл, разрушение и растворение ядра, утрату базофилии набухшей цитоплазмой. исчезновение клеточных граииц и распад клетки.
Для некроза, в отличие от апоптоза не являющегося активным процессом (см. ниже), не требуется продолжающейся синтетической активности клетки, он не сопровождается активацией пулей внутриклеточной сигнализации. Продукты распада клеток попадают в межклеточные пространства, привлекают лейкоциты и макрофаги, фагоцитирующие клеточный детрит. Фагоциты, в свою очередь, выделяют разнообразные вещества, которые обусловливают активацию и приток различных клеток вследствие хемотаксиса. Описанным образом развивается и в течение определенного времени поддерживается воспалительная реакция на продукты разрушения клеток при их некрозе.
Апоптоз - физиологическая (запрограммированная) гибель клеток.
Апоптоз (от греч. apotosis - листопад) - "смерть клетки в результате самоубийства (самоуничтожения)" - активный, генетически контролируемый процесс клеточной гибели, регулируемый внутренней программой, которая запускается внешними факторами. Развитие апоптоза индуцируется особыми генами (киллерными генами), которые обеспечивают синтез ряда веществ, обусловливающих разрушение клетки. Обнаружены также "гены-спасители", экспрессия которых противодействует развертыванию программы апоптоза (наиболее изученным ингибитором апоптоза служит ген bcl-2).
Апоптоз представляет собой энергоемкий процесс и сопровождается активацией сигнальных систем в клетке. Он обычно происходит асинхронно в отдельных клетках или мелких клеточных группах, разделенных численно превосходящими жизнеспособными клетками. Апоптоз наблюдается в различных тканях человека и животных в норме, патологии, эмбриональном развитии и у взрослого.
Сигналы, запускающие генетическую программу апоптоза, обладают специфичностью для клеток различных тканей. К наиболее общим индуцирующим сигналам относятся:
(1) Нарушение баланса регуляторных воздействий, поддерживаю пщх нормальную дифференцировку и функциональную активность клеток, например, вследствие дефицита стимулирующих факторов (гормонов, факторов роста, некоторых цитокинов), потери контакта с другими клетками или компонентами межклеточного вещества и др. К этой же категории сигналов, вероятно, относятся и те, что возникают в клетке при ее естественном старении;
- 96 -
(1)Воздействие физиологических активаторов (индукторов) апоптоза -
ФНО (фактора некроза опухолей), ИФНу (интерферона-у), ГФРР (трансформирующего фактора роста-β), молекулы Fas, глюкокортикоидов, некоторых интерлейкинов. Этот эффект тканеспецифичен: некоторые из указанных веществ в клетках одних тканей индуцируют апоптоз, тогда как в других являются его ингибиторами (факторами выживания);
(2)Воздействие разнообразных повреждающих физических и хими-ческих факторов (гипертермии, гипоксии, оксидантов, токсинов, ишемии, облучения) умеренные по интенсивности, которые при большей интенсивности приводят к развитою некроза. Причиной апоптоза обычно служат вызывемые действием указанных факторов неустранимые повреждения ДНК (см. выше) или резкие метаболические сдвиги;
(3)Некоторые инфекции, в особенности, вирусные.
Структурно-функциональные изменения клеток при апоптозе. На наиболее ранних этапах развития апоптоза до возникновения структурных изменений в клетках в их цитоплазме в течение латентного периода длительностью до 12 ч происходит синтез ферментов, которые необходимы для осуществления гибели /снетки. Эту стадию, однако, проходит большее число клеток, нежели погибает в конечном итоге, так как часть из них выживает благодаря "спасению" в результате активации особых "генов-спасителей" и действия специфических трофических факторов.
Наиболее ранним морфологическим проявлением апоптоза, выявляемым на электронно-микроскопическом уровне, служит утрата клетками специализированных структур на их поверхности (например, микроворсинок и межклеточных соединений), их отделение от соседних (рис. 3-24). Развитие апоптоза морфологически на светооптическом уровне также проявляется уплотнением ядра (в котором накапливаются крупные глыбки хроматина), конденсацией цитоплазмы, которая уплотняется, сморщивается и уменьшается в размерах (отчего аноптоз был назван также "сморщивающим некрозом" - shrinkage necrosis в англоязычной литературе). Уплотнение цитоплазмы приводит ко все более компактному расположению органелл, которые при апоитозе, в отличие от некроза, сохраняют свою целостность.
Изменения в ядре при апоптозе обусловлены активацией эндо-генной Са2 + - зависим ой эндонуклеазы, что приводит к упорядоченному расщеплению геномной ДНК в межнуклеосомных участках на отдельные нуклеосомные сегменты. Хроматин укладывается в ядре в виде крупных
полулуний, после чего ядро распадается на фрагменты,
- 97 -
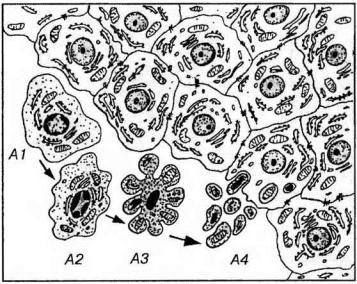
окруженные мембраной. Таким образом, в отличие от некроза, изменения ядра при апоптозе включают только кариопикноз и своеобразный кариорексис (без разрушения кариолеммы); кариолизис отсутствует.
Рис. 3-24. Морфологические изменения клеток при апоптозе. А1-А4 - клетки на последовательных стадиях апоптоза: А1 - начало апоптоза - утрата клеткой соединений с соседними интактными клетками и ее отделение от них; А2 - сжатие и уплотнение цитоплазмы и ядра, изменение формы клетки, распределение гетерохроматина в виде полулуний под кариолеммой; АЗ - нарастающее сжатие и уплотнение клетки, образование вздутий и выростов на ее поверхности, кариопикноз; А4 - распад клетки на фрагменты, окруженные плазмолеммой (апоптозные тела) и их фагоцитоз соседними интактными клетками.
При прогрессировании апоптоза нарастающая конденсация цитоплазмы сочетается с изменением формы клетки - она образует многочисленные крупные вздутия и выпячивания (поверхность клетки при этом как бы "вскипает"), а также "кратеры" (по-видимому, в участках слияния с плазмолеммой пузырьков, образующихся из цистерн грЭПС).
Образование и удаление апоптозных тел. Выпячивания, содержащие жизнеспособные органеллы, а также фрагменты ядра, отшнуровываются, формируя крупные окруженные мембраной фрагменты округлой или овальной формы - апоптозные тела. Образование апоптозных тел связано с преобразованиями цитоскелета: в частности, перешнуров-
- 98 -
ка цитоплазмы происходит с участием пучков актиновых микрофиламентов, разрушение которых блокирует ход апоптоза. Число и размеры образующихся клеточных фрагментов (апоптозных тел) варьируют в широких пределах и обычно тем значительнее, чем крупнее разрушающаяся клетка. В некоторых случаях клетка сморщивается целиком, превращаясь в одно сферическое апоптозное тело. Апоптозные тела быстро захватываются соседними метками посредством фагоцитоза и перевариваются ими. Некоторые тела могут разрушаться внеклеточно, другие же поглощаются местными фагоцитами. Нейтрофилы в фагоцитозе апоптозных тел не участвуют, воспалительная реакция отсутствует.
Процесс апоптоза развивается сравнительно быстро и обычно длится от нескольких минут до нескольких часов (в среднем, морфологически регистрируемые его стадии - от начала конденсации хроматина до полного переваривания апоптозных тел, занимают 1-3 ч).
Биохимические процессы при апоптозе. Сигнал, запускающий апоптоз,
инициирует внутриклеточную каталитическую реакцию, которая включает ряд этапов:
(1)передачу сигнала в клеточное ядро (обеспечивается различными механизмами, опосредованными ионами Са2+, фосфолипазой, тирозинкиназой, протеинкиназами А и С, цАМФ, сфингомиелином/перамидом и др. молекулами),
(2)активацию "летальных", или "киллерных" генов, ответственных за развертывание программы апоптоза,
(3)включение процессов транскрипции и трансляции (в результате которых осуществляется синтез апоптоз-специфических белков),
(4)активацию ряда ферментных систем, вызывающих необрати-мые изменения в ядре и цитоплазме клетки.
Деятельность указанных ферментных систем на заключительном этапе биохимических преобразований при апоптозе генетически контролируется и координируется, разворачиваясь в определенном порядке. К наиболее важным ферментным системам относят (в порядке их активации):
(1)цистеиновые протеазы семейства ICE (сокращенное название от англ.
IL-1 Converting Enzyme - фермент, конвертирующий ИЛ-1), представляющие собой протеолитическую каскадную аутокаталитическую систему, а также ICEподобные протеазы;
(2)гранзимы (сериновые протеазы);
(3)эндонуклеазы, обусловливающие фрагментацию ДНК в участках между нуклеосомами с формированием цепей ДНК стандартной длины.
-99 -
Эта реакция, развивающаяся еще до протеолиза пистонов и других ядерных белков, настолько специфична, что ее используют в качестве маркера процесса апоптоза.
Значение апоптоза в развитии тканей и механизмах тканевого гомеостаза у человека
Апоптоз - один из фундаментальных и универсальных биологических механизмов тканевого гомеостаза, поэтому он в той или иной степени связан со всеми проявлениями жизнедеятельности тканей в норме и патологии. Особенно значима роль апоптоза в следующих процессах: (1) эмбриональном развитии; (2) удалении стареющих клеток в зрелых тканях; (3) инволюции зрелых тканей; (4) иммунных реакциях; (5) реакциях тканей на действие повреждающих факторов; (6) развитии ряда дегенеративных и инфекционных заболеваний; (7) опухолевом росте.
(1)апоптоз в эмбриональном развитии. Внутриутробное развитие сопровождается избыточным образованием огромного количества клеток, которые своевременно уничтожаются путем апоптоза. Наиболее активно этот процесс происходит в нервной системе, где механизмом апоптоза гибнет до 4085% нейронов различных участков ЦНС. Важнейшие процессы гисто- и органогенеза тесно связаны с индукцией апоптоза, развивающегося в соответствии с генетически определенной пространственной и временной программой. Апоптоз охватывает клетки в четко определенных участках формирующихся зачатков и органов на конкретных этапах их развития.
Проявлениями апоптоза в ходе развития являются регрессия частей эмбриональных зачатков и закладок органов, изменения их формы, процессы образования просвета в трубчатых органах, инволюция провизорных органов, разрыв плодных оболочек и др. Одним из механизмов действия тератогенов (от греч. teras - урод и genes - происшедший) - веществ, обусловливающих развитие уродств, - как предполагают, служит изменение расположения зон, в которых в норме происходит гибель клеток механизмом апоптоза (нарушение программы апоптоза);
(2)апоптоз стареющих клеток в зрелых тканях. Длительность жизни клеток в различных тканях варьирует в очень широких пределах - от нескольких часов (для лейкоцитов) или нескольких суток (для клеток кишечного эпителия) до многих лет (для кардиомиоцитов и нейронов). Она определена генетически и связана с характером популяции, к которым принадлежат эти клетки (см. выше). Старение клеток, неза-
- 100 -
