
- •Пищевые белки как источник аминокислот. Качественный состав и биологическая ценность пищевых белков.
- •Динамическое состояние белков в организме. Нормы белка в питании. Азотистый баланс.
- •П ереваривание белков
- •Протеиназы пищеварительного тракта (общая характеристика и классификация)
- •Минеральный состав желудочного сока. Роль соляной кислоты в процессах пищеварения.
- •Виды кислотности желудочного сока, определение и расчет всех видов кислотности по михаэлису.
- •Проферменты пищеварительных протеиназ, механизм превращения в ферменты. Субстратная специфичность протеиназ.
- •Желудочные протеиназы: пепсин, гастриксин, их роль в переваривании белков.
- •Методы количественного определения пепсина.
- •Химический состав панкреатического и кишечного соков. Роль панкреатических и кишечных протеиназ в переваривании белков.
- •Б иохимические механизмы регуляции пищеварения, гормоны желудочно-кишечного тракта. Всасывание аминокислот.
- •Общая схема источников и путей расходования аминокислот в тканях. Экзогенный и эндогенный пул аминокислот
- •Трансаминирование, химизм. Трансаминазы, их специфичность. Роль витамина в6 в трансаминировании.
- •Биологическая роль реакций трансаминирования
- •Определение трансаминаз в сыворотке крови.
- •Д езаминирование аминокислот
- •Окислительное дезаминирование химизм. Роль глутаматдегидрогеназы. Биологическая роль окислительного дезаминирования аминокислоты.
- •Непрямое дезаминирование аминокислот, понятие, стадии, биологическое значение.
- •Декарбоксилирование аминокислот, химизм, ферменты, субстратная специфичность декарбоксилаз.
- •Биогенные амины, механизм образования, влияние на процессы метаболизма и физиологические функции. Окисление биогенных аминов.
- •Образование катехоламинов и гамк, функции аминов.
- •Понятие о свободном амином азоте. Принцип метода определения, диагностическое значение.
- •Трансметилирование. Метионин и s-аденозилметионин. Роль метионина в биосинтезе биологически важных соединений, в реакциях обезвреживания.
- •Тетрагидрофолиевая кислота и ее роль в синтезе и переносе одноуглеродных радикалов.
- •Обмен фенилаланина и тирозина. Пути превращения в норме.
- •Врожденные нарушения обмена ароматических аминокислот. Методы предупреждения, диагностики и лечения врожденных нарушений обмена фенилаланина и тирозина.
- •Наследственные нарушения обмена других аминокислот.
- •Понятие о скрининг-тестах.
- •Качественное открытие фенилпировиноградной и гомогентезиновой кислот.
- •Конечные продукты азотистого обмена. Основные источники аммиака в организме.
- •О безвреживание аммиака в месте образования в организме.
- •Транспортные формы обезвреженного аммиака
- •Г люкозо-аланиновый цикл
- •Синтез мочевины как путь окончательного обезвреживания аммиака. Химизм, ферменты, энергетика. Биологический смысл цикла мочевинообразования, связь с цтк.
- •Нарушения синтеза и выведения аммиака. Причины уремии.
- •Патология азотистого обмена.
- •Определение мочевины в сыворотке крови. Диагностическое значение.
- •Креатин и креатинин. Количественное определение креатинина, роль, диагностическое значение.
- •Образования аммонийных солей
Минеральный состав желудочного сока. Роль соляной кислоты в процессах пищеварения.
В желудочном соке в норме присутствует свободная соляная кислота
Функции соляной кислоты
активация пепсиногена
создание рН-оптимума для пепсина (1,5-2,5)
бактерицидное действие
денатурирует белки
регулирует работу привратника и стимулирует выработку секретина в кишечнике
активирует всасывание железа
обеспечивает всасывание витамина В12 (участвует в синтезе белкового фактора Кастла – антианемического)

МЕХАНИЗМ СЕКРЕЦИИ СОЛЯНОЙ КИСЛОТЫ.
Основная пищеварительная функция желудка заключается в том, что в нём начинается переваривание белка. Существенную роль в этом процессе играет соляная кислота. Белки, поступающие в желудок, стимулируют выделение гистамина и группы белковых гормонов -гастринов которые, в свою очередь, вызывают секрецию НСI и профермента - пепсиногена. Источником Н+ является Н2СО3, которая образуется в обкладочных клетках желудка из СО2, диффундирующего из крови, и Н2О под действием фермента карбоангидразы (карбонатдегидра-тазы):
Н2О + СО2 → Н2СО3 → НСО3- + H+
Диссоциация Н2СО3 приводит к образованию бикарбоната, который с участием специальных белков выделяется в плазму в обмен на С1-, и ионов Н+, которые поступают в просвет желудка путём активного транспорта, катализируемого мембранной Н+/К+-АТФ-азой. При этом концентрация протонов в просвете желудка увеличивается в 106 раз. Ионы Сl- поступают в просвет желудка через хлоридный канал. Концентрация НСl в желудочном соке может достигать 0,16 М, за счёт чего значение рН снижается до 1,0-2,0. Приём белковой пищи часто сопровождается выделением щелочной мочи за счёт секреции большого количества бикарбоната в процессе образования НСl. Теперь их надо выделить в просвет желудка.
Водород - через мембранную Н/К-АТФ-азой. Хлор через ХЛОРИДНЫЙ канал.
Виды кислотности желудочного сока, определение и расчет всех видов кислотности по михаэлису.
Виды кислотности желудочного сока
Общая кислотность (НСl + прочие кислые вещества – кислые соли, органические кислоты) 40-60 ммоль/л
Соляная кислота:
Свободная 20-40 ммоль/л
Связанная (с ионогенными группами белков) – 10-12 ммоль/л
Часть соляной кислоты связывается с белками и продуктами их гидролиза, это свя-занная НСl, со свободной она образует общую НС1
В желудочном соке присутствуют органические кислоты и кислые фосфаты – это кислореагирующие продукты. Они вместе с общей соляной кислотой дают общую кислотность желудочного сока
Общая кислотность желудочного сока может как повышаться (гипера-цидное состояние), так и снижаться (гипоацидное), вплоть до исчезнове-ния (анацидное состояние). Гиперацидное состояние вызывается в основном избытком свободной соляной кислоты, т.е. возникает гиперхлоргид-рия. Снижение HCI в желудочном соке — это гипохлоргидрия, отсутствие – ахлоргидрия. Изменение кислотности желудочного сока имеет место при язвенной болезни, гастритах, при раке, злокачественном малокровии
Проферменты пищеварительных протеиназ, механизм превращения в ферменты. Субстратная специфичность протеиназ.
Биологический смысл синтеза проферментов – защита тканей пищеварительных желёз от самопереваривания (аутолиза)
Пепсиноген - белок, состоящий из одной полипептидной цепи с молекулярной массой 40 кД. Под действием НСl он превращается в активный пепсин (с оптимумом рН 1,0-2,5. В процессе активации в результате частичного протеолиза от N-конца молекулы пепсиногена отщепляются 42 аминокислотных остатка, которые содержат почти все положительно заряженные аминокислоты, имеющиеся в пепсиногене. Таким образом, в активном пепсине преобладающими оказываются отрицательно заряженные аминокислоты, которые участвуют в конформационных перестройках молекулы и формировании активного центра.
Образовавшиеся под действием НСl активные молекулы пепсина быстро активируют остальные молекулы пепсиногена (аутокатализ). Пепсин в первую очередь гидролизует пептидные связи в белках, образованные ароматическими аминокислотами (фенилаланин, триптофан, тирозин) и несколько медленнее - образованные лейцином и дикарбоновыми аминокислотами. Пепсин - эндопептидаза, поэтому в результате его действия в желудке образуются более короткие пептиды, но не свободные аминокислоты.
А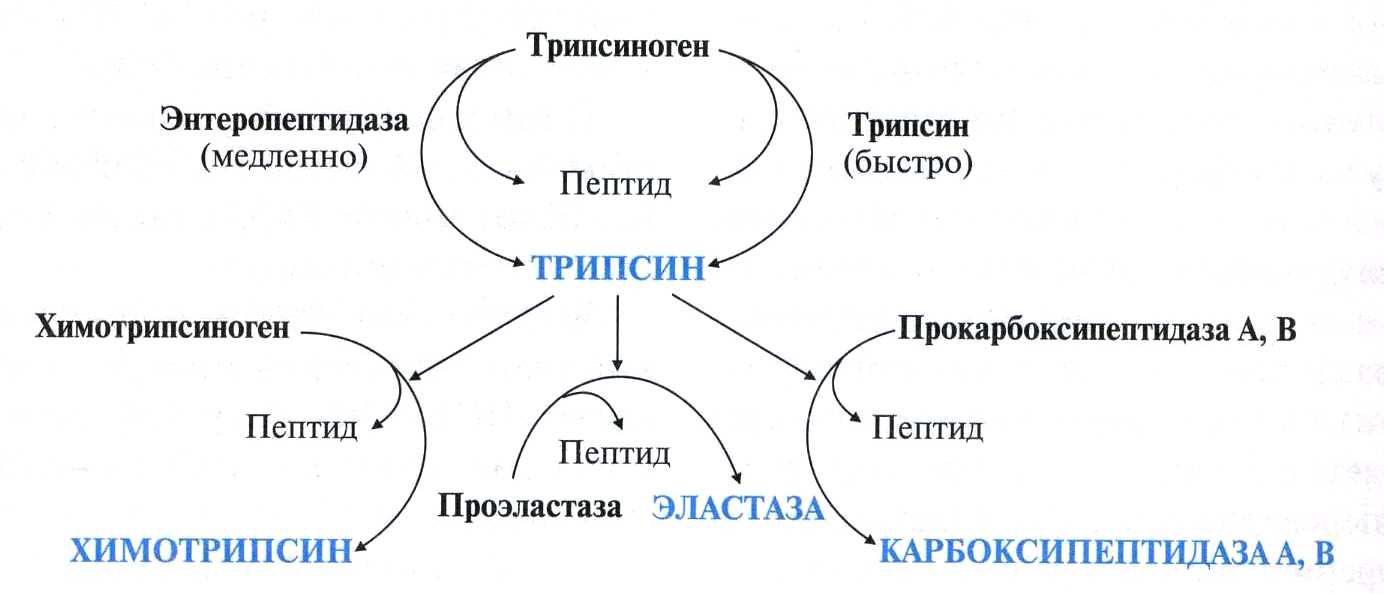 ктивация
панкреатических ферментов.
В поджелудочной железе синтезируются
проферменты ряда протеаз: трипсиноген,
химотрипсиноген, проэластаза,
прокарбоксипептидазы А и В. В кишечнике
они путём частичного протеолиза
превращаются в активные ферменты
трипсин, химотрипсин, эластазу и
карбоксипептидазы А и В.
ктивация
панкреатических ферментов.
В поджелудочной железе синтезируются
проферменты ряда протеаз: трипсиноген,
химотрипсиноген, проэластаза,
прокарбоксипептидазы А и В. В кишечнике
они путём частичного протеолиза
превращаются в активные ферменты
трипсин, химотрипсин, эластазу и
карбоксипептидазы А и В.
Активация трипсиногена происходит под действием фермента эпителия кишечника энтеропептидазы. Этот фермент отщепляет с N-конца молекулы трипсиногена гексапептид Вал-(Асп)4-Лиз. Изменение конформации оставшейся части полипептидной цепи приводит к формированию активного центра, и образуется активный трипсин. Последовательность Вал-(Асп)4-Лиз присуща большинству известных трипсиногенов разных организмов - от рыб до человека.
Специфичность действия протеаз. Трипсин преимущественно гидролизует пептидные связи, образованные карбоксильными группами аргинина и лизина. Химотрипсины наиболее активны в отношении пептидных связей, образованных карбоксильными группами ароматических аминокислот (Фен, Тир, Три). Карбоксипептидазы А и В - цинксодержащие ферменты, отщепляют С-концевые остатки аминокислот. Причём карбоксипептидаза А отщепляет преимущественно аминокислоты, содержащие ароматические или гидрофобные радикалы, а карбоксипептидаза В - остатки аргинина и лизина. Последний этап переваривания - гидролиз небольших пептидов, происходит под действием ферментов аминопептидаз и дипептидаз, которые синтезируются клетками тонкого кишечника в активной форме.
Аминопептидазы последовательно отщепляют N-концевые аминокислоты пептидной цепи. Наиболее известна лейцинаминопептидаза - Zn2+- или Мn2+-содержащий фермент, несмотря на название, обладающий широкой специфичностью по отношению к N-концевым аминокислотам.
Дипептидазы расщепляют дипептиды на аминокислоты, но не действуют на трипептиды.
В результате последовательного действия всех пищеварительных протеаз большинство пищевых белков расщепляется до свободных аминокислот.
Экзопептидазы (экзопротеиназы) — ферменты, гидролизующие белки, отщепляя аминокислоты от конца пептида: карбоксипептидазы — от C-конца, аминопептидазы — от N-конца, дипептидазы расщепляют дипептиды. Экзопептидазы синтезируются в клетках тонкого кишечника (аминопептидазы, дипептидазы) и в поджелудочной железе (карбоксипептидаза). Функционируют эти ферменты внутриклеточно в кишечном эпителии и, в небольшом количестве, в просвете кишечника.
Эндопептидазы (эндопротеиназы) — протеолитические ферменты (пепсин, трипсин, химотрипсин), расщепляющие пептидные связи внутри пептидной цепи. С наибольшей скоростью ими гидролизуются связи, образованные определёнными аминокислотами. Эндопептидазы синтезируются в виде проферментов, активируемых затем при помощи избирательного протеолиза. Таким образом клетки, секретирующие эти ферменты, защищают собственные белки от разрушения. От действия ферментов клеточную мембрану клеток животных защищает также поверхностный слой олигосахаридов —гликокаликс, а в кишечнике и желудке — слой слизи.
