
- •Причини зміни агрегатного стану матеріалу.
- •Причини формування впорядкованої кристалічної гратки при кристалізації металу.
- •Гомогенне утворення зародків при кристалізації.
- •Гетерогенне утворення зародків при кристалізації.
- •Точкові дефекти кристалічної гратки.
- •Лінійні дефекти кристалічної гратки.
- •Зобразити діаграму двокомпонентного сплаву з необмеженою розчинністю у твердому стані з вказанням структурних складових у всіх її областях.
- •Причини і умови формування сплавів з необмеженою і обмеженою розчинністю у твердому стані.
- •Зобразити діаграму двокомпонентного сплаву з обмеженою розчинністю у твердому стані з вказанням структурних складових у всіх її областях.
- •Порядок експериментального одержання діаграми стану двокомпонентного сплаву.
- •Причини і механізм протікання евтектичного перетворення при кристалізації двокомпонентного сплаву з обмеженою розчинністю у твердому стані.
- •Причини зміни розчинності компонентів у твердому розчині при зміні температури.
- •Причини поліморфних перетворень в металах.
- •Поліморфізм заліза.
- •Структурні стани залізовуглецевих сплавів: визначення, властивості.
- •17,18 Структурні складові на діаграмі стану Fe-Fe3c.
- •22 Побудувати і пояснити криву охолодження заевтетоїдної сталі.
- •23 Побудувати і пояснити криву охолодження доевтектичного чавуну.
- •24 Побудувати і пояснити криву охолодження евтектичного чавуну
- •25 Побудувати і пояснити криву охолодження заевтектичного чавуну.
- •28. Вплив вмісту вуглецю на структуру і властивості вуглецевих сталей.
- •29. Вплив сірки на структуру і властивості вуглецевих сталей.
- •30. Вплив неметалевих включень на структуру та властивості вуглецевих сталей
- •31. Схематично зобразити структуру доевтектоїдної сталі з вказанням структурних складових.
- •32. Схематично зобразити структуру евтектоїдної сталі з вказанням структурних складових.
- •33. Схематично зобразити структуру заевтектоїдної сталі з вказанням структурних складових.
- •34. Класифікація чавунів у залежності від кількості вуглецю зв’язаного у цементиті.
- •35. Білі чавуни, структура та властивості.
- •36. Сірі чавуни, структура та властивості.
- •37. Схематично зобразити структуру феритного сірого чавуну з вказанням структурних складових.
- •38. Схематично зобразити структуру ферито-перлітного сірого чавуну з вказанням структурних складових.
- •39. Схематично зобразити структуру перлітного сірого чавуну з вказанням структурних складових.
- •40. Високоміцні чавуни, одержання, структура, властивості. Високоміцні чавуни (з кулястим графітом)
- •41. Схематично зобразити структуру ферито-перлітного високоміцного чавуну з вказанням структурних складових.
- •Ковкі чавуни, одержання, структура, властивості.
Зобразити діаграму двокомпонентного сплаву з обмеженою розчинністю у твердому стані з вказанням структурних складових у всіх її областях.
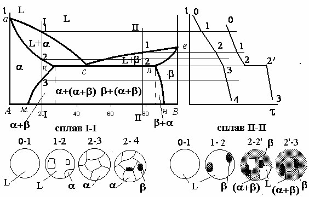
Порядок експериментального одержання діаграми стану двокомпонентного сплаву.
Діаграма стану будується наступним чином.
На вісі абсцис відмічають концентрації сплавів і чистих компонентів. В цих точках проводять ординати і проставляють критичні точки чистих компонентів, а також сплавів, взяті з кривих охолодження (рисунок 5.3).
Зверніть увагу на те, що точка початку вісі Х відповідає стопроцентній концентрації компонента А і нульовій концентації компонента В. Зліва направо зменшується концентрація компонента А і відповідно збільшується концентрація компонента В.
З'єднуючи точки початку кристалізації одержують на діаграмі стану лінію "ліквідус", а з'єднуючи точки кінця кристалізації і одержують лінію "солідус"
Отже, лінія "ліквідус" на діаграмі стану являє собою геометричне місце точок початку кристалізації, а лінія "солідус" – геометричне місце точок кінця кристалізації.
Тепер зрозуміло, що якщо лінії діаграми побудовані по критичних точках, одержаних експериментально, то маючи діаграму стану двокомпонентних сплавів, ми маємо критичні точки всіх сплавів (з будь-якою концентрацією двох компонентів) цієї системи, а відповідно фазовий стан при будь-якій температурі. І можемо по діаграмі стану побудувати криву охолодження для будь-якого сплаву. Для цього на вісі X проставляємо концентрацію сплаву. В цій точці проводимо ординату. Точки перетину ординатою ліній діаграми є критичними точками даного сплаву.
При побудові кривих охолодження користуються правилом фаз ( закон Гіббса).
Причини і механізм протікання евтектичного перетворення при кристалізації двокомпонентного сплаву з обмеженою розчинністю у твердому стані.
Причини зміни розчинності компонентів у твердому розчині при зміні температури.
Зміна розчинності твердих речовин із зміною температури визначається знаком і величиною теплового ефекту розчинення. Якщо для деяких речовин процес розчинення відбувається з поглинанням тепла, то їх розчинність з ростом температури зростатиме. Якщо ж для деяких кристалогідратів теплота гідратації вища за теплоту руйнування кристалічної гратки, то процес розчинення буде екзотермічним, а тому розчинність з ростом температури буде зменшуватись. Якщо ж для деяких кристалогідратів тепловий ефект розчинення наближається до нуля, то розчинність їх практично не буде залежати від температури.
Причини поліморфних перетворень в металах.
Поліморфізм заліза.
Існування одного металу в декількох кристалічних формах називається поліморфізмом, чи алотропією, а температура, при якій метал переходить з одного стану в інший — температурою поліморфного перетворення.
Алотропія металів (або поліморфізм) — це властивість перебудовувати решітку при певних температурах у процесі нагрівання або охолодження. Алотропія властива всім елементам, які змінюють валентність при зміні температури, наприклад залізу, марганцю, нікелю, олову та ін. Кожне алотропічне перетворення відбувається при певній температурі. Наприклад, одне з перетворень заліза відбувається при температурі 911 °С, нижче від якої атоми складають решітку центрованого куба, а вище — решітку гранецентрованого куба
залізо має дві температури поліморфного перетворення: 911оС і 1392оС (1400оС). Після затвердіння (кристалізації) при температурах 1539оС залізо має ОЦК решітки і ця модифікація позначається як δ–Fe. Виникнення інших модифікацій і їх температурні інтервали також наведено на рисунку, видно також, що β і α модифікації заліза мають один і той же тип решітки – ОЦК і відрізняються тільки параметром решітки.
Тип кристалічної гратки і температурний діапазон існування , , і модифікацій заліза. Залізо має дві алотропні форми, тобто два типи кристалічних ґраток, що змінюються зі зміною температури або тиску. Процес перебудови кристалічної гратки, як і інші процеси фазових перетворень для чистих металів, проходить при постійній температурі (рис. 5.1). Нижче 911оС залізо має об’ємноцентровану кубічну гратку (ОЦК) з параметром 0,28606нм і називається ? - залізом (Fea). У діапазоні 911оС – 1392оС залізо
Рис. 5.1. Крива охолодження заліза.
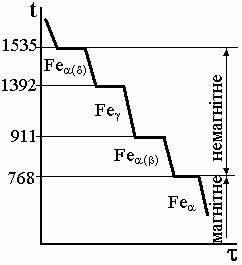
має гранецентровану кубічну гратку (ГЦК) з параметром 0,3645нм і називається ? - залізом (Fe?). Вище 1392оС і до температури плавлення кристалічна гратка знову змінюються на об’ємноцентрований куб, що має такі ж розміри, як і при температурах менше 911оС (іноді цю модифікацію називають ? - залізо (Fe?), щоб розрізняти високо і низькотемпературні типи кристалічних граток). При температурі 768оС (точка Кюрі) зникають магнітні властивості заліза, при цьому тип кристалічної гратки не міняється і таке залізо називають b-залізо (Feb). Процес зникнення магнітних властивостей суттєво відрізняється від поліморфного перетворення.
