
Волинський державний університет ім. Лесі Українки кафедра фізики твердого тіла
Інструкція до лабораторної роботи.
Тема: Визначення сталої Рідберга.
Мета: Ознайомитись із принципом роботи стилоскопа і основними закономірностями в спектрах випромінювання атома водню та при допомозі останніх визначити сталу Рідберга.
Прилади і матеріали:
1 . Набір газозарядних трубок і блок живлення для них.
Ртутна лампа з блоком живлення.
Стилоскоп СЛ-11 А.
Спектрометр СЛП-1.
Література:
1 . Савельев И.В. Курс физики ,Т,3.- М: Наука, 1989.
Ахматова А.С. Лабораторний практикум по физике. - М.: Вьісшая школа, 1980, с 305.
Майсова Н.Н. Практикум по курсу общей физики. - М.: Вьісшая школа 1970,с.409.
Давидюк Г. Є., Калапуша Л. Р., Булатецький В. О. Посібник для лабораторних робіт з квантової фізики. - Луцьк.: Видавництво ЛДШ ім. Лесі Українки, 1992, с 57.
Завдання:
Користуючись ртутною лампою, проградуювати спектрометр СЛП-1.
Вимірявши частоти основних ліній у видимій частині спектра випромінювання водню, визначити сталу Рідберга.
Дати відповіді на контрольні запитання.
Теоретичні відомості:
Розріджений газ, який складається з атомів речовини (атомарний газ) при збудженні випромінює лінійчастий спектр. Було помічено, що лінії в такому спектрі розміщені не хаотично, а об'єднуються в групи або серії, в яких вони зв'язані між собою певними закономірностями.
Швейцарський хімік Бальмер (1885 р.) встановив, що довжини хвиль у видимій серії випромінювання водню можуть бути визначені за формулою:
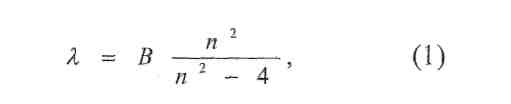
де В - константа, п- ціле число, яке приймає значення: 3, 4, 5 і т. д.
Хвильове число - це кількість довжин хвиль, що вміщується в 1 см Враховуючи це , формулу (1) можна переписати так:
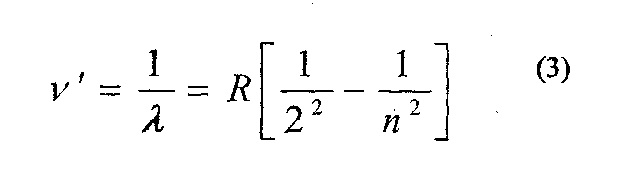
В спектроскопії прийнято характеризувати спектральні лінії не частотою, а хвильовим числом яке обернене до довжини хвилі:

Де R дістало назву сталої Рідберга (на честь шведського спектроскопіста)
R= 1,097373∙ 10-7м.
Якщо для характеристики спектральних ліній користуватись частот, яка визначається:
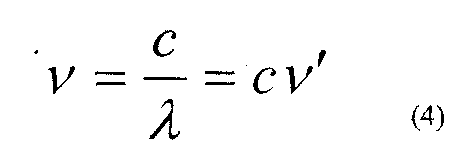
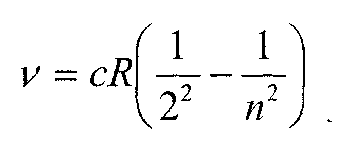
Інколи під сталою Рідберга розуміють константу Ro = cR. Крім серії Бальмера в спектрі водню є інші серії, частоти ліній в цих серіях можна представити узагальненою формулою:
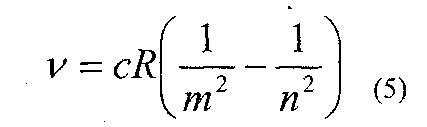
де n і m цілі числа, при чому n≥m + 1; коли m=1 (серія Лаймана), то випромінювання лежить в ультрафіолетовій області. Інші серії, а саме серії Пашена, Брекета, Пфунда, для яких m відповідно рівне 3, 4, 5 лежать в інфрачервоній частині спектра.
Сукупність спектральних ліній, які в своїй послідовності і в розподілі інтенсивності виявляють певну закономірність, називають спектральною серією.
При збільшенні числа п частота ліній в кожній - серії наближається до значення cR/m² , яке дістало назву границі серії,
Спектральні закономірності у випромінюванні найпростіших атомів речовини - атомів водню були вперше пояснені на основі елементарної борівської теорії атома водню.
Атом випромінює квант електромагнітної енергії при переході із стаціонарного стану з більшою енергією Еn в стаціонарний стан з меншою енергією Еm
hv = En- Em (6)
де h – стала Планка, Еn і Еm - спектральні терми або просто терми.
Енергія атома Водню складається з потенціальної енергії U взаємодії між ядром та електронам та кінетичної енергії mv²/2 руху електрона по деякій n стаціонарній орбіті.
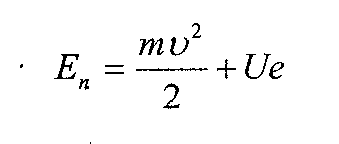
Стаціонарними є стани, для яких момент імпульсу електрона визначається формулою:
![]()
де n - ціле число (n≠ 0), гn- радіус електронної орбіти.
Після відповідних перетворень формули (7) з врахуванням значення
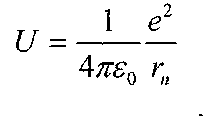
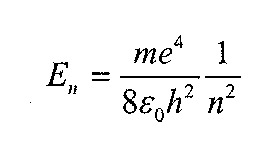
Підставивши значення стаціонарної енергії атома, яка відповідає квантовим числам min(n>m) у формулу(б), одержимо:
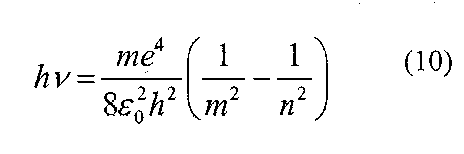
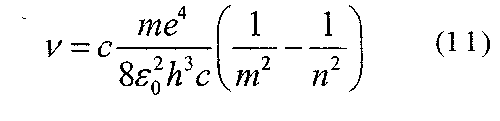
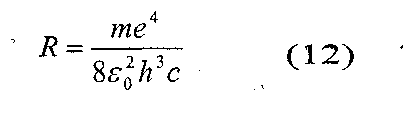
Теорія Бора описує атом з точки зору класичної фізики без врахування хвильових властивостей електрона.
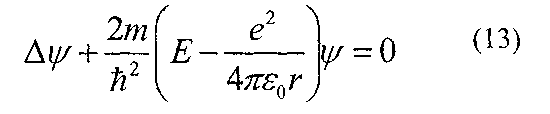 В
більш точній квантовій теорії хвильові
властивості електрона враховуються
рівнянням Шредінгера, яке для електрона
в атомі водню має вигляд:
В
більш точній квантовій теорії хвильові
властивості електрона враховуються
рівнянням Шредінгера, яке для електрона
в атомі водню має вигляд:
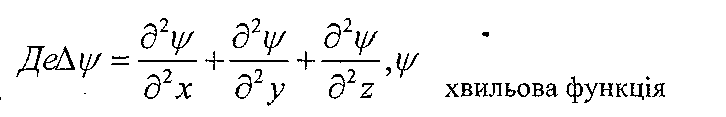
Розв'язок рівняння Шредінгера приводить до появи дискретних значень енергії, які відповідають значенням енергії, одержаної з теорії Бора.
Рівняння Шредінгера вносить суттєві зміни в теорію Бора.
Квантова теорія заперечує існування електронних орбіт в атомі. Хвильова функція електрона дозволяє встановити лише імовірність знаходження електрона в тій чи іншій частині простору.
Теорія багатрелектронних атомів значно складніша теорії атома водню. Спектри багатоелрктронних атомів лінійчасті і характерні для атомів того чи іншого елемента.
Досліджуючи лінійчасті спектри випромінювання атомів, можна встановити природу хімічно елемента. Дана методика покладена в основу спектроскопічного методу аналізу сплавів. Такий аналіз здійснюється на приладах, які дістали назву стилоскопів. Для одержання лінійчастого спектра випромінювання необхідно сплав перевести в атомарний газ. Тому в стилоскопах між досліджуваним зразком і спеціальним мідним диском запалюють дуговий або іскровий розряд, світло якого проектують на вхідну щілину спектрального приладу. Одержаний спектр порівнюють з відповідними стандартами, які додаються до кожного приладу. Таке порівняння дозволяє встановити в спектрі наявність характерних ліній того чи іншого елемента і відповідно провести якісний аналіз сплаву. По інтенсивності спектральних ліній можна оцінити кількість хімічного елемента в сплаві.
Для запалювання дугового або іскрового розряду один із електродів в стилоскопі виготовляють з міді у вигляді диска. Це пояснюється тим, що в електролітичній міді відсутні будь-які сторонні домішки, які вносять в досліджуваний спектр додаткові спектральні лінії. Крім того, мідний електрод, внаслідок високої теплопровідності, нагрівається менше, ніж досліджуваний зразок сплаву і внаслідок цього дає менший фон.
Для того, щоб електрична дуга (при змінній напрузі 220 В) стабільно горіла, додатково до електродів підводять високочастотну напругу від
генератора малої потужності, який називається активізатором.
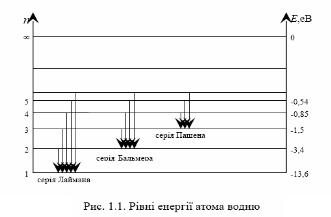
Закономірності в атомних спектрах. Лінії в спектрах розташовуються закономірно. Окремі лінії в спектрах можуть бути об'єднані в групи ліній, що називаються серіями
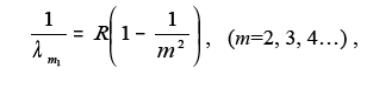
(1.1)
Наприклад, Лайман відкрив серію ліній, що лежать в ультрафіолетовій частині спектра атома водню
(1.1)
- де l- довжина хвилі випромінювання відповідної лінії;
R- стала величина,
m- номер рівня, з якого здійснюється перехід
Бальмер відкрив, що лінії у видимій частині спектра водню можна представити формулою
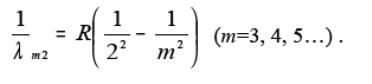
(1.2)
В інфрачервоній частині спектра атома водню було відкрито серії:
П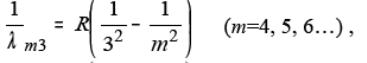 ашена
,
(1.3)
ашена
,
(1.3)
![]()
Брекета (1.4)
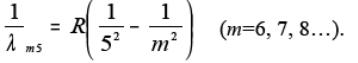
Пфунда . (1.5)
З формул (1.1-1.5) випливає, що довжини хвиль спектральних ліній атома водню, які випромінюються при переході атома з рівня m на рівень n, у загальному випадку можуть бути визначені за допомогою формули:

. (1.6)
Формула (1.6) відома у спектроскопії з 1885 року. Вона одержана емпіричним шляхом і називається формулою Бальмера. Формула Бальмера вірно описує експериментально одержані значення довжин хвиль спектральних ліній атома водню при R=1,097373∙107 м-1 (стала Рідберга).
У даній роботі досліджується серія Бальмера, лінії якої знаходяться у видимій частині спектру. Для серії Бальмера n = 2. Для перших чотирьох ліній цієї серії m приймає значення 3, 4, 5 i 6. Ці лінії прийнято умовно позначати як H, H, H, H.
