
- •Химия лабораторный практикум
- •Вводная часть
- •Цель и задачи освоения дисциплины
- •Место дисциплины в структуре ооп
- •1.3. Требования к результатам освоения учебной дисциплины
- •1.4. Тематический план лекций по химии
- •1.5. Тематический план лабораторного практикума по химии
- •1.6. Общие правила выполнения лабораторных работ
- •1.7. Правила техники безопасности
- •1.8. Первая помощь при несчастных случаях
- •Модуль 1. Основы химической термодинамики и кинетики. Химическое равновесие Занятие 1
- •2. Учебные цели:
- •3. Материалы для самоподготовки к усвоению данной темы
- •3.1. Вопросы для самоподготовки к занятию
- •6. Оснащение рабочего места
- •7.5. Подведение итогов занятия
- •Занятие 2
- •3. Материалы для самоподготовки к усвоению данной темы
- •3.1. Вопросы для самоподготовки к занятию
- •6.Оснащение рабочего места
- •7.1. Типовой тест входного контроля
- •7.2. Узловые вопросы, необходимые для усвоения темы занятия
- •7.3. Самостоятельная работа студентов
- •7.4. Контроль усвоения темы занятия
- •7.5. Подведение итогов занятия
- •Занятие 3
- •2. Учебные цели:
- •3. Материалы для самоподготовки к усвоению данной темы
- •3.1. Вопросы для самоподготовки к занятию
- •6.Оснащение рабочего места
- •7. Содержание занятия.
- •7.1. Типовой тест входного контроля
- •7.2. Узловые вопросы, необходимые для усвоения темы занятия
- •7.3. Самостоятельная работа студентов.
- •7.4. Контроль усвоения темы занятия
- •7.5. Подведение итогов занятия
- •Модуль 2. Учение о растворах Занятие 5
- •7.4. Контроль усвоения темы занятия
- •7.5. Подведение итогов занятия
- •Занятие 6
- •3. Материалы для самоподготовки к усвоению данной темы
- •3.1. Вопросы для самоподготовки к занятию
- •6. Оснащение рабочего места
- •7. Содержания занятия
- •7.1.Типовой тест входного контроля
- •7.2. Узловые вопросы, необходимые для усвоения темы занятия:
- •7.3. Самостоятельная работа студентов
- •7.4. Контроль усвоения темы занятия
- •7.5. Подведение итогов занятия.
- •Модуль 3. Обменные реакции в растворах Занятие 8
- •3. Материалы для самоподготовки к усвоению данной темы
- •3.1. Вопросы и упражнения для самоподготовки к занятию
- •6. Оснащение рабочего места
- •7. Содержания занятия
- •7.1.Типовой тест входного контроля
- •7.2. Узловые вопросы, необходимые для усвоения темы занятия:
- •7.3. Самостоятельная работа студентов
- •7.4. Контроль усвоения темы занятия
- •7.5. Подведение итогов занятия
- •Занятие 9
- •3. Материалы для самоподготовки к усвоению данной темы
- •3.1. Вопросы и упражнения для самоподготовки к занятию
- •6. Оснащение рабочего места
- •7. Содержания занятия
- •7.1.Типовой тест входного контроля
- •7.2. Узловые вопросы, необходимые для усвоения темы занятия:
- •7.3. Самостоятельная работа студентов
- •7.4. Контроль усвоения темы занятия
- •7.5. Подведение итогов занятия
- •Занятие 10
- •2. Учебные цели:
- •3. Материалы для самоподготовки к усвоению данной темы
- •3.1. Вопросы для самоподготовки к занятию
- •6. Оснащение рабочего места:
- •7. Содержания занятия
- •7.1.Типовой тест входного контроля
- •7.2. Узловые вопросы, необходимые для усвоения темы занятия
- •7.3. Самостоятельная работа студентов
- •7.4. Контроль усвоения темы занятия
- •7.5. Подведение итогов занятия
- •Занятие 11
- •3. Материалы для самоподготовки к усвоению данной темы
- •3.1. Вопросы для самоподготовки к занятию
- •6. Оснащение рабочего места:
- •7. Содержание занятия.
- •7.1. Типовой тест входного контроля
- •7.2. Узловые вопросы, необходимые для усвоения темы занятия:
- •7.3. Самостоятельная работа студентов
- •7.4. Контроль усвоения темы занятия
- •7.5. Подведение итогов занятия
- •Занятие 12
- •Занятие 13
- •Литература
7.3. Самостоятельная работа студентов
Лабораторная работа.
Получение и свойства комплексных соединений
Опыт 1. Получение комплексных соединений
Получите комплексные соединения в 4 пробирках, проведя следующие реакции с растворами:
CuSO4 + 4 NH4OH = [Cu(NH3)4]SO4 + 4 H2O;
NaCl + AgNO3 = AgCl↓ + NaNO3;
AgCl + 2 NH4OH = [Ag(NH3)2]Cl + 2 H2O;
FeCl3 + K4[Fe(CN)6] = KFe[Fe(CN)6] + 3 KCl;
FeCl3 + 3 NaOH = Fe(OH)3↓ + 3 NaCl;
Fe(OH)3↓ + 3 H2C2O4 = H3[Fe(C2O4)3] + 3 H2O.
Укажите цвета полученных комплексов, назовите их, напишите уравнения диссоциации комплексных ионов и выражения для констант нестойкости.
Раствор из пробирки (2) с комплексом серебра сохраните для опытов 3 и 5.
Опыт 2. Диссоциация комплексных ионов
Проведите в двух пробирках реакции:
1)FeCl3 + 3 KCNS = Fe(CNS)3 + 3KCl;
2)K3[Fe(CN)6] + KCNS = ?
Запишите наблюдения, сделайте вывод, есть ли в растворе красной кровяной соли K3[Fe(CN)6] ионы Fe3+. Напишите уравнение ее диссоциации.
Опыт 3. Разрушение комплексного иона
К части раствора [Ag(NH3)2]Cl из опыта №1 прибавьте раствор HNO3 до выпадения осадка AgCl. Объясните разрушение комплексного аниона, исходя из констант нестойкости.
[Ag(NH3)2]Cl + 2 HNO3 = AgCl + 2[NH4]NO3.
lgKн = -7,2 lg Kн = -9,3
Опыт 4. Окисление комплексообразователя
Проведите реакцию:
5K4[Fe(CN)6] + 4H2SO4 + KMnO4 = 5K3[Fe(CN)6] + 3K2SO4+MnSO4+4H2O
Запишите наблюдения.
Опыт 5. Восстановление комплексообразователя
Проведите реакцию с [Ag(NH3)2]Cl из опыта №1:
2[Ag(NH3)2]Cl + Zn = 2Ag + [Zn(NH3)4]Cl2.
Сделайте выводы из опытов.
7.4. Контроль усвоения темы занятия
Типовой тест выходного контроля
1. Степень окисления и координационное число центрального атома в соединении K4[Fe(CN)6] равны соответственно
1) +2 и 6; 2) +3 и 4; 3) +3 и ;6 4) +6 и 4.
2. Выражение для константы нестойкости [Ag(NH3)2]+:
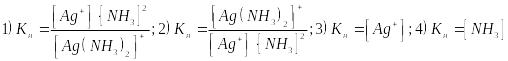
3. Пользуясь константами устойчивости, определите направление реакции: K[Ag(CN)2] + 2 NH3 = [Ag(NH3)2]CN + KCN
lgKуст = 19,9 lgKуст = 7.2
1) влево; 2) вправо; 3) равновесие; 4) не известно.
Типовые упражнения и задачи
1.Назовите перечисленные ниже соединения, укажите центральный атом, лиганды, внутреннюю координационную сферу, внешнюю сферу. Напишите уравнения диссоциации этих соединений в растворе. Для диссоциации по внутренней сфере напишите выражение для константы нестойкости:
1) K3[Co(CN)6]; 6) [Cr(NH3)6]SO4; 11) Na3[AlF6];
2) [Co(NH3)6]Cl2; 7) [Cr(H2O)3Cl3]; 12) [Al(H2O)6]2(SO4)3;
3) [Co(NH3)3(NO2)3]; 8) Na3[Cr(OH)6]; 13) K6[Pb(S2O3)4];
4) K4[Fe(CN)6]; 9) [Pt(NH3)4Cl]Cl3; 14) [Pd(NH3)4][PtCl4];
5) [Fe(CO)5]; 10) K2[Pt(OH)5Cl]; 15) [Hg(NH3)6]Br2.
2. Составьте формулы комплексных соедиений:
1) тринитротриамминкобальт;
2) гексацианоферрат(III) калия;
3) хлорид дихлороакватриамминкобальта(III);
4) фосфатотетраамминхром;
5) тетрацианоаурат (III) калия.
3. С каким лигандом Zn2+ образует более прочное соединение: глицин (Кн=1,1 ∙10-10), лизин (Кн=2,5∙ 10-8), гистидин (Кн=1,3∙ 10-13) ?
4. Пользуясь константами устойчивости, определите направление реакций:
1) K[Ag(CN)2] + 2 NH3 = [Ag(NH3)2]CN + KCN
lgKуст = 19,9 lgKуст = 7.2
2) Na3[Ag(S2O3)2] + 2 KCN = Na[Ag(CN)2] + Na2S2O3 + K2S2O3
lgKус = 13,5 lgKуст = 19,9
5. Рассчитайте массу марганца, находящуюся в виде ионов в растворе триоксалатоманганата (III) натрия объемом 100 мл с концентрацией 0,4 моль/л при избытке оксалат-ионов, равном 0,1 моль/л. (Кн = 3,8 . 10-20).
(Ответ: 8,36 .10-27).
