
- •1. Химическая природа и строение ферментов
- •1.1. Химическая природа ферментов
- •1.2. Активный центр ферментов
- •1.3. Изоферменты
- •2. Основные свойства ферментов
- •2.1.Отличие от неорганических катализаторов
- •2.2 Субстратная специфичность действия ферментов
- •Термолабильность ферментов
- •Зависимость активности ферментов от рН-среды
- •2.5. Активность ферментов
- •3. Механизм действия ферментов.
- •4. Основы кинетики ферментативного катализа
- •5. Факторы, определяющие активность ферментов. Активаторы и ингибиторы ферментов.
- •6. Классификация и номенклатура ферментов
- •Примеры реакций катализируемых ферментами различных классов:
- •Количественная оценка активности ферментов
Термолабильность ферментов
Подобно обычным химическим реакциям, ферментативные реакции ускоряются при повышении температуры. Скорость химической реакции увеличивается в 2 раза при повышении температуры на 10ºС. Однако при повышении температуры происходит инактивация фермента вследствие постепенной денатурации белковой молекулы. Известны, однако, ферменты, устойчивые к тепловой денатурации.
Оптимальная температура для активности ферментов составляет обычно 40—50°. При более низкой температуре скорость ферментативной реакции, как правило, снижается, а при 0° функционирование фермента прекращается.
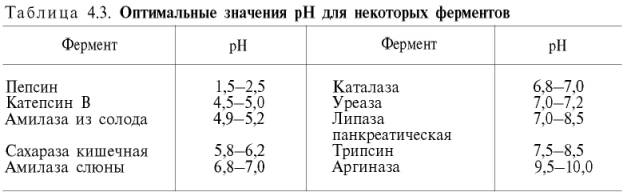
Зависимость активности ферментов от рН-среды
Ферменты различаются по оптимальному для их действия значению рН. Многие ферменты наиболее активны при величине рН, близкой к нейтральной (рН около 7.0), но ряд ферментов имеет оптимум рН вне этой области. Так, пепсин наиболее активен в сильнокислой среде (рН 1,0—2,0), а трипсин — в слабощелочной среде (рН 8,0—9,0).
2.5. Активность ферментов
Как правило, ферменты присутствуют в биологических объектах в ничтожно малых концентрациях, поэтому больший интерес представляет не количественное содержание ферментов, а их активность по скорости ферментативной реакции (по убыли субстрата или накоплению продуктов).
Принятая международная единица активности ферментов (ME) соответствует такому количеству фермента, которое катализирует превращение 1 мкмоля субстрата за 1 мин в оптимальных для данного фермента условиях.
В Международной системе единиц (СИ) единицей активности фермента является катал (кат) — количество фермента., необходимое для каталитического превращения 1 моля субстрата за 1 с.
Характеристикой ферментативной реакции является величина «число оборотов фермента», показывающая, сколько молекул субстрата подвергается превращению за единицу времени в расчете на одну молекулу фермента.
Регуляция активности ферментативных реакций многообразна. Она может осуществляться за счет изменения факторов, влияющих на активность фермента, в т.ч. рН, температуры, концентрации субстратов, активаторов и ингибиторов.
3. Механизм действия ферментов.
Для протекания любой химической реакции молекулы реагирующих веществ должны быть переведены в активированное (переходное) состояние. Молекула субстрата, связанного с ферментом, претерпевает изменения, в результате которых разрываются одни и образуются другие химические связи. Чтобы этот процесс произошел, необходима энергия, которая называется энергией активации. На рисунке … представлено соотношение между энергией активации химической реакции при наличии и в отсутствие катализатора. Наивысшая точка энергии представляет собой энергетический барьер. В присутствии катализатора энергии, которая необходима для начала реакции, требуется меньше.
Достижение переходного состояние возможно при передаче реагирующим молекулам дополнительной энергии (например, в результате нагревания реакционной смеси). Второй путь – снижение энергии активации химической реакции, что связано с применением катализаторов. Роль фермента и состоит в снижении энергетического барьера, который нужно преодолеть субстрату для превращения в продукт.
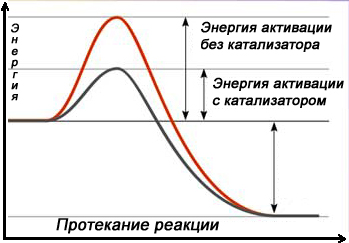
Рис. Соотношение между энергией активации (при наличии и при отсутствии катализатора.
