
4 В котором на каждой 2р-орбитали уже находится по одному электрону.
![]()
Следовательно, присоединяемый к атому азота дополнительный электрон должен попасть на орбиталь, занятую одним электроном. Отталкивание, возникающее между двумя электронами на одной орбитали, является причиной того, что атом азота обладает меньшей способностью притягивать дополнительный электрон, чем атом углерода. Следовательно, атомы элементов с заполненными или полузаполненными подуровнями имеют более положительное сродство к электрону (меньшую способность притягивать электрон), чем элементы, соседние с ними в периодической таблице.
Задача 8. Вычислить энергию ионизации калия в кДж/моль, если первый потенциал ионизации (J1) его равен 4,34 В.
Решение. Энергия ионизации эВ/атом численно равна его ионизационному потенциалу, выраженному в вольтах. I эВ=1,602∙10-19Дж. Эту величину можно выразить в моль атомов: произведение потенциала ионизации (4,34 В) на число Авогадро (N) дает нам величии - энергии ионизации.
J=4,34∙1,602 ∙10-19∙ 6,02 ∙1023 = 418,5 кДж/моль
Задача 9. Вычислите относительную электроотрицательность брома, если известна энергия ионизации брома, равная 1140,8 кДж/моль, и сродство к электрону -3,54 эВ/атом.
Дано:
JBr = 1140,8 кДж/моль
Еср = 3,54 эВ/атом
ОЭО=?
Решение. Электроотрицательность элемента ОЭО - это мера его неметалличности. Она характеризует способность атома элемента присоединять электроны при образовании химической связи. Электроотрицательность (ОЭО) определяется как арифметическая сумма энергии ионизации и сродства к электрону, т.е. ОЭО = (J + E). Сродство брома к электрону равно
Е = 3,54∙1,602∙10-19∙6,02 1023= 341,4кДж/моль.
Задача 10. Как объяснить характер изменения сродства к электрону у атомов галогенов: 3,62 (F), 3,82 (CI), 3,54(Br), 3,24 эВ (J)?
Решение. Уменьшение сродства к электрону от хлора к йоду связано с увеличением радиуса атома и количества электронных слоев.
Химическая связь
Примеры решения задач
Задача 1. Для каких-элементов, имеющих электронные конфигурации внешнего слоя атома a) 3s2р2; б) 4s2р3; в) 5s25p4; г) 6s26р3, характерны переменная четная и переменная нечетная валентности.
Решение. При возбуждении электронов внешнего уровня в а,б, в, г их электронные формулы таковы: а) 3s13р3; б) 4s14р34d1; в) 5sI5p35d2; г) 6sI6p36dI.
Для "а" (кремний) валентность равна 2,4; для "б" (мышьяк) валентность равна 3,5; для "в" (теллур) валентность равна 2,4,6; для "г" (висмут) валентность равна 3,5.
Задача 2. Каковы возможные валентности у атомов кислорода и серы?
Решение. Электронные формулы внешнего уровня кислорода и серы соответственно таковы: 2s22р4 и 3s23р4. У атома серы имеется вакантный подуровень и спаренные электроны атома серы могут распариваться, увеличивая число неспаренных электронов, вследствие чего валентность серы равна 2,4,6, а у атома кислорода валентность может быть равна только 2, т.к. нет вакантного подуровня.
Задача 3. Молекула хлорида бора BCl3 имеет плоскую структуру, а хлорида азота NCl3- пирамидальную. Чем объясняется такое различие?
Решение В молекуле BCl3 центральный атом В при возбуждении имеет 3 электрона:
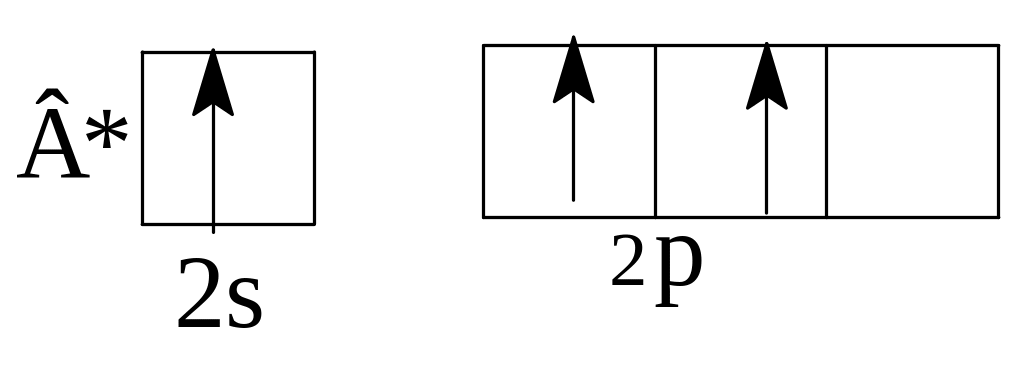
Непарные электроны возбужденного атома бора находятся в sp2-гибридном состоянии, 3 гибридные орбитали атома бора расположены под углом 1200 и связи B-Cl также направлены под углом 120 , форма молекулы плоская.

![]() и пара ē на
2s-
орбитали является несвязывающей, она
оказывает большое отталкивающее
действие, тетраэдрический угол уменьшается
до 107° и форма молекулы становится
пирамидальной.
и пара ē на
2s-
орбитали является несвязывающей, она
оказывает большое отталкивающее
действие, тетраэдрический угол уменьшается
до 107° и форма молекулы становится
пирамидальной.
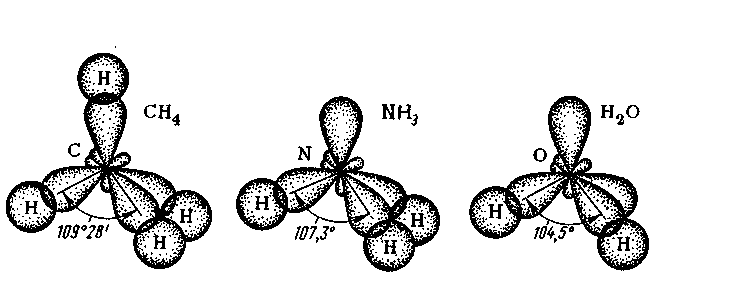
Задача 4. В молекулах СН4, NH3 и H2O валентные орбитали атомов С,N,O находятся в состоянии sp3-гибридизации, однако углы между связями не равны; в CH4 - 109, в NH3-107, в H2O - 104,50. Как это объяснить?
Решение. Причиной этого соглаcно теории валентных связей является наличие у центрального атома несвязывающих электронных пар. Искажение валентных углов вызывается взаимным отталкиванием связывающих и несвязывающих электронных пар центрального атома. Здесь нужно учесть следующее: связывающая орбиталь (электронная пара - локализованная между двумя атомами) имеет меньшие размеры, чем орбиталь несвязывающей электронной пары. Наиболее сильное отталкивание наблюдается между несвязывающими парами, меньший эффект отталкивания между несвязывающей и связывающей парой, наименьшее отталкивание проявляется между связывающими электронными парами.
В![]() предложенных молекулах центральные
атомы образуют химические
связи
за счет электронов sp3-гибридных
орбиталей. В молекуле СН4
у атома углерода на четыре sр3-гибридные
орбитали приходится четыре электрона:
Это определяет образование 4σ-связей
С-H,
направленных под углом 1090.
предложенных молекулах центральные
атомы образуют химические
связи
за счет электронов sp3-гибридных
орбиталей. В молекуле СН4
у атома углерода на четыре sр3-гибридные
орбитали приходится четыре электрона:
Это определяет образование 4σ-связей
С-H,
направленных под углом 1090.
В![]() молекуле NH3
в
атоме азота на четыре sp3
-гибридные
орбитали приходится 5 электронов:
2s-орбиталь
будет несвязывающей и занимает одну
одну из sp3
-
гибридных орбиталей азота, направленных
к вершинам тетраэдра. Несвязывающая
электронная пара отталкивается от
связывающих, в молекуле NH3
угол становится меньше тетраэдрического
и равен HNH=107,30
(геометрическая форма – пирамидаль-
молекуле NH3
в
атоме азота на четыре sp3
-гибридные
орбитали приходится 5 электронов:
2s-орбиталь
будет несвязывающей и занимает одну
одну из sp3
-
гибридных орбиталей азота, направленных
к вершинам тетраэдра. Несвязывающая
электронная пара отталкивается от
связывающих, в молекуле NH3
угол становится меньше тетраэдрического
и равен HNH=107,30
(геометрическая форма – пирамидаль-
Задача 5. Объясните и покажите образование связей в молекулах C2H4, C2H2, KHCO3.
Решение.
Атом углерода в этих молекулах центральный.
Электронная формула углерода такова:
ls22s22p2.
При возбуждении атом углерода имеет
следующую
формулу
ls22s12p3
![]() В молекуле C2H4
каждый
атом углерода находится в состоянии
sр2-гибридизации,
а
в sр2-гибридном
состоянии гибридные орбитали
центрального
атома направлены под углом 1200.
Покажем
перекрывание
гибридных орбиталей углерода:
В молекуле C2H4
каждый
атом углерода находится в состоянии
sр2-гибридизации,
а
в sр2-гибридном
состоянии гибридные орбитали
центрального
атома направлены под углом 1200.
Покажем
перекрывание
гибридных орбиталей углерода:
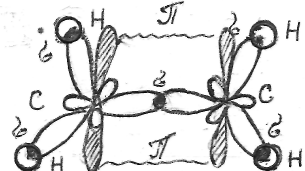
При перекрывании гибридных орбиталей каждый атом углерода образует по 3σ-связи: одну σ - С-С и 2σ -связи С-Н с атомами водорода. В возбужденном атоме углерода по одному электрону от каждого не вошли в гибридизацию и, перекрываясь, образуют по обе стороны линии σ-связи
π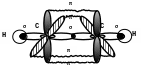 -связь
(перпендикулярно σ -связи); каждый атом
углерода образует по 3 σ- σ-связи и 1
π-связь. В молекуле С2Н2
каждый атом углерода находится в
состоянии sp-гибридизации
и образует по 2 σ-связи С-С и С-Н, а 2
р-электроны, не вошедшие в гибридизацию,
образуют еще 2 π-связи перпендикулярно
друг другу. Покажем перекрывание
орбиталей в С2Н2:
-связь
(перпендикулярно σ -связи); каждый атом
углерода образует по 3 σ- σ-связи и 1
π-связь. В молекуле С2Н2
каждый атом углерода находится в
состоянии sp-гибридизации
и образует по 2 σ-связи С-С и С-Н, а 2
р-электроны, не вошедшие в гибридизацию,
образуют еще 2 π-связи перпендикулярно
друг другу. Покажем перекрывание
орбиталей в С2Н2:
В молекуле КНСО3 центральный атом – углерод находится в состоянии sp2-гибридизации, образует 3 σ-связи; кроме того, один негибридизированный электрон атома углерода и электрон атома кислорода образуют нелокализованную π-связь:
Задача 6. Чем объяснить устойчивость мономерных молекул N2, O2, CO, CO2 (образованы атомами элементов II периода) и склонность к полимеризации молекул Р2 (образованы атомами элементов III периода или атомами кислорода и элементов III периода)?
Решение. В молекулах N2, O2, CO, CO2 наряду с σ-связыванием наблюдается π-связывание, т.е. в этих молекулах образуются прочные кратные связи, например, в молекуле N2 проявляется 1 σ-связь и 2 π-связи. Возбужденный атом углерода в молекуле CO2 имеет 4 непарных электрона. Непарные электроны s-орбитали и р-орбитали образуют 2 sp-гибридные орбитали, расположенные под углом 180 0С. Молекула линейная и каждый из атомов кислорода объединяется с атомом углерода одной σ- и одной π-связью. Поэтому молекулы N2, O2, CO, CO2 устойчивы. Размеры атомов элементов III периода много больше размеров атомов элементов II периода, поэтому для них мало характерно образование π -связывания. Поэтому молекулы P=P,S=S, Si=0, O=Si=O нестабильны и склонны к полимеризации, для фосфора и серы в конденсированном состоянии характерны цепи: −S−S−; −P−Р−; для оксидов кремния - цепи: –O−Si−O−Si−O– и
O O
| |
–O−Si−O−Si−O−
| |
O O
В молекуле SiO2 стабилизация связей Si−O достигается за счет адативного взаимодействия O SiO с участием d-орбиталей атомов кремния.
Задача 7. Пользуясь значениями электроотрицательности, предсказать, имеет ли связь в а)CaO; б)HJ; в)SiH4; г) Br2 чисто ковалентный, чисто ионный или частично ионный характер. В случае чисто ионной и частично ионной связей укажите ожидаемое распределение зарядов ОЭOCa=1; ОЭOO=3,5.
Решение. а) Разность электроотрицательностей в молекуле СaО
∆ОЭО=ОЭОО – ОЭОCa = 2,5 велика, следовательно, связь CaO имеет чисто ионный характер и может описываться структурой Са2+О2-;
б) ОЭОJ=2,5; ОЭОH = 2,1 для HJ ∆ОЭО=(ОЭОJ – ОЭОH = 0,40 связь в этом соединении ковалентная с небольшой степенью ионности Нσ+Jσ–; в) ОЭОSi = 1,8; ОЭОH = 2,1 SiH4 ∆ОЭО=ОЭОH – ОЭОSi =0,30, связь ковалентная с очень небольшой степенью ионности, распределение зарядов описывается структурой.
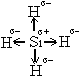
Ионный характер связи в этом случае мал и принято считать, что связь Si-Н имеет чисто ковалентный характер; г) в молекуле Вr2 ∆ОЭО=0, связь чисто ковалентная.
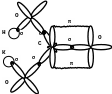
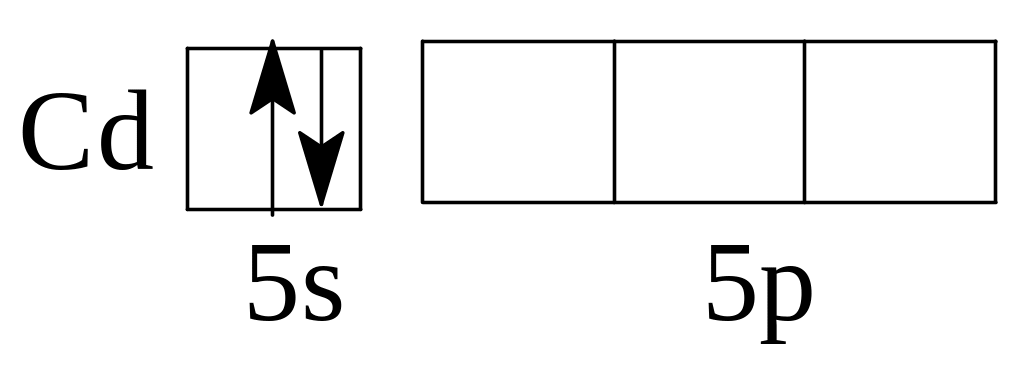
Задача 8. Определить тип гибридизации и форму молекулы в соединении CdС12.
Решение. Электронная формула кадмия ls22s22p63s23p64s23d104p65s24d10. При возбуждении электроны на 5s- подуровне "распариваются" и один из них переходит с 5s-подуровня на 5р-подуровень. Итак, в образовании связи участвуют электроны различных энергетических подуровней. В этом случае они выравнивают свои энергии и образуют две гибридные орбитали, направленные под углом 180°, которые

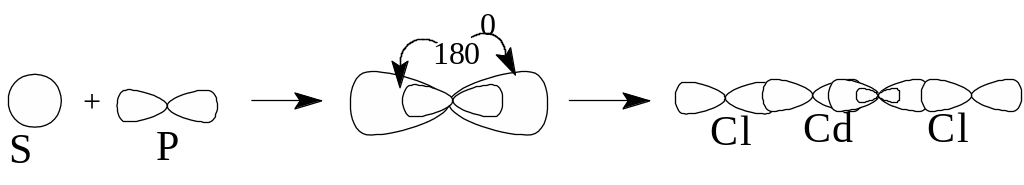
при образовании связей перекрываются р-орбиталями атома хлора. Следовательно, молекула CdCl2 линейна.
Задача 9. Вязкость глицерина CH2OHCH(OH)CH2OH в 75 раз больше вязкости этиленгликоля CH2OH-CH2OH. Какова причина cтоль сильного различия вязкости ?
Решение . Наличие большого числа гидроксильных групп в молекуле глицерина увеличивает возможность образования межмолекулярных водородных связей, что сказывается на увеличении вязкости глицерина по сравнению с этиленгликолем.
Задача 10. Почему в ряду HF, НСl, HBr, HJ падает прочность химической связи и устойчивость молекул к нагреванию?
Решение. При переходе от HF к HJ уменьшается степень перекрывания электронных облаков атомов водорода и галогена, а область перекрывания располагается на большем раccтоянии от ядра атома галогена и сильнее экранируется возросшим числом промежуточных электронных слоев. Кроме того, в ряду F-Cl-Br-J уменьшается электроотрицательность атома галогена. В результате этого в молекуле HF электронное облако атома водорода смещается в сторону атома галогена в наибольшей степени, а в молекулах HCl, НВr, HJ это приводит к уменьшению перекрывания облаков и к ослаблению связи между атомами.
С уменьшением прочности связи в молекулах галогеноводородов падает их устойчивость к нагреванию. Термическая диссоциация HF происходит лишь при очень высоких температурах (более 3500°С), тогда как HJ распадается в значительной степени при 300°С на йод и водород.
Задача 11. Определите энергию связи кислород-водород в молекуле H2O, если энергия связей водород-водород и кислород-кислород соответственно равна 435,9; 498,7 кДж/моль, а при сгорании 2 молей водорода выделяется 483,68 кДж теплоты.
Решение. Важнейшей характеристикой связи является энергия, определяющая ее прочность. Образование молекулы воды можно представить таким образом: а) разрыв связи водород-водород и кислород-кислород в молекулах Н2O и O2 с образованием атомов Н и O; б) образовавшиеся атомы водорода и кислорода соединяются в молекулы H2O, каждая из которых содержит две связи кислород-водород:
4Н (г) = 2Н2(г) - 485,9 2
2О (г) = О2(г) - 498,2
2 Н2(г)+О2(г)=
2Н2О(г)
-
483,68
Н2(г)+О2(г)=
2Н2О(г)
-
483,68
2Н(г)+2О(г) =2Н2О(г) – 1854,18 кДж
в
двух молекулах H2O
четыре связи кислород-водород; средняя
энергия связи кислород-водород равна
![]()
Задача 12. Какая из следующих связей более полярна: а) В-Сl; или C-Cl; б) Р-F или P-Cl? В каждом случае укажите, на каком атоме возникает парциальный отрицательный заряд.
Решение. а) Разность электроотрицательностей (∆ОЭО) бора и хлора равна ∆ОЭО B-Cl =ОЭОCl - ОЭОВ =3,2-1,8=1,4; ∆ОЭОC-Cl=ОЭOCl - ОЭОc =3,2-2,5=0,7. Следовательно, связь B-CI должна быть более полярной; на атоме хлора должен находиться парциальный отрицательный заряд, поскольку он более электроотрицателен. Поскольку бор в периодической системе расположен слева от углерода, то можно предсказать, что он должен слабее притягивать электроны.
Хлор, находящийся в правой части периодической таблицы, должен сильнее притягивать электроны. Наиболее полярная связь возникает между атомами элементов, один из которых характеризуется самой низкой способностью притягивать электроны (бор), а другой - наибольшей способностью притягивать электроны (хлор);
б) поскольку фтор находится в периодической таблице над хлором, для него следует предсказать более высокую электроотрицательность. Следовательно, связь Р-Р должна иметь большую полярность по сравнению со связью P-CI. Подтвердим это количественным расчетом ∆ОЭОF-P = ОЭOF – ОЭOP = 4,0-2,2 = 1,8 ∆ОЭOCl-P = ОЭOCl - ОЭOр = 3,2-2,2=1.
Задача 13. Почему молекулы аммиака (NH3) и трифторид азота NF3, имеющие одинаковую пирамидальную форму и содержащие атомы элементов с примерно одинаковым различием в электроотрицательности, существенно различаются по величинам дипольных моментов:
μNH3 = 1,5Дж; μNF3=0,2Д?
Решение. На величину дипольного момента молекулы сильно влияют несвязывающие (неподеленные) электронные пары. Молекулы NH3 и NF3 имеют одинаковую геометрическую форму, тригоно-пирамидальную неполярность связи N-H и N-F одинаковы, а дипольные моменты значительно отличаются. Это можно объяснить следующим: большая величина μ в молекуле NH3 объясняется тем, что направление дипольного момента отдельных связей N-H, имеющих отрицательный конец у атома азота и неcвязывающей электронной пары совпадает и при векторном сложении обуcловливaeт большой дипольный момент молекулы: μNH3 = 1,5Д
В молекуле же NF3 дипольные моменты отдельных связей N-F с положительным концом у атома азота и неподеленной электронной пары направлены в противоположные стороны, поэтому при векторном сложении они компенсируются и μ сильно уменьшается и μNF3 равно 0,2Д.
