
СТРОЕНИЕ АТОМА. ПЕРИОДИЧЕСКИЙ ЗАКОН
И ПЕРИОДИЧЕСКАЯ СИСТЕМА Д.И. МЕНДЕЛЕЕВА. ХИМИЧЕСКАЯ СВЯЗЬ
Примеры решения задач
Задача 1. Желтый свет, испускаемый натриевой лампой, имеет
длину волны 589 нм. Какова частота этого излучения?
Дано: λ= 589 нм
 с
=3∙108
м/с
с
=3∙108
м/с
ν=?
Решение. Из уравнения с= h∙ν находим ν = c/h. Подставляем в это уравнение значение с и h, преобразуя нм в м, получаем
![]()
Задача 2. Вычислите мельчайшую порцию энергии (т.е. квант энергии)
желтого света с длиной волны 589 нм, которая может быть
поглощена телом.
Дано: λ =589нм
H=6,63∙108 м/с
c=3∙108 м/с
E?
Решение.
Величина кванта энергии согласно
уравнению Планка равна E=h∙ν.
В задаче I
найдено:
![]()
Зная ν, находим: ∆Е=hν =(6,63∙10-34 Дж∙(5,09∙1014 с-1)=3,37∙10-19 Дж. Согласно теории Планка атом или молекула, испускающая или поглощающая излучение с длиной волны 589 нм, могут терять или приобретать энергию излучения только порциями, кратными величине 3,37∙10-19 Дж. Они не могут, например, получить от такого излучения энергию 5,00∙10-19 Дж, поскольку это количество не является целочисленным кратным величине 3,37∙10-19Дж.
Задача 3. Вычислить в электронвольтах энергию возбуждения электрона в атоме магния, если пары его поглощают фотоны с длиной волны 6600∙10-19 м.
Дано: h=6,63∙10-34Дж с
c=3,00∙108 м/с
λ=6,600∙10-10м,
 ∆Е=?
∆Е=?
Решение. Энергия возбуждения электрона равна энергии поглощаемого фотона, которую можно рассчитать по уравнению Планка Е = h∙ν и по соотношению ν = c/λ. Согласно этим двум уравнениям записываем выражение для энергии возбуждения фотона Е = h∙ν = h∙ c/λ:
Е
= 6,63∙10-34![]() =3,410-19
Дж .
=3,410-19
Дж .
Сделаем пересчет Дж в эВ, исходя из того, что 1 Дж = 0,624∙10-19 эВ; отсюда Е возбуждения будет равна Е = 3,4∙10-19 0,624∙10-19 = 2,12∙10-39 эВ.
Задача 4. Вычислить массу фотона, соответствующую линии серии Бальмера, если отвечающая ей длина волны λ равна 6563∙10-10м.
Дано: h = 6,63∙10-34 Дж с
C = 3∙108м/с
λ = 6563 10-10 м
mфотона – ?
Решение.
Из уравнения Луи де Бройля
![]() находим, что m = h/λc.
Подставляя числовые значения, получим,
что
находим, что m = h/λc.
Подставляя числовые значения, получим,
что
![]()
Задача 5. Вычислите длину волны де Бройля, которая соответствует электрону с массой 9,1∙10-31 кг, движущемуся со скоростью 6∙106 м/с.
Дано: ml = 9,1∙10-31кг
Vф = 6∙106 м/с
h = 6,63∙10-34 Дж
λ – ?
Решение.
Подставляя имеющиеся значения в уравнение
де Бройля
![]() ,
получим
,
получим
![]()
Задача 6. Вычислить частоту линии в спектре атомарного водорода, которая соответствует переходу электрона из состояния с n=4 в состояние n = 2.
Дано: ni - квантовое число исходной орбиты=4
nf - квантовое число конечной орбиты=2
ν = ?
Решение. Подставим в уравнение значения ni =4 и nf=2, так как это и есть квантовые числа, исходной и конечной орбит соответственно:
![]()
Отсюда
![]()
Задача 7. Вычислите энергию, необходимую для ионизации электрона из основного состояния атома водорода.
Дано: Rн = 2,18 ∙10-18 Дж
nf = ∞
ni = 1
∆Е=?
Решение.
Энергию ионизации можно записать как
разность между энергиями конечного
состояния nf
и исходного состояния ni:
![]() .
.
Следовательно, ∆E = Rн =2,18∙10-18Дж, полученную величину удобнее выражать в расчете на моль атомов. Для этого ее нужно умножить на число Авогадро:
∆Е = (2,18 10-18) Дж/атом (6,02 1023 атомов/моль)/1000= =1,31∙103 кДж/моль.
Задача 8. Определите энергию (эВ), которой обладает электрон,
находясь на втором энергетическом уровне в атоме водорода.
Дано: n = 2
E = ?
Решение. Для решения задачи применим уравнение (1): En= - Rн z2/n2 · Е = -13,6 z2/n2, где z- заряд ядра атома, n номер энергетического уровня. Энергия электрона на втором энергетическом уровне равна E=13,6∙1/22 эВ = 3,40 эВ.
Задача 9. Длины волн линий Нα и Нβ серии Бальмера ооответственно равны 6563∙10-10 и 4102∙10-10 м. Во сколько раз масса одного фотона (какого?) больше массы другого?
Дано: h=6,626∙10-34 Дж с
с=3∙108 м/с
Нα=6563∙10-10м
Hβ=4102 ∙10-10м
mHβ / mНα=?
Решение. Массу протона вычисляют по уравнению де Бройля, принимая скорость фотона равной скорости света с = 3∙108 м/с:
![]()
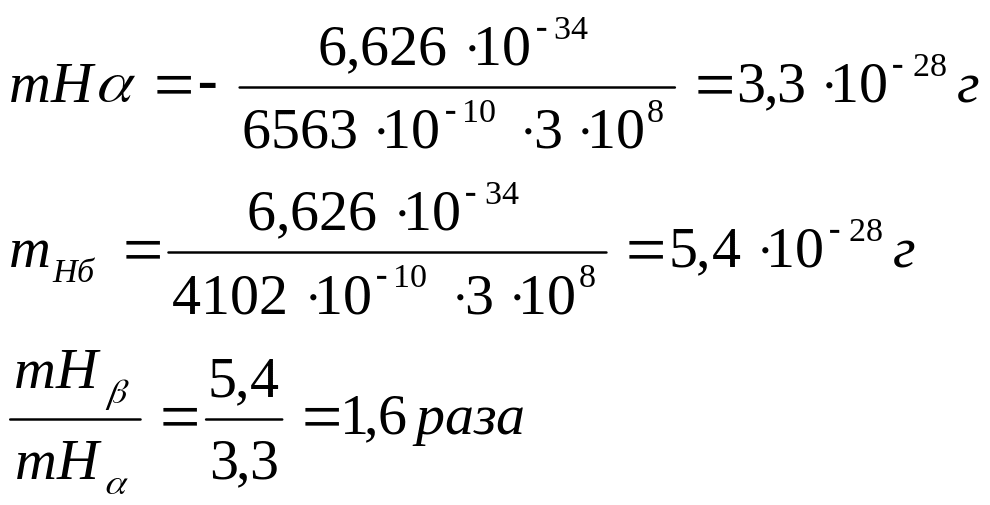
Ответ: mHβ в 1,6 раза больше mHα.
Задача 10. Определите частоту излучения и длину волны 2-й линии (Hβ) серии Бальмера спектра атомарного водорода.
Дано: h=6,63∙10-34Дж с
Rн=3,29∙10-15
или 2,18∙10-18 Дж/ат; υ - ? λ - ?
Решение. Линия Hβ в серии Бальмера атомарного спектра водорода образуется при переходе электрона из состояния n=4 в состояние n =2.
Подставим в уравнение (3) n=4 и n=2, так как это и есть квантовые числа исходной и конечной орбит соответственно:
 Отрицательный
знак полученной величины указывает,
что атом испускает свет. Из уравнения
с = hν
вычислим λ (длину волны излучения).
Отрицательный
знак полученной величины указывает,
что атом испускает свет. Из уравнения
с = hν
вычислим λ (длину волны излучения).
![]() или
4860А0
или
4860А0
КВАНТОВЫЕ ЧИСЛА. ПРИНЦИП ПАУЛИ. ПРИНЦИП НАИМЕНЬШЕЙ ЭНЕРГИИ. ЭЛЕКТРОННЫЕ ФОРМУЛЫ.
ПРАВИЛО ХУНДА
Примеры решения задач
Задача 1. Определите, сколько подуровней и орбиталей может быть в 5-м энергетическом уровне.
Решение. Число подуровней определяется орбитальным квантовым числом l , которое принимает значение от 0 до (n-1). Если n=5, то l=0,1,2,3,4. Число подуровней на 5 уровне равно 5.
Известно, что ориентацию орбиталей в пространстве и возможное число орбиталей характеризует магнитное квантовое число ml, которое принимает значение от –l, 0, +l.
В данной задаче l = 0, 1, 2, 3, 4. Если l = 0(s), ml = 0, это значит, что в случае орбитали шаровой симметрии возможна только одна ее ориентация, т.е. число орбиталей равно 1; если l = 1(p), то ml принимает значения –l,0,+1, т.е. число орбиталей на р-подуровне равно 3; l=2, то ml принимает значения от -2,-1,0,1,2, т.е. число орбиталей нa d-подуровне равно 5; ml=3(f), ml принимает значения от -3,-2,-1,0,1,2,3, т.е. число орбиталей на f подуровне равно 7; ml =4(g), ml принимает значения -4,-3,-2,-1,0,1,2,3,4, т.е. возможное число орбиталей на g-подуровне равно 9. Таким образом, максимально возможное число орбиталей на 5 уровне равно 1+3+5+7+9=25.
Задача 2. Написать электронные формулы атомов йода и вольфрама.
Решение. Для распределения электронов в многоэлектронном атоме воспользуемся принципом Паули и правилами Клечковского. Энергия электрона в атоме определяется значением (n+l) –суммой главного и орбитального квантовых чисел, последовательность заполнения электронами отдельных подуровней происходит в порядке последовательного увеличения суммы (n+l) (1-е правило Клечковского), а при одинаковых значениях суммы - в порядке последовательного возрастания главного квантового числа - (2-е правило Клечковского). Атом иода находится в 5-м периоде, порядковый номер 53. Для распределения электронов предварительно можно для каждого уровня написать значения подуровней и (n+l) (см. таблицу). Заполнение ведем согласно 1-му правилу Клечковского, а с четвертого уровня прибегаем ко 2-му правилу, т.е. если у 2-х квантовых слоев, как у нас, n=3 и n =4, сумма (n+l) равна 4 - (3+1) и (4+0), то после суммы (3+1), заполняется сумма(4+0). Далее заполняем сумму 5, которая повторяется в 3-х квантовых слоях 3,4,5 (3+2, 4+1, 5+0). В этом случае вначале заполняем сумму от меньшего n к большему l, т.е. 3d, 4р, 5s по принципу наименьшей энергии, следующая возрастающая сумма (n+l)=6, она наблюдается также в 3-х квантовых слоях (4+2, 5+1, 6+0). Таким образом распределим 53 электрона атома йода по 2-м квантовым числам 1s2, 2s2, 2p6, 3s2, Зр6, 4s2, 3d10, 4p6,5s2,4d10, 5p5.
Номер периода |
n=1 |
n=2 |
n=3 |
n=4 |
n=5 |
n=6 |
Значе-ние l |
l=0(s) |
l=0(s), 1(p) |
l=0(s), 1(p),2(d) |
l=0(s),1(p),2(d),3f |
l=0(s),1(p),2(d),3f,4d |
l=0(s), 1(p),2(d), 3f,4d,5(… |
Сумма |
(n+l) |
(n+l) |
(n+l) |
(n+l) |
(n+l) |
(n+l) |
|
1+0(s)=1 |
2+0(s)=2 |
3+0(s)=3 |
4+0(s)=4 |
5+0(s)=5 |
6+0(s)=6 |
|
|
2+1(p)=3 |
3+1(p)=4 |
4+1(p)=5 |
5+1(p)=6 |
6+1(p)=7 |
|
|
|
3+2(d)=5 |
4+2(d)=6 |
5+2(d)=7 |
6+2(d)=8 |
|
|
|
|
4+3(f)=7 |
5+3(f)=8 |
6+3(f)=9 |
|
|
|
|
|
5+4(q)=9 |
|
Атом вольфрама находится в 6-м периоде, порядковый номер 74; распределим электроны аналогично атому йода:
1s2,2s2,2p6,3s2,3р6,4s2,3d10,4р6,5s2,4dI0,5p6,6s2 ,4f14,5d4.
Задача 3. Определить последовательность заполнения электронами подуровней в атомах элементов, если их суммы (n+l) соответственно равны 5 и 6.
Решение. n+l =5 n+l=6
n=3, n=4,
l=2, l=1, l=0 l=3, l=2, l=1, l=0
n=4, n=5,
l=3, l=2, l=1 l=0 l=4, l=3, l=2, l=1 l=0
n=5 n =6
l=4, l=3, l=2, l=1 l=0 l=5, l=4, l=3, l=2, l=1 l=0
3+2 4+1=5 5+0=5 4+2=6 5+1=6 6+0=6
Таким
oбpaзoм,
последовательность заполнения электронами
подуровней в атомах элементов, если
сумма n+l
=
5, от 3d→4p![]() 5s,
а в случае суммы n+l
=6 - от 4d
5p
6s.
5s,
а в случае суммы n+l
=6 - от 4d
5p
6s.
Задача 4. Напишите электронные конфигурации следующих ионов: AI3+, Cr3+, Fe2+, Fe3+, Cl.
Р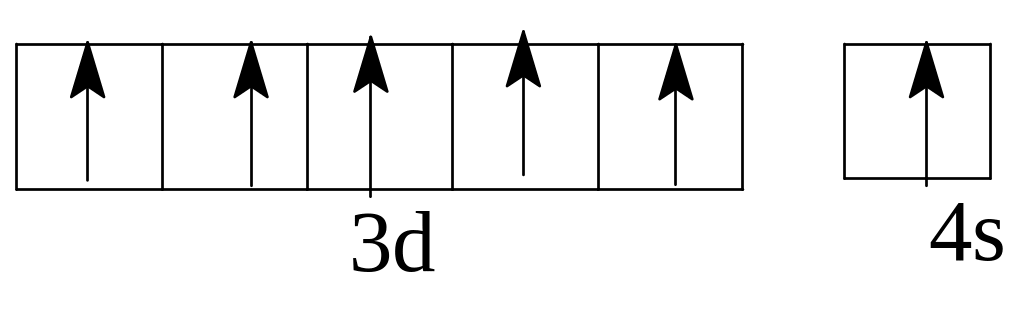 ешение.
Положительно заряженные ионы образуются
в том случае, когда от нейтрального
атома под действием энергии извне
отрываются электроны. Отрицательно
заряженные ионы образуются при
присоединении к нейтральному атому
электронов. Нейтральный атом алюминия
имеет следующую электронную конфигурацию:
13Al
1s22s22р63s23р1,
последний застраивающийся слой 3s23р1.
В том случае, когда атом алюминия (Al)
превращается в ион Al3+,
от нейтрального атома отрывается 3
электрона, имеющие наибольшую энергию,
т.е. с 3s
и 3р-подуровней, вследствие чего ион
имеет следующую электронную конфигурацию:
1s22s22р63s03р0.
Нейтральный атом хрома имеет электронную
конфигурацию 24Cr
1s22s22p63s23р64s13d5,
последний
застраивающийся 3d
– подуровень:
ешение.
Положительно заряженные ионы образуются
в том случае, когда от нейтрального
атома под действием энергии извне
отрываются электроны. Отрицательно
заряженные ионы образуются при
присоединении к нейтральному атому
электронов. Нейтральный атом алюминия
имеет следующую электронную конфигурацию:
13Al
1s22s22р63s23р1,
последний застраивающийся слой 3s23р1.
В том случае, когда атом алюминия (Al)
превращается в ион Al3+,
от нейтрального атома отрывается 3
электрона, имеющие наибольшую энергию,
т.е. с 3s
и 3р-подуровней, вследствие чего ион
имеет следующую электронную конфигурацию:
1s22s22р63s03р0.
Нейтральный атом хрома имеет электронную
конфигурацию 24Cr
1s22s22p63s23р64s13d5,
последний
застраивающийся 3d
– подуровень:
При отрыве от нейтрального атома 3-х электронов в первую очередь будут отрываться: один электрон с подуровня 4s и два электрона с подуровня 3d. При этом атом хрома превращается в ион Cr3+ и его электронная конфигурация будет такова 1s2 2s2 2p6 3s2 3р6 4s°3d3.
Нейтральный
атом железа имеет следующую электронную
конфигурацию 26Fе
1s2
2s2
2p6
3s2
3p6
4s2
3d6.
При отрыве от атома 2
электронов
атом превращается в ион Fе2+:
1s2
2s2
2р6
3s2
3р6
4s°
3d6.
При отрыве от атома 3 электронов, атом
превращается в ион Fe3+:
1s2
2s2
2p6
3s2
3p64s°3d5.
Нейтральный атом хлора имеет следующую
электронную конфигурацию 17Cl
1s2
2s2
2p6
3s2
3p5
![]() ;
приобретая один электрон, атом превращается
в отрицательно заряженный ион Сl-:
1s22s22p63s23p6
;
приобретая один электрон, атом превращается
в отрицательно заряженный ион Сl-:
1s22s22p63s23p6
![]()
Задача 5. Какие ошибки допущены в схемах распределения электронов
внешних слоев в невозбужденном состоянии атомов:
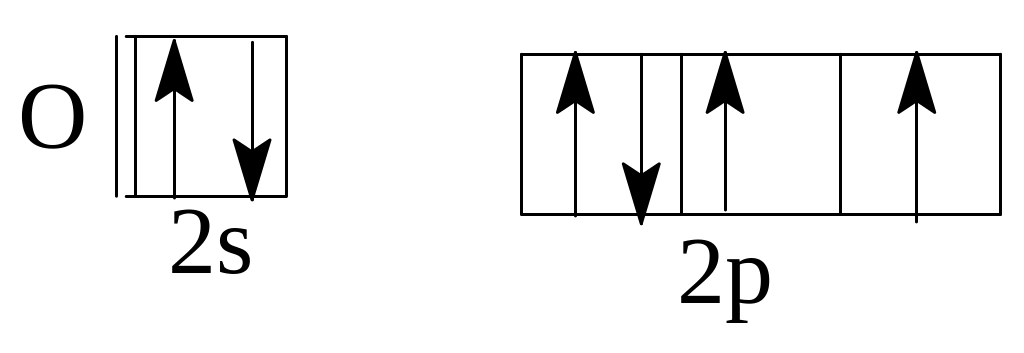
а)
Бор (В)
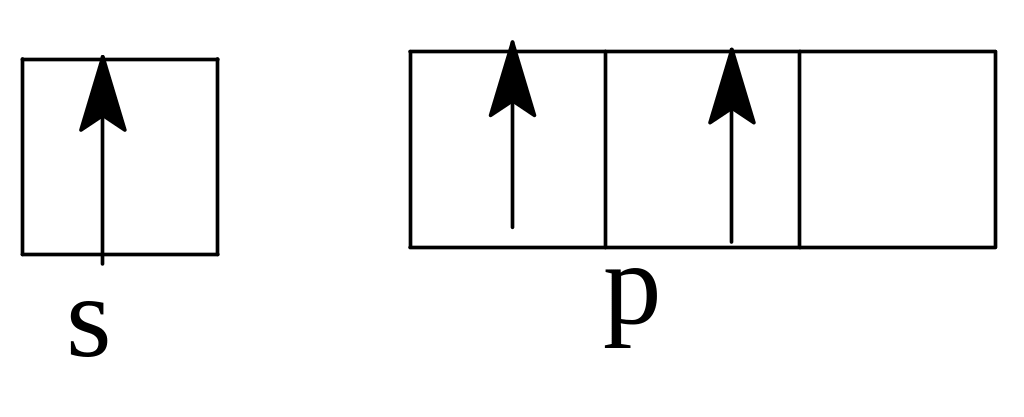
б)Азот
(Ш)

в)
Кислород (0)
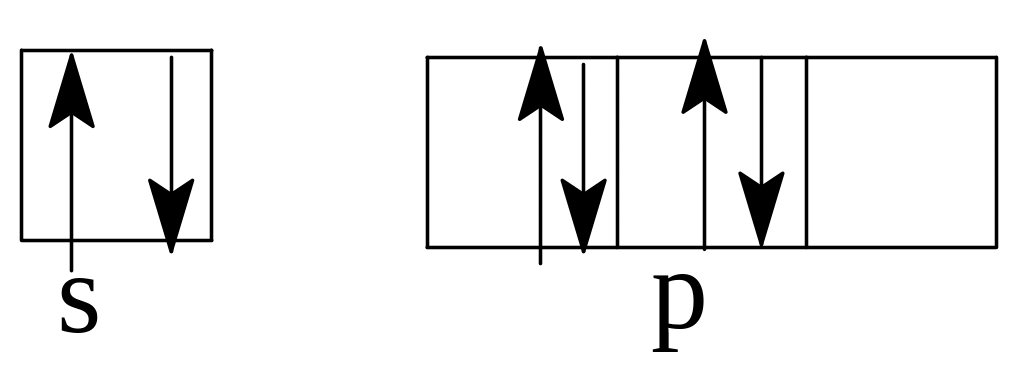
Решение. а) В невозбужденном атоме бора по принципу наименьшей энергии должен вначале заполниться полностью s-подуровень второго
у ровня,
а затем электронами заполняется
р-подуровень. Правильное распределение
2s22р1.
В
случае (б) и (в) не выполнено правило
Хунда. Электроны в пределах подуровня
должны распределяться так, чтобы
суммарное спиновое квантовое число
было максимальным. Правильное
распределение:
ровня,
а затем электронами заполняется
р-подуровень. Правильное распределение
2s22р1.
В
случае (б) и (в) не выполнено правило
Хунда. Электроны в пределах подуровня
должны распределяться так, чтобы
суммарное спиновое квантовое число
было максимальным. Правильное
распределение:
Задача 6. Какие вакантные орбитали, способные влиять на химические свойства элементов, имеются у атомов титана, криптона, урана?
Решение. На химические свойства элементов оказывают влияние лишь вакантные орбитали с относительно низкой энергией. Обычно это d-орбитали предпоследнего слоя. Также можно отметить, что на химические свойства элементов могут оказывать влияние вакантные (n–1) f-орбитали. На химические свойства титана в основном оказывают влияние наличие у его атомов 3d-и 4р-вакантных орбиталей, у атомов криптона 4d-, а у атомов урана 5f-,6d-,7p-орбитали.
Задача 7. Одинаковы ли по энергии и ориентации орбитали двух электронов со следующими наборами квантовых чисел:
1)
n1=3;
l1=0;
m(l)=0
m(s)=![]() ;
;
2)
n2=3;
l2=1;
m(l)=1
m(s)=![]()
Решение. Энергия электрона в атоме определяется суммой энергий главного и орбитального квантовых чисел (n+l). У первого электрона (n+l) равно 3+0=3, а у второго(n+l) (3+1 )=4. Следовательно, эти два электрона имеют различную энергию. Ориентация орбиталей электронов на данном подуровне определяется магнитным квантовым числом, в нашем примере у первого электрона m(l1)=0, а у второго m(l)=1. Следовательно, ориентация орбиталей у них различная.
Задача 8. Не обращаясь к табличным данным, определите количество орбиталей, для которых n = 4, укажите значения чисел n и ml для каждой из этих орбиталей.
Решение. Для n = 4 возможные значения числа l таковы: 0,1,2,3. Это соответствует 4s-, 4р-, 4d-, 4f- подуровням. В них существуют одна 4s-орбиталь (n=4, l=0, ml=0), три 4р-орбитали (n=4, l=1, ml=1,0,+1), пять 4d- орбиталей (n=4, l=2, ml=-2,-1,0,1,2) и семь 4f- орбиталей (n=4, l=3, ml=-3,-2,-1,0,1,2,3).
Задача 9. Написать электронно-графические формулы атомов скандия, брома, молибдена в нормальном и возбужденном состоянии атома.
Решение. Электронные формулы заданных атомов в нормальном
(невозбужденном) состоянии :21Sc 1s22s22p63s23p64s23d1
35Br 1s22s22p63s23p64s23d I04 p5
42Mo 1s22s22p63s23p64s23dI04p 65s14d5
Такие электронные формулы могут быть представлены графически:
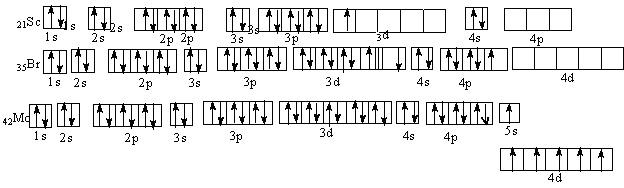
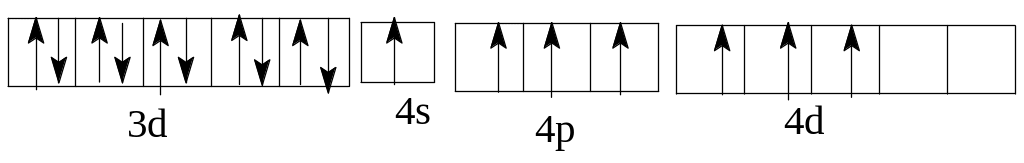
Однако наличие вакантных орбиталей у Sc в 4 уровне в подуровне 4р делает возможным возбуждение этих электронов до 4р у Sc и 4d у Вr с затратой сравнительно небольшой энергии. Электронные формулы возбужденных атомов скандия и брома таковы: Sc* 1 22 22p63s23p64sI3d14pI

максимальное возбуждение Br***ls22s22p63s23p64sI3d104p34d3
3. ПЕРИОДИЧЕСКАЯ СИСТЕМА, ПЕРИОДИЧЕСКИЙ ЗАКОН Д.И.МЕНДЕЛЕЕВА, ПЕРИОДИЧНОСТЬ ИЗМЕНЕНИЯ СВОЙСТВ ЭЛЕМЕНТОВ
