
- •Методическое пособие
- •Методы выражения концентрации растворов
- •264,7 Г h2so4 содержится в 1000 г ее 26,47 % раствора
- •7,35 Г h2so4 будет содержаться в m1 г ее 26,47 % раствора
- •Ионное произведение воды. Вордородный показатель
- •Гидролиз солей
- •Соль образована слабой кислотой и сильным основанием
- •Соль образована слабым основанием и сильной кислотой
- •Соль образована слабым основанием и слабой кислотой
- •Щелочность воды
- •Жесткость воды
- •Варианты домашних заданий
264,7 Г h2so4 содержится в 1000 г ее 26,47 % раствора
7,35 Г h2so4 будет содержаться в m1 г ее 26,47 % раствора
х = 7,35∙1000/264,7 = 27,75 г
Рассчитаем объем (V,мл) 26,47 % раствора H2SO4, необходимый для приготовления 0,5 л ее 0,3 N раствора:
V = m1/ρ = 27,75: 1,19 = 23,3 мл.
Задачи для самостоятельного решения
Дозировка сульфата алюминия при коагуляции воды из одного водоема составила 80 мг Al2(SO4)3 в 1 л. Концентрация сульфата алюминия в коагулирующем растворе равна 1 % (ρ = 1 г/см3). Какой объем коагулирующего раствора необходимо добавить на 1 м3 воды? Ответ. 8.
Какой объем воды (л) и какое количество Al2(SO4)3∙18Н2О (г) нужно взять, чтобы приготовить 2 л 4 % раствора сульфата алюминия? Ответ. 1,92; 162.
Какой объем воды (мл) нужно добавить к 250 мл каждого из растворов: KOH, NH4OH, K2SO4, Fe2(SO4)3, AlCl3, содержащих по 50 г вещества, чтобы получить 1 N раствор? Ответ. 644; 1178; 325; 501; 872.
Рассчитать нормальную и молярную концентрацию 14,38 % раствора серной кислоты (ρ = 1,1 г/см3). Ответ. 3,23; 1,615.
Определить молярную и нормальную концентрацию раствора сульфата алюминия, плотность которого составляет 1,105 г/см3 (см. табл.1).
Ответ. 0,232; 1,94.
50 мл 1 N раствора NaOH было подвернуто нейтрализации 2 N раствором соляной кислоты. Рассчитать процентную концентрацию полученного раствора хлорида натрия (плотность раствора принять равной 1 г/см3).
Ответ. 3,9.
Плотность 6 % раствора гидрофосфата натрия равна 1, 067 г/см3. Рассчитать нормальную концентрацию этого раствора. Ответ. 0,902.
Сколько миллилитров 0,1 N раствора NaOH потребуется для полной нейтрализации 10 мл 0,1 N раствора H3PO4? Ответ. 10.
Сколько миллилитров 0,1 N раствора NaOH потребуется для полной нейтрализации 25 мл 0,03 М раствора H2SO4 (ρ = 1 г/см3)? Ответ. 15.
Сколько миллилитров 0,1 N раствора NaOH потребуется для полной нейтрализации 10 мл 1,15 % раствора HCl (ρ = 1 г/см3)? Ответ. 31.
Вычислить молярную и нормальную концентрации раствора, содержащего 2,1∙10‒3 г CaSO4 в 1 мл. Ответ. 0.0154; 0,0308.
В воде содержаться следующие ионы в количествах (мг-экв/л):
Ca2+ = 5,00; Mg2+ = 1,75; HCO3‒ = 0,70; SO42‒ = 7,00; Cl‒ = 2,50. Определить содержание (мг/л) в воде ионов Na+. Ответ. 79,35.
Проверить правильность химического анализа воды, если в ней содержатся, мг/л:
CaO = 140,0; MgO= 30,0; Na+ = 46,0; SO42‒ = 240,0; HCO3‒ =122,0; Cl‒ =53,3.
Никаких других катионов и анионов в воде не обнаружено. Ответ. Анализ верен.
1.14. По данным анализа общая жесткость вода равна 5,355 мг-экв/л. Содержание (мг/л): HCO3‒ = 100,0; Cl‒ = 5,0; SO42‒ + 225,0.
Вычислить содержание в воде катионов натрия (мг-экв/л). Ответ. 1,126.
Ионное произведение воды. Вордородный показатель
При электролитической диссоциации воды образуются ионы водорода и гидроксила:
Н2О ↔ Н+ + ОН‒
Константа диссоциации воды будет выражена следующим аналитическим уравнением:
КН2О = [Н+]∙[ОН‒] / [Н2О]
Произведение концентраций ионов [ Н+] и [ОН‒] есть величина постоянная при данной температуре и называется ионным произведением воды (Кw).
Поскольку концентрация недиссоциированных молекул воды [Н2О] есть величина постоянная и равна [Н2О] = 1000 : 18 = 55,5моль/л, то ее можно ввести в константу и вычислить величину ионного произведения воды, которая при температуре 220 С будет равна
Кw = КН2О∙[Н2О] = [Н+]∙[ОН‒] = 1,8∙10‒16 ∙ 55,5 = 1∙10‒14.
Ионное произведение воды при данной температуре есть величина постоянная и равна 1∙10‒14 г-ион/л.
В
нейтральной среде [Н+]
= [ОН‒]
=
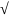 10‒14
= 10‒7
г-ион/л.
10‒14
= 10‒7
г-ион/л.
В кислой среде [Н+] > [ОН‒]; [Н+] > 10‒7 г-ион/л.
В щелочной среде [Н+] < [ОН‒]; [Н+] < 10‒7 г-ион/л.
Кислотность и щелочность среды принято выражать через водородный показатель рН: рН = ‒ lg[Н+]; рОН = ‒ lg[ОН‒].
Из величины Кw следует, что рН + рОН = 14.
Задача 1. Рассчитать рН 0,1 % раствора гидроксида натрия, учитывая, что NaOH полностью диссоциирует в водном растворе (ρ = 1 г/см3).
Решение.
В 1 л такого раствора содержится 1 г NaOH или 2,5∙10‒2 моль/л, тогда концентрация [ОН‒] = 2,5∙10‒2 г-ион/л.
рОН = ‒lg (2,5∙10‒2) = 1,6. рН = 14‒1,6 = 12,4.
Задача 2. Вычислить рН и рОН 0,5 М раствора СН3СООН.
Решение.
Кдис. СН3СООН = 1,75∙10‒5;
[Н+]
=
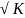 дис.∙[СН3СООН]
=
1,75∙10‒5∙0,5
= 2,96∙10‒3
г-ион/л;
дис.∙[СН3СООН]
=
1,75∙10‒5∙0,5
= 2,96∙10‒3
г-ион/л;
рН = ‒lg2,96∙10‒3 = 2,53; рОН = 14‒2,53 = 11,47.
Задача 3. После обработки пробы соляной кислотой в ней осталось свободной HCl 0,03 моля. Сколько миллилитров 25,33 % раствора аммиака (ρ = 0,906 г/см3) следует добавить в пробу, чтобы рН раствора был равен 10? Общий объем пробы после добавления аммиака должен составлять 100 мл.
Решение.
В основе процесса нейтрализации лежит химическая реакция:
HCl + NH4OH = NH4Cl + H2O
Из стехиометрии химической реакции следует, что на нейтрализацию 0,03 молей HCl расходуется 0,03 моля NH3.
В результате реакции нейтрализации образуется 0,03 моля NH4Cl в 100 мл пробы или 0,3 моля в 1 л.
Пор условию задачи рН раствора 10, или [Н+] = 10‒10 г-ион/л, концентрация [ОН‒] = 10‒14 : 10‒10 = 10‒4 г-ион/л.
Такую концентрацию ионов ОН‒ обеспечивает наличие в растворе избыточной концентрации NH4OH, которая может быть рассчитана по формуле:
[NH4OH] = [ОН‒]∙[ NH4OH] / Коснов = 10‒4 ∙ 0,3 / 1,79∙10‒5 = 1,676 моль/л.
В 100 мл пробы избыточного NH4OH должно содержаться 0,1676 моля. Всего аммиака в пробе должно содержаться 0,1676 + 0,03 0,1976 моля. Масса аммиака, содержащегося в растворе должна составлять:
m = ν ∙ М = 0,1976∙17 = 3,359 г.
Рассчитаем объем 25,33 % раствора аммиака, необходимого ввести в пробу: V = 3,359 ∙ 100 / 25,33 ∙ 0,906 = 14,65 мл.
Задачи для самостоятельного решения
Рассчитать величину рН 0,1 м раствора HCl. Ответ. 1.
Рассчитать величину рН 0,1 М раствора плавиковой кислоты, если степень диссоциации HF составляет 8,5 %. Ответ. 2,07.
Рассчитать величину рН 0,1 % раствора H2SO4 (ρ = 1 г/см3).
Ответ. 1,69.
Рассчитать величину рН 0,028 % раствора КОН (ρ = 1 г/см3).
Ответ. 11,7.
Рассчитать величину рН 0,1 м раствора аммиака. Ответ. 11,13.
рН раствора 3,5. Рассчитать концентрацию (г-ион/л) ионов Н+ и ОН‒ Ответ. 3,16∙10‒4; 3,16∙10‒11.
Вычислить нормальную концентрацию сильной кислоты и щелочи, если рН этих растворов 1,5 и 12,0 соответственно. Ответ. 0,0316; 0,01.
Сколько миллилитров раствора аммиака (ρ = 0,91 г/см3) следует взять для приготовления 0,5 л раствора с рН 12? Ответ. 210.
Сколько миллилитров 36,23 % раствора соляной кислоты (ρ = 1,18 г/см3) следует взять для приготовления 2 л раствора, имеющего величину рН 1? Ответ. 17,1.
Сколько миллилитров 36 % раствора плавиковой кислоты (ρ = 1,118 г/см3) следует взять для приготовления 2 л раствора, рН которого равен 2? Степень диссоциации HF = 8,5 %. Ответ. 11,7.
