
- •«Обмен белков в организме»
- •Переваривание белков в организме. Этапы гидролиза белковой молекулы.
- •Всасывание аминокислот и утилизация. Межуточный обмен аминокислот.
- •3. Дезаминирование, переаминирование, декарбоксилирование
- •1. Прямое дезаминирование.
- •Непрямое дезаминирование
- •Переаминирование
- •Декарбоксилирование
- •Биогенные амины, роль в организме
Непрямое дезаминирование
Реакции, катализируемые оксидазами, в клетке протекают медленно, а наибольшей активностью обладает фермент глутаматдегидрогеназа, роль которой в обмене аминокислот велика. Фермент глутаматдегидрогеназа широко представлен в печени, мозге и катализирует превращение глутаминовой кислоты в α-кетоглутаровую кислоту:
глутаматдегидрогеназа
 НООС-СН2-СН2-СН-СООН
НООС-СН2-СН2-С-СООН
+ NН3
НООС-СН2-СН2-СН-СООН
НООС-СН2-СН2-С-СООН
+ NН3
NН2 О
Глутаминовая кислота α-кетоглутаровая кислота
Переаминирование
ТРАНСАМИНИРОВАНИЕ (переаминирование) – реакции, в ходе которых аминогруппа переносится от донорской аминокислоты к акцепторной α-кетокислоте. В результате получается α-кетокислота из донорской аминокислоты и новая аминокислота. Реакции катализируют ферменты трансаминазы с участием кофермента пиридоксальфосфата (производное Vit B6).
Трансаминирование происходит практически во всех органах. Играет основную роль в процессах мочевинообразования, глюконеогенеза, путях образования новых аминокислот.
Продукт реакции α-кетоглутаровая кислота является хорошим субстратом в реакциях переаминирования – реакции, в которых происходит как бы обмен аминогруппы на кетогруппу между аминокислотой и кетокислотой:
СН3 СООН СН3 СООН СООН
АлАТ глутаматдегидрогеназа

 СН-NН2
+ СН2
С=О + СН2
СН2
+ NН3
СН-NН2
+ СН2
С=О + СН2
СН2
+ NН3
Переаминирование + ½ О2
СООН СН2 СООН СН2 СН2
α-аланин Пируват
С=О СН-NН2 С=О
СООН СООН СООН
α-кетоглутаровая α-глутаминовая α-кетоглутаровая
кислота кислота кислота
α-аланин → пируват (трансаминирование),
α-кетоглутаровая кислота → глутаминовая (окислительное дезаминирование).
Такое сочетание переаминирования аминокислот с участием кетоглутаровой кислоты с последующим дезаминированием глутаминовой кислоты получило название непрямого дезаминирования.
(Непрямое дезаминирование α-аминокислот связано с предварительным переносом их аминогруппы на кетоглутаровую кислоту путем переаминирования.)
В
клинической практике широко используется
определение двух трансаминаз. В
диагностике инфаркта миокарда применяют
определение активности АсАТ, а для
диагностики и оценки эффективности
лечения некоторых болезней печени
используют определение активности
АлАТ, что связано с неравномерным
распределением этих ферментов в разных
органах и тканях и даже в разных
субклеточных фракциях (сердце, печень,
почки, эритроциты, легкие, плазма). ⅔
всей активности АсАТ клетки приходятся
на митохондрии, а для АлАТ – на цитоплазму.
При незначительных нарушениях функций
клетки в кровь переходят цитозольные
ферменты. При значительных повреждениях
в кровь могут переходить митохондриальные
ферменты. При инфаркте миокарда активность
АсАТ повышается через 2-6 часов после
инфаркта, достигает максимума через
24-48 часов и затем в течение недели
возвращается к исходным значениям. АсАТ
оказывает хорошую помощь в диагностике.
При острых поражениях печени типичным
будет повышение активности АлАТ, а также
АсАТ, ЛДГ, но коэффициент
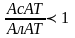 ,
а при инфаркте
,
а при инфаркте
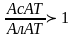 .
Повышение активности АлАТ наблюдается
при повреждении паренхимы печени.
.
Повышение активности АлАТ наблюдается
при повреждении паренхимы печени.
