
Степановских Е.И. Тестовые задания для самоконтроля по курсу физической химии [doc]
.docФедеральное агентство по образованию
ГОУ ВПО «Уральский государственный технический университет − УПИ»
Физическая химия
Тестовые задания для самоконтроля
по курсу «Физическая химия»
для студентов химикотехнологического факультета
Екатеринбург
2007
УДК 544(076)С79
Составитель Степановских Е.И.
Научный редактор проф., д-р хим. наук Марков В.Ф.
Физическая химия: тестовые задания для самоконтроля по курсу «Физическая химия» / сост. Е. И. Степановских. Екатеринбург: ГОУ ВПО УГТУ−УПИ, 2007 −28 с.
Тестовые задания предназначены для самостоятельного контроля усвоения материала курса физической химии, они составлены по всем разделам курса.
Библиогр.: 6 назв. Рис. 36.
Подготовлено кафедрой «Физическая и коллоидная химия».
© ГОУ ВПО «Уральский
государственный технический
университет – УПИ», 2007
Данный банк, содержащий 100 тестовых заданий, предназначен либо для самоконтроля, проводимого студентами в ходе изучения курса «Физическая химия», либо при использовании соответствующих компьютерных программ может использоваться в качестве одного из видов контроля (текущего или итогового), при оценке знаний студентов по рейтинговой технологии, при этом тест формируется по случайному выбору.
Вся совокупность тестовых заданий разделена на две части, так как обучение студентов физической химии продолжается два семестра, и поэтому контроль удобнее проводить отдельно по каждому семестру.
Задания представлены в виде двух стандартизованных форм: закрытой и на установления соответствия.
Тестовые задания не требуют дополнительных пояснений по способу ввода тестируемых заключений. Закрытая форма тестового задания предполагает выбор одного, двух или трех верных заключений. В тестовых заданиях используются общепринятые термины и символы, употребляемые при изучении данного курса и поэтому не нуждающиеся в объяснениях. Содержание тестовых заданий соответствует Государственному образовательному стандарту высшего и среднего образования и учебному плану по направлению подготовки 240400 – Технология органических веществ и топлив, специальностей: 240401– химическая технология органических веществ и по направлению 240900 – Биотехнология, специальности 240901 –биотехнология.
Тестовые задания составила: Степановских Е.И., доц., к.х.н. Разработка данного банка тестовых заданий происходила в течение 20052007 гг.
Содержательная структура теста представлена в таблице.
|
|
Раздел курса физической химии |
Номера ТЗ |
Кол-во |
|
|
1 часть |
|
|
|
1 |
Основные понятия физической химии. Постулаты физической химии. Характеристические функции |
ТЗ 1 ТЗ 26. |
26 |
|
2 |
Растворы |
ТЗ 27 ТЗ 39 |
13 |
|
3 |
Изменение экстенсивных свойств системы. Химическое равновесие |
ТЗ 40 ТЗ 44 |
5 |
|
|
2 часть |
|
|
|
4 |
Фазовые равновесия в одно- и двухкомпонентных системах |
ТЗ 45 ТЗ 72 |
28 |
|
5 |
Электрохимия |
ТЗ 73 ТЗ 88 |
16 |
|
6 |
Химическая кинетика |
ТЗ 89 ТЗ 100 |
12 |
ТЗ 1.
МАТЕМАТИЧЕСКОЕ ВЫРАЖЕНИЕ ДЛЯ ЭНТАЛЬПИИ
-
H = U + pV.
-
H = U – TS.
-
H = G + TS.
-
H = F TS.
-
H = G TS.
ТЗ 2
МАТЕМАТИЧЕСКОЕ ВЫРАЖЕНИЕ ДЛЯ ЭНЕРГИИ ГИББСА
-
G = U – TS.
-
G = H – TS.
-
G = F + pV.
-
G = F – TS.
-
G = H – pV.
ТЗ 3
ОПРЕДЕЛИТЕЛЬНОЕ ВЫРАЖЕНИЕ ДЛЯ ФУНКЦИИ ГЕЛЬМГОЛЬЦА
-
F = H – TS.
-
F = U – TS.
-
F = G – TS.
-
F = G – pV.
-
F = U + pV.
ТЗ 4
ДЛЯ ЭНТАЛЬПИИ ЕСТЕСТВЕННЫМ ЯВЛЯЕТСЯ СЛЕДУЮЩИЙ НАБОР ПЕРЕМЕННЫХ
-
T, p,
 .
.
-
T, V, nk.
-
S, p,
 .
. -
S, V,
 .
. -
S, p, nk.
ТЗ 5
ВНУТРЕННЮЮ ЭНЕРГИЮ УДОБНО РАССМАТРИВАТЬ КАК ФУНКЦИЮ
-
f(T, S,
 ).
). -
f(S, V,
 ).
). -
f(S, p,
 ).
). -
f(S, V, nk).
-
f(S, p, nk).
ТЗ 6
ФУНДАМЕНТАЛЬНОЕ УРАВНЕНИЕ ГИББСА ДЛЯ ЗАКРЫТОЙ СИСТЕМЫ БЕЗ ХИМИЧЕСКОГО ПРЕВРАЩЕНИЯ ИМЕЕТ ВИД
-
dG = TdS – pdV.
-
dG = TdS – Vdp.
-
dG = SdT +Vdp.
-
dG = SdT + pdV.
-
dG = SdT – Vdp .
ТЗ 7.
СООТВЕТСТВИЕ ТЕРМОДИНАМИЧЕСКИХ ФУНКЦИЙ ЗАКРЫТОЙ СИСТЕМЫ И ИХ ЕСТЕСТВЕННЫХ ПЕРЕМЕННЫХ
1. Н а) S, V
2. G б) S, p
3. F в) p, T
г) p, V
д) T, V
е) S, T
ТЗ 8.
ЧАСТНАЯ ПРОИЗВОДНАЯ ЭНТАЛЬПИИ ПО ЭНТРОПИИ РАВНА
1.
![]() T
T
2.
![]() p
p
3.
![]() T
T
4.
![]()
![]()
5.
![]() V
V
ТЗ 9.
СООТВЕТСТВИЕ ОБОБЩЕННЫХ КООРДИНАТ ОБОБЩЕННЫМ ПОТЕНЦИАЛАМ
1. Энтропия а) химический потенциал
2. Число молей компонента k б) масса
3. Объем в) отрицательное давление
г) температура
д) энтальпия
е) разность давлений
ТЗ 10.
СООТВЕТСТВИЕ ТЕРМОДИНАМИЧЕСКОЙ ФУНКЦИИ ЕЕ ОПРЕДЕЛИТЕЛЬНОМУ ВЫРАЖЕНИЮ
1. Энтальпия а) H TS
2. Энергия Гельмгольца б) H + pV
3. Энергия Гиббса в) U + TS
г) U TS
д) U + pV
е) TS + pV
ТЗ 11.
ДИФФЕРЕНЦИАЛЬНАЯ ФОРМА ПЕРВОГО ЗАКОНА ТЕРМОДИНАМИКИ ДЛЯ ОТКРЫТОЙ СИСТЕМЫ БЕЗ ХИМИЧЕСКОГО ПРЕВРАЩЕНИЯ
-
dU = TdS pdV +
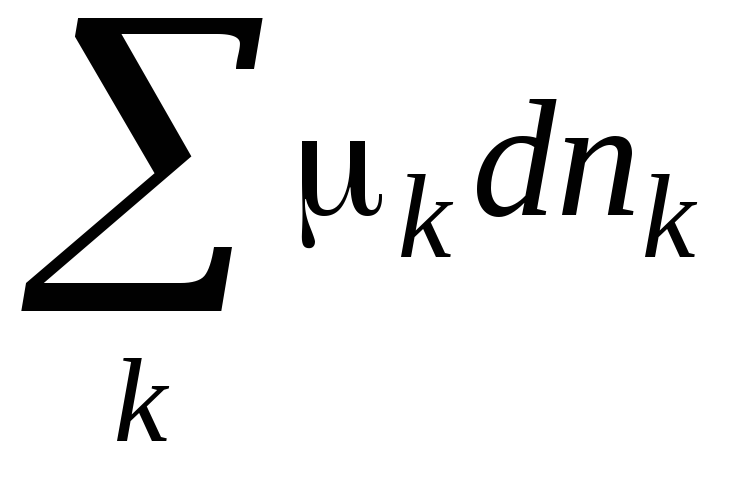
-
dU = TdS + pdV +
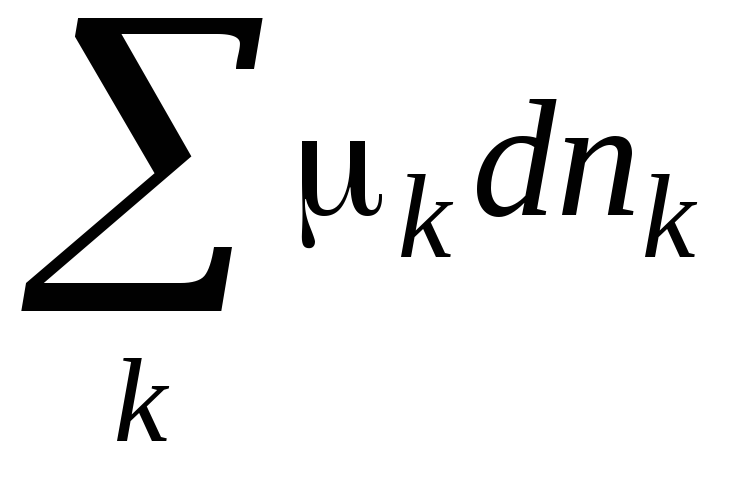
-
dU = SdT pdV +
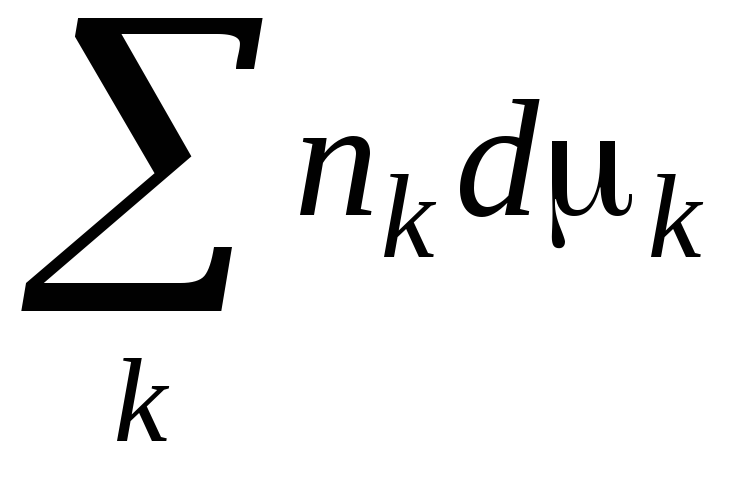
-
dU = SdT pdV
-
dU = TdS pdV
ТЗ 12.
МАТЕМАТИЧЕСКОЕ ВЫРАЖЕНИЕ ПЕРВОГО ЗАКОНА ТЕРМОДИНАМИКИ ДЛЯ ИЗОЛИРОВАННОЙ СИСТЕМЫ
-
dU = 0.
-
dU = dQ pdV.
-
U = const.
-
dU = dQ +pdV.
-
dU = dQ.
ТЗ 13.
ВТОРОЙ ЗАКОН ТЕРМОДИНАМИКИ
-
Сформулирован постулативно.
-
Выведен на основании законов квантовой химии.
-
Носит статистический характер.
-
Имеет ограничения по области действия.
-
Абсолютен в применении.
ТЗ 14.
ОТНОШЕНИЕ ИЗМЕНЕНИЯ ЧИСЛА МОЛЕЙ КОМПОНЕНТА k В ХОДЕ РЕАКЦИИ К СТЕХИОМЕТРИЧЕСКОМУ КОЭФФИЦИЕНТУ НАЗЫВАЕТСЯ
-
Степенью диссоциации.
-
Глубиной химической реакции.
-
Плотностью глубины химической реакции.
-
Химической переменной.
-
Степенью превращения.
ТЗ 15.
ВЫРАЖЕНИЕ: ЭНТРОПИЯ БЕЗДЕФЕКТНОГО КРИСТАЛЛА ПРИ АБСОЛЮТНОМ НУЛЕ РАВНА НУЛЮ
-
Называется постулатом Планка.
-
Называется тепловой теоремой Нернста.
-
Третьим законом термодинамики.
-
Законом фазового равновесия.
-
уравнением КлайзиусаКлапейрона.
ТЗ 16.
ЧАСТНАЯ ПРОИЗВОДНАЯ ЭНТАЛЬПИИ ПО ТЕМПЕРАТУРЕ ПРИ ПОСТОЯНСТВЕ ДАВЛЕНИЯ В ЗАКРЫТОЙ СИСТЕМЕ НАЗЫВАЕТСЯ
-
Парциально-мольной энтропией.
-
Изобарной теплоемкостью.
-
Изохорной теплоемкостью.
-
Мольной энтропией.
-
Энтропией смешения.
ТЗ 17.
ПРОИЗВОДНАЯ
![]() ПРЕДСТАВЛЯЕТ
СОБОЙ
ПРЕДСТАВЛЯЕТ
СОБОЙ
-
Химический потенциал компонента k.
-
Парциальную мольную энергию Гиббса компонента k.
-
Мольную энтропию компонента k.
-
Мольную энергию Гиббса.
-
Парциальную мольную энтропию компонента k.
ТЗ 18.
СООТВЕТСТВИЕ НАЗВАНИЯ ЗАКОНОВ ИХ МАТЕМАТИЧЕСКОМУ ВЫРАЖЕНИЮ
1.
Закон ГиббсаДюгема
а)
 .
.
2.
Закон ГиббсаГельмгольца
б)
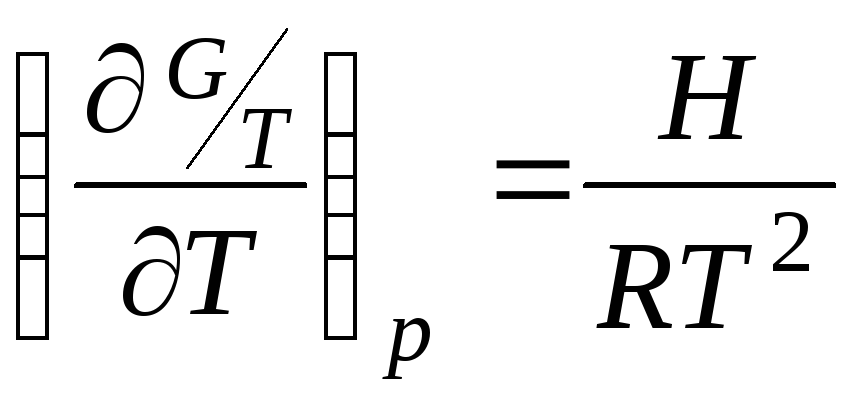 .
.
3.
Закон Генри в)
![]() .
.
г)
![]() .
.
д)
![]() .
.
е)
![]() .
.
ТЗ 19.
ИНТЕНСИВНЫЕ ПЕРЕМЕННЫЕ
-
Масса.
-
Температура.
-
Давление.
-
Теплоемкость.
-
Число молей вещества.
ТЗ 20.
ЭКСТЕНСИВНЫЕ ПЕРЕМЕННЫЕ
-
Масса.
-
Давление.
-
Объем.
-
Температура.
-
Концентрация.
ТЗ 21.
ОБЩЕЙ КОЛИЧЕСТВЕННОЙ МЕРОЙ, ХАРАКТЕРИЗУЮЩЕЙ РАЗЛИЧНЫЕ ТИПЫ ВЗАИМОДЕЙСТВИЯ СИСТЕМЫ С ОКРУЖАЮЩЕЙ СРЕДОЙ, ЯВЛЯЕТСЯ
-
Энергия Гиббса.
-
Работа.
-
Теплота.
-
Внутренняя энергия.
-
Энтальпия.
ТЗ 22.
ЭНТРОПИЯ ИЗОЛИРОВАННОЙ СИСТЕМЫ ПРИ ОБРАТИМОМ ПРОЦЕССЕ
-
Равна нулю.
-
Возрастает.
-
Уменьшается.
-
Неизменна всегда.
-
Возрастает только при понижении температуры.
-
Уменьшается при постоянстве давления.
ТЗ 23.
В СОСТОЯНИИ РАВНОВЕСИЯ ЭНЕРГИЯ ГЕЛЬМГОЛЬЦА
1. Имеет максимальное значение.
2. Имеет минимальное значение.
3. Равна нулю.
4. Равна нулю при постоянстве температуры.
5. При постоянстве объема равна нулю.
ТЗ 24.
ЭНТАЛЬПИЯ ЗАКРЫТОЙ СИСТЕМЫ БЕЗ ХИМИЧЕСКОГО ПРЕВРАЩЕНИЯ
-
Не изменяется с ростом энтропии.
-
Уменьшается с ростом энтропии.
-
Увеличивается с ростом давления.
-
Уменьшается с ростом давления.
-
Увеличивается с ростом энтропии.
ТЗ 25.
ЕСЛИ ПЕРЕМЕННЫЕ: ОБЪЕМ СИСТЕМЫ, ТЕМПЕРАТУРА И ЧИСЛО МОЛЕЙ КОМПОНЕНТОВ, ТО ХАРАКТЕРИСТИЧЕСКАЯ ФУНКЦИЯ
-
Энергия Гиббса.
-
Энергия Гельмгольца.
-
Энтальпия.
-
Внутренняя энергия.
-
Энтропия.
ТЗ 26.
КРИТЕРИЙ САМОПРОИЗВОЛЬНОСТИ ИЗОБАРНОИЗОТЕРМИЧЕСКОГО ПРОЦЕССА В ЗАКРЫТОЙ СИСТЕМЕ
-
Энергия Гельмгольца.
-
Энергия Гиббса.
-
Энтальпия.
-
Внутренняя энергия.
-
Энтропия.
ТЗ 27.
ХИМИЧЕСКИЙ ПОТЕНЦИАЛ КОМПОНЕНТА k СОВПАДАЕТ С
-
Мольной энергией Гельмгольца.
-
Мольной энергией Гиббса.
-
Парциально-мольной энергией Гельмгольца.
-
Парциально-мольной энергией Гиббса.
-
Парциально-мольной энтальпией.
ТЗ 28.
ХИМИЧЕСКИЙ ПОТЕНЦИАЛ КОМПОНЕНТА ИДЕАЛЬНОГО ГАЗОВОГО РАСТВОРА
1.
![]() .
.
2.
![]() .
.
3.
![]() .
.
4.
![]() .
.
5.
![]() .
.
ТЗ 29.
УРАВНЕНИЕ, ОПИСЫВАЮЩЕЕ ЗАВИСИМОСТЬ ХИМИЧЕСКОГО ПОТЕНЦИАЛА КОМПОНЕНТА НЕИДЕАЛЬНОГО РАСТВОРА ОТ ТЕМПЕРАТУРЫ И СОСТАВА РАСТВОРА
1.
![]() .
.
2.
![]() .
.
3.
![]() .
.
4.
![]()
5.
![]()
ТЗ 30.
УДЕЛЬНЫМ ОБЪЕМОМ ЧИСТОГО ВЕЩЕСТВА k ЯВЛЯЕТСЯ
-
Величина, обратно пропорциональная плотности массы.
-
Отношение мольного объема к плотности массы.
-
Произведение плотности массы на мольную массу.
-
Произведение мольного объема на плотность массы.
-
Удельный объем, умноженный на мольную массу.
ТЗ 31.
ПРИ НАХОЖДЕНИИ ПО МЕТОДУ РОЗЕБОМА ПАРЦИАЛЬНОЙ МОЛЬНОЙ ЭНТАЛЬПИИ ПЕРВОГО КОМПОНЕНТА РАСТВОРА ПОСТОЯННЫ
-
Давление и температура.
-
Давление и энтропия.
-
Объем и температура.
-
Давление, объем и число молей второго компонента.
-
Температура, объем и число молей второго компонента.
ТЗ 32.
МОЛЬНАЯ МАССА БИНАРНОГО РАСТВОРА РАВНА
-
M1N1+M2N2 .
-
M1+M2
-
½(M1+M2)
-
M11+M22
-
(M1+M2)(N1+N2).
ТЗ 33.
ПАРЦИАЛЬНЫЙ МОЛЬНЫЙ ОБЪЕМ ВТОРОГО КОМПОНЕНТА БИНАРНОГО РAСТВОРА ИМЕЕТ РАЗМЕРНОСТЬ
-
м3моль/кг.
-
м3/кг.
-
м3/мольК.
-
м3/моль.
-
моль/м3.
ТЗ 34.
РАЗНОСТЬ МЕЖДУ ПАРЦИАЛЬНЫМ МОЛЬНЫМ ОБЪЕМОМ КОМПОНЕНТА k И МОЛЬНЫМ ОБЪЕМОМ ЧИСТОГО ВЕЩЕСТВА k НАЗЫВАЕТСЯ
-
Парциальным мольным избыточным объемом.
-
Парциальным мольным объемом смешения.
-
Изменением объема системы при смешении.
-
Мольной энтропией смешения.
-
Полным объемом смешения.
ТЗ 35.
ПАРЦИАЛЬНЫЕ МОЛЬНЫЕ ОБЪЕМЫ НАХОДЯТСЯ ПО ЗАВИСИМОСТИ
-
Мольного объема от мольной доли второго компонента.
-
Полного объема от мольной доли второго компонента.
-
Полного объема от числа молей второго компонента.
-
Мольного объема от числа молей второго компонента.
-
Мольного объема от массы второго компонента .
ТЗ 36.
УДЕЛЬНАЯ ИЗОБАРНАЯ ТЕПЛОЕМКОСТЬ ИМЕЕТ РАЗМЕРНОСТЬ
-
Дж/моль.
-
Дж/кг.
-
Дж/К.
-
Дж/кгК.
-
Дж/мольК.
ТЗ 37.
РЕГУЛЯРНЫМИ НАЗЫВАЮТСЯ РАСТВОРЫ, ДЛЯ КОТОРЫХ СПРАВЕДЛИВО СООТНОШЕНИЕ
-
gE = TsE
-
gE = hE
-
gE = TsE – hE
-
gE = hE +TsE
-
gE = hE – TsE .
ТЗ 38.
АТЕРМАЛЬНЫЕ РАСТВОРЫ ОБРАЗОВАНЫ
-
Молекулами, размеры которых сильно различаются.
-
Одинаковыми по размерам молекулами.
-
Молекулами веществ, близких по свойствам.
-
Оптическими изомерами.
-
Веществами при одинаковой температуре.
ТЗ 39.
СООТВЕТСТВИЕ РАЗМЕРНОСТИ ВИДУ ТЕПЛОЕМКОСТИ
1. Удельная. а) Дж/К.
2. Мольная. б) Джмоль/К.
3. Полная. в) Дж/мольК.
г) Дж/кг.
д) Дж/кгК.
е) Дж / моль.
ТЗ 40.
УГЛОВОЙ КОЭФФИЦИНТ КАСАТЕЛЬНОЙ К ГРАФИЧЕСКОЙ ЗАВИСИМОСТИ МОЛЬНОЙ ЭНТАЛЬПИИ РЕАКЦИИ ОТ ТЕМПЕРАТУРЫ
-
Равен полной энтропии реакции.
-
Полной изобарной теплоемкости реакции.
-
Мольной изобарной теплоемкости.
-
Частной производной мольной энтальпии по температуре.
-
Изменению мольной энтропии за счет реакции.
ТЗ 41.
УРАВНЕНИЕ
![]() НАЗЫВАЕТСЯ
НАЗЫВАЕТСЯ
-
Уравнением изотермы ВантГоффа.
-
Уравнением изобары ВантГоффа.
-
Уравнением для расчета дифференциального мольного изменения энергии Гиббса.
-
Уравнением изохоры ВантГоффа.
-
Уравнением для расчета константы равновесия.
ТЗ 42.
СООТВЕТСТВИЕ МЕЖДУ СТЕХИОМЕТРИЧЕСКИМ УРАВНЕНИЕМ ГАЗОВОЙ РЕАКЦИИ И ЗАКОНОМ ХИМИЧЕСКОГО РАВНОВЕСИЯ
1.
A + B = C . а)
![]() .
.
2.
A
= B.
б)
![]() .
.
3.
A
= B
+ C.
в)
![]() .
.
г)
![]() .
.
д)
![]() .
.
е)
![]() .
.
ТЗ 43.
ЗАВИСИМОСТЬ КОНСТАНТЫ РАВНОВЕСИЯ ЭКЗОТЕРМИЧЕСКОЙ РЕАКЦИИ ОТ ТЕМПЕРАТУРЫ
-
1.
2.
3.
4.
5.
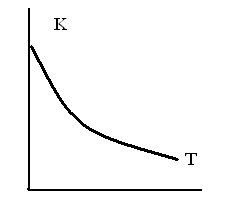
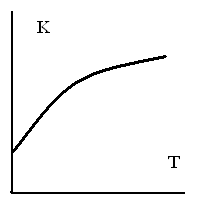
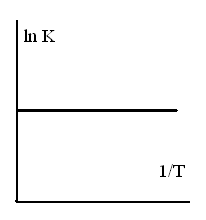
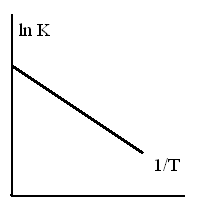

ТЗ 44.
ЗАКОН ДЕЙСТВУЮЩИХ МАСС СФОРМУЛИРОВАЛИ
-
Гиббс и Гельмгольц.
-
Гульдберг и Вааге.
-
Гуггенгейм.
-
Гиббс и Дюгем.
-
Ван дер Ваальс.
ТЗ 45.
ПРАВИЛО РАВНОВЕСИЯ ФАЗ ГИББСА
1.
![]() = k
– f
+2.
= k
– f
+2.
2.
![]() = 2 – k
+ f.
= 2 – k
+ f.
3.
![]() = f
– k
– 2.
= f
– k
– 2.
4.
![]() =
k
– f
– 1.
=
k
– f
– 1.
5.
![]() = f
– 2 + k.
= f
– 2 + k.
ТЗ 46.
ОБЛАСТИ РАВНОВЕСНОГО СОСУЩЕСТВОВАНИЯ ФАЗ НА ДИАГРАММЕ СОСТОЯНИЯ ОДНОКОМПОНЕНТНОЙ СИСТЕМЫ
-
1.
2.
3.
4.
5.
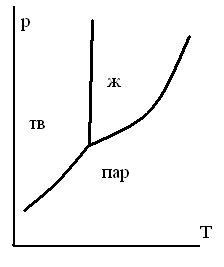
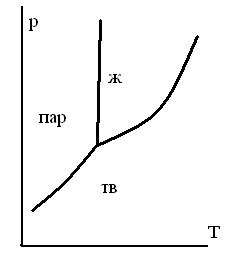
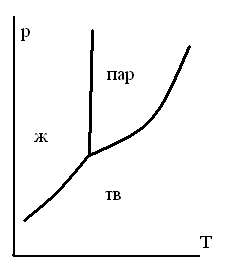
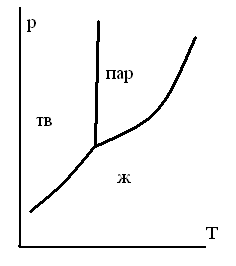
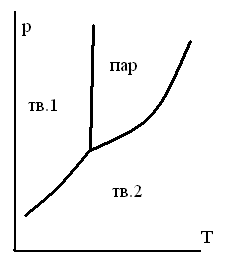
ТЗ 47.
УСЛОВИЯ ФАЗОВОГО РАВНОВЕСИЯ
1.
![]() .
.
2.
![]() .
.
3.
![]() .
.
4.
![]() .
.
5.
![]() .
.
ТЗ 48.
НА ДИАГРАММЕ СОСТОЯНИЯ ДЛЯ ЧИСТОГО ВЕЩЕСТВА ИМЕЮТСЯ ЛИНИИ
-
для равновесия жидкостьпар
-
для равновесия трех фаз
-
для равновесия двух газообразных фаз
-
для равновесия кристаллыпар
-
для равновесия жидкостькристаллы
ТЗ 49.
НА ДИАГРАММЕ СОСТОЯНИЯ ЧИСТОГО ВЕЩЕСТВА ИМЕЮТСЯ СЛЕДУЮЩИЕ ОСОБЫЕ ТОЧКИ
-
точка эвтектики
-
точка азеотропа
-
тройная точка
-
точка кипения
-
точка перитектики
ТЗ 50.
МАТЕМАТИЧЕСКОЕ ВЫРАЖЕНИЕ ЗАКОНА РАУЛЯ
1.
![]() .
.
2.
![]() .
.
3.
![]() .
.
4.
![]() .
.
5.
![]() .
.
ТЗ 51.
ДЛЯ РАСЧЕТА МОЛЬНОЙ ТЕПЛОТЫ ИСПАРЕНИЯ ЖИДКОСТИ ОПЫТНЫЕ ДАННЫЕ НУЖНО ОТОБРАЗИТЬ В КООРДИНАТАХ
1. Абцисса обратное давление, ордината логарифм температуры.
2. Абцисса обратная температура, ордината логарифм давления.
3. Т (ln p ).
4. ln Т р .
5. ln р ln Т .
ТЗ 52.
РАЗНОСТЬ МЕЖДУ ЧИСЛОМ ПЕРЕМЕННЫХ В СИСТЕМЕ И ЧИСЛОМ УРАВНЕНИЙ СВЯЗИ МЕЖДУ ЭТИМИ ПЕРЕМЕННЫМИ
-
Называется вариантностью системы.
-
Равна числу компонентов в системе.
-
Соответствует числу фаз в системе.
-
Равна числу степеней свободы.
-
Равна числу компонентов минус число фаз.
