
РГР по физхимии
.doc
![]() Министерство
образования и науки Российской Федерации
Министерство
образования и науки Российской Федерации
Пермский государственный технический университет
Березниковский филиал
Кафедра Химической технологии и экологии
Расчетная работа по курсу:
«физическая химия»
Выполнил: Студентка гр.ХТНВ – 02(в)
Куриленкова Ю.А.
Проверил:доцент кафедры ХТиЭ
Колбасина В.Д.
Березники
2004
СuO(т) + H2S(г) = СuS (т) + H2O (Ж) Т=725К
|
|
Ноf (298), кДж/моль.
|
Sо(298), Дж/ (моль К) |
а |
b |
с/ |
Gоf(298), кДж/ моль |
|
СuO |
-162.00 |
42,63 |
43,83 |
16,77 |
-5,88 |
-134,26 |
|
H2S |
-20.6 |
205,7 |
29,37 |
15,4 |
- |
-33,5 |
|
СuS |
-53.14 |
66,53 |
44,35 |
11,05 |
- |
-53,58 |
|
H2O |
-285.83 |
69,95 |
39,02 |
76,64 |
11,96 |
-237,23 |
Определим стандартный тепловой эффект образования нашей реакции:
![]()
![]()
Так как![]() <0
то, происходит выделение тепла, реакция
экзотермическая.
<0
то, происходит выделение тепла, реакция
экзотермическая.
Рассчитаем тепловой эффект реакции при заданной температуре 725 К. При этой температуре происходит фазовый переход Н2О(ж)→Н2О (г)
![]()
![]()
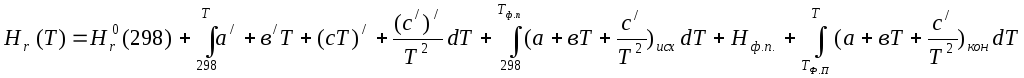
![]()
![]()
а/=а-ан о=10,17-39,02=-28,85
в=11,05+76,64-16,77-15,4=55,52*10-3
в/=55,52-76,64=-21,12*10-3
с=11,96+5,88=17,84*105
с/=5,88*105
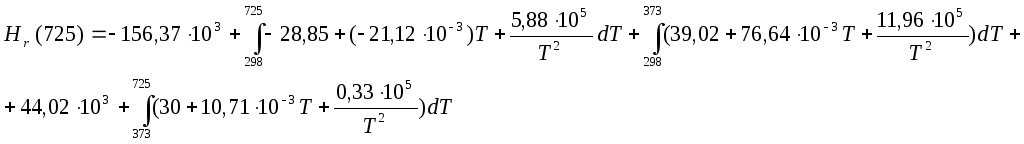
Нr(725)=-156370-28.85(725-298)-21.12*10-3(7252-2982)/2+5,88*105(1/298-1/373)+44020+30(725-373)+10,71*10-3(7252-3732)/2 +0,33*105(1/373-1/725) = -109,711 КДж
При повышении температуры, тепловой эффект понижается за счет фазового перехода воды.
Найдем внутреннюю энергию при стандартных условиях.
Н= U + nRТ
n=nкон – nнач = -1
U = H – nRT =-156.37*103 – ((-1)*8.31*298))= -153,89кДж
Внутренняя энергия при 725 К
U = H – nRT=-109711-(-1*8,31*725)=-103,686 КДж
При увеличении температуры внутренняя энергия увеличивается.
Рассчитаем энтропию в стандартных условиях (справедливо только для идеальных систем)
![]()
![]()
Так как значение энтропии отрицательное то процесс идет в обратном направлении, процесс является не самопроизвольным.
Рассчитаем энтропию при заданной температуре, при этой температуре происходит фазовый переход.
![]()
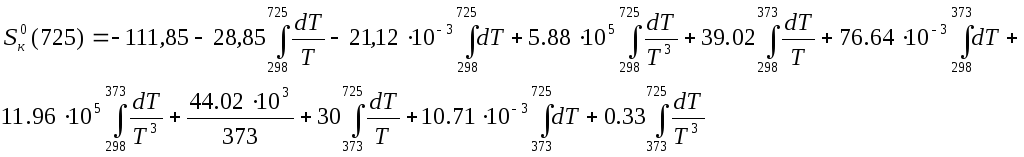
 С
увеличением температуры хаос в системе
увеличивается, и как следствие, энтропия
так же возрастает, процесс самопроизвольный
(Все расчеты энтропии ведутся только
для изолированных систем)
С
увеличением температуры хаос в системе
увеличивается, и как следствие, энтропия
так же возрастает, процесс самопроизвольный
(Все расчеты энтропии ведутся только
для изолированных систем)
Определим энергию Гиббса в стандартных условиях:
![]()
![]()
![]() кДж
кДж
![]()
![]()
G(Т) = -156,37-298(-111,85)=31174.93 Дж=31.174 кДж
Полученное значение энергии Гиббса (G>0) указывает на то, что процесс протекает не самопроизвольно в стандартных условиях
Рассчитаем энергию Гиббса при температуре 725 К.
![]()
![]() =
-109,6 кДж
=
-109,6 кДж
При повышении температуры, энергия Гиббса уменьшается, процесс является самопроизвольным.
Вычислим энергию Гельмгольца в стандартных условиях
F=U-TS=-153.89*103-298*(-111.85)=-120,56кДж
Так как значение энергии Гельмгольца меньше ноля, то протекает самопроизвольный процесс.
Энергия Гельмгольца при 725 К.
F=-103,686*103-725*0.15=-212.44кДж
При повышении температуры, энергия Гельмгольца увеличивается, процесс самопроизвольный.
Вывод:так как в системе протекает экзотермическая реакция (Н<0),энтропия системы при этом возрастает S>0, а энергия Гиббса убывает, то это значит, что реакция в системе может протекать самопроизвольно при любых температурах.
