Степановских Е.И. Тестовые задания для самоконтроля по курсу физической химии [doc]
.doc
ТЗ 53.
ЛИНЕЙНОСТЬ ЭКСПЕРИМЕНТАЛЬНОЙ ЗАВИСИМОСТИ ДАВЛЕНИЯ НАСЫЩЕННОГО ПАРА ЧИСТОГО ВЕЩЕСТВА ОТ ТЕМПЕРАТУРЫ В КООРДИНАТАХ 1/T ln p
-
Свидетельствует о выполнимости уравнения МенделееваКлапейрона.
-
Подтверждает выполнимость уравнения ГиббсаГельмгольца.
-
Говорит о выполнимости уравнения КлаузиусаКлапейрона.
-
Указывает на выполнимость уравнения КлаузиусаМоссотти.
-
Позволяет определить мольную теплоту испарения.
ТЗ 54.
ЭКЗОТЕРМИЧЕСКИМИ НАЗЫВАЮТ ПРОЦЕССЫ, В КОТОРЫХ
-
Теплота смешения положительна.
-
Энтальпия смешения отрицательна.
-
Объем смешения положителен.
-
Изменение энтальпии при смешении отрицательно.
-
Мольная теплота смешения положительна.
ТЗ 55.
В ОДНОКОМПОНЕНТНОЙ СИСТЕМЕ УРАВНЕНИЕ КЛАУЗИУСА КЛАПЕЙРОНА ХАРАКТЕРИЗУЕТ ЗАВИСИМОСТЬ
1. Давления от температуры при равновесии двух фаз.
2. Температуры тройной точки от давления.
3. Критической температуры от давления.
4. Координат тройной точки от критической температуры.
5. Давления от состава раствора.
ТЗ 56.
УРАВНЕНИЕ ШРЕДЕРА СПРАВЕДЛИВО ДЛЯ
-
Азеотропных растворов.
-
Для эвтектических смесей.
-
Систем, при замерзании которых образуются твердые растворы.
-
Систем, твердая фаза которых состоит из чистого растворителя.
-
Систем, при замерзании которых образуются кристаллы растворителя.
ТЗ 57.
С УВЕЛИЧЕНИЕМ КОНЦЕНТРАЦИИ РАСТВОРЕННОГО ВЕЩЕСТВА ТЕМПЕРАТУРА КРИСТАЛЛИЗАЦИИ РАСТВОРА
1. Убывает.
2. Растет пропорционально квадрату концентрации.
3. Не меняется.
4. Убывает по экспоненциальному закону.
5. Растет по экспоненциальному закону.
ТЗ 58.
КРИОСКОПИЧЕСКИЙ МЕТОД ИССЛЕДОВАНИЯ ОСНОВАН
1. На связи между температурой кристаллизации и температурой кипения .
2. На зависимости состава жидкой фазы от состава кристаллов.
3. На зависимости температуры кипения от состава жидкой фазы.
4. На зависимости температуры кристаллизации от давления в жидкой фазе.
5. На зависимости температуры кристаллизации от состава жидкой фазы.
ТЗ 59.
ТЕМПЕРАТУРА КРИСТАЛЛИЗАЦИИ ЛИНЕЙНО ЗАВИСИТ ОТ КОНЦЕНТРАЦИИ ВТОРОГО КОМПОНЕНТА
1. Для концентрированных идеальных растворов.
2. Для концентрированных реальных растворов.
3. Для идеальных разбавленных растворов.
4. Для неидеальных растворов.
5. Для совершенных растворов.
ТЗ 60.
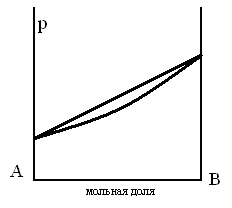
ПАРОЖИДКОСТНАЯ ДИАГРАММА СОСТОЯНИЯ БИНАРНОЙ СИСТЕМЫ ДЛЯ СЛУЧАЯ, КОГДА ЖИДКОСТЬ ПРЕДСТАВЛЯЕТ СОБОЙ ИДЕАЛЬНЫЙ РАСТВОР
-
1.
2.
3.
4.
5.




ТЗ 61
ДЛЯ РАСЧЕТА КРИОСКОПИЧЕСКОЙ ПОСТОЯННОЙ НЕОБХОДИМО ЗНАТЬ
-
Мольную массу растворенного вещества.
-
Мольную массу растворителя.
-
Универсальную газовую постоянную.
-
Температуру кристаллизации чистого растворителя.
-
Постоянную Планка.
ТЗ 62.
ДИАГРАММА ПАРОЖИДКОСТНОГО РАВНОВЕСИЯ «ТЕМПЕРАТУРАСОСТАВ» СООТВЕТСТВУЕТ СЕЧЕНИЮ ОБЪЕМНОЙ ДИАГРАММЫ
-
T = const
-
p = const
-
N2 = const
-
Изотермическому.
-
Изобарическому.
ТЗ 63.
АЗЕОТРОПНЫЙ РАСТВОР ЭТО РАСТВОР
-
Пар над которым имеет тот же состав, что и жидкость.
-
Пар над которым более обогащен легколетучим компонентом.
-
Имеющий самую большую мольную массу.
-
Нелетучего вещества.
-
Соответствующий точке эвтектики.
ТЗ 64.
ПО ПЕРВОМУ ЗАКОНУ КОНОВАЛОВА ПАР ПО СРАВНЕНИЮ С ЖИДКОСТЬЮ ОБОГАЩЕН
-
Менее легколетучим компонентом.
-
Более легколетучим компонентом.
-
Компонентом, у которого больше мольная масса.
-
Компонентом, у которого меньше мольная масса.
-
Компонентом, у которого выше температура кипения.
ТЗ 65.
НА ДИАГРАММЕ КИПЕНИЯ ЧИСЛО СТЕПЕНЕЙ СВОБОДЫ РАВНО НУЛЮ
-
В любой точке на осях ординат.
-
В точке кипения чистых компонентов.
-
В точке азеотропа.
-
В любой точке на линии конденсации.
-
В любой точке на линии кипения.
ТЗ 66.
ТОЧКА ЭВТЕКТИКИ НА ДИАГРАММЕ ПЛАВКОСТИ БИНАРНОЙ СИСТЕМЫ С ПРОСТОЙ ЭВТЕКТИКОЙ СООТВЕТСТВУЕТ РАВНОВЕСИЮ
-
Двух фаз: кристаллы А+ кристаллы В.
-
Трех фаз: кристаллы А + кристаллы В + расплав.
-
Трех фаз: кристаллы А + кристаллы В + кристаллы твердого раствора.
-
Двух фаз: кристаллы А + расплав.
-
Двух фаз: кристаллы В + расплав.
ТЗ 67.
НА ДИАГРАММЕ ПЛАВКОСТИ СИСТЕМЫ С НЕОГРАНИЧЕННОЙ РАСТВОРИМОСТЬЮ В ЖИДКОМ И ТВЕРДОМ СОСТОЯНИЯХ ВАРИАНТНОСТЬ СИСТЕМЫ
-
Равна нулю в любой точке гетерогенной области диаграммы.
-
Равна нулю в любой точке на линии ликвидуса.
-
В любой точке на линии солидуса равна нулю.
-
Равна 0 в точке температуры плавления чистого компонента А.
-
Равна 0 в точке температуры плавления чистого компонента В.
ТЗ 68.
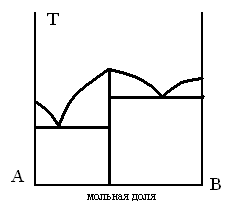
ДИАГРАММА ПЛАВКОСТИ БИНАРНОЙ СИСТЕМЫ, В КОТОРОЙ ЕСТЬ ОБЛАСТЬ, СОДЕРЖАЩАЯ КРИСТАЛЛЫ ДВУХ ЧИСТЫХ КОМПОНЕНТОВ
-
1.
2.
3.
4.
5.
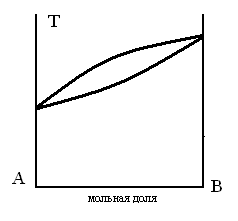
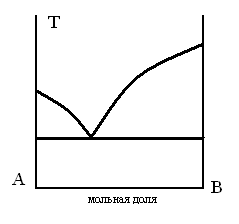


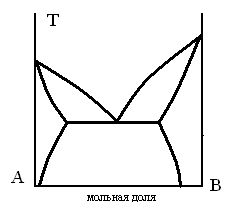
ТЗ 69.
НИЖЕ ЛИНИИ СОЛИДУСА В СИСТЕМАХ С НЕОГРАНИЧЕННОЙ РАСТВОРИМОСТЬЮ ВЕЩЕСТВ В ЖИДКОМ И ТВЕРДОМ СОСТОЯНИЯХ
-
Образуются смешанные кристаллы.
-
Образуются твердые растворы внедрения.
-
Существует смесь кристаллов чистых компонентов.
-
Находятся твердые растворы замещения.
-
Образуются устойчивые химические соединения.
ТЗ 70.
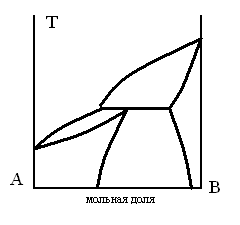
ДИАГРАММА ПЛАВКОСТИ БИНАРНОЙ СИСТЕМЫ, В КОТОРОЙ НАБЛЮДАЕТСЯ ОБРАЗОВАНИЕ ХИМИЧЕСКОГО СОЕДИНЕНИЯ
-
1.
2.
3.
4.
5.


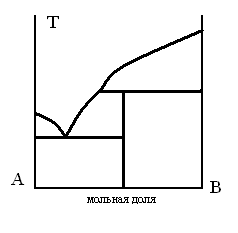
ТЗ 71.
КРИВОЙ ОХЛАЖДЕНИЯ НАЗЫВАЕТСЯ
-
Зависимость температуры охлаждающейся смеси от времени.
-
Зависимость температуры охлаждающейся смеси от давления.
-
Зависимость мольной массы охлаждающейся смеси от времени.
-
Вертикальная линия на диаграмме плавкости при определенной мольной доле.
-
Совокупность линий на диаграмме плавкости.
ТЗ 72.
ОТНОСИТЕЛЬНЫЕ КОЛИЧЕСТВА ФАЗ, НАХОДЯЩИХСЯ В РАВНОВЕСИИ, НАХОДЯТ
-
По правилу рычага.
-
По правилу фаз Гиббса.
-
По правилу Розебома.
-
По правилу отрезков.
-
По уравнению Шредера.
ТЗ 73.
ДЛЯ ИЗМЕРЕНИЯ ЭЛЕКТРОПРОВОДНОСТИ РАСТВОРОВ ИСПОЛЬЗУЕТСЯ
1. Мост постоянного тока.
2. Мост переменного тока.
3. Мост Кольрауша.
4. Потенциометр.
5. Потенциостат.
ТЗ 74.
РЕЗКОЕ ПАДЕНИЕ ЭЛЕКТРОПРОВОДНОСТИ РАСТВОРА ПРИ НЕЙТРАЛИЗАЦИИ КИСЛОТЫ ЩЕЛОЧЬЮ СВЯЗАНО
1. С уменьшением суммарной концентрации ионов.
2. С уменьшением концентрации очень подвижных ионов гидроксония.
3. С накоплением в системе ионов гидроксила.
4. С образованием осадка.
5. C разбавлением раствора.
ТЗ 75.
ИЗВЕСТНЫ СЛЕДУЮЩИЕ МЕТОДЫ ИЗМЕРЕНИЯ ЭДС ГАЛЬВАНИЧЕСКОГО ЭЛЕМЕНТА
1. Потенциометрический.
2. Полярографический.
3. Метод вольтметра с высоким внутренним сопротивлением.
4. Компенсационный.
5. Кондукторометрический.
ТЗ 76.
ДЛЯ НОРМАЛЬНО РАЗОМКНУТОГО ГАЛЬВАНИЧЕСКОГО ЭЛЕМЕНТА ЭЛЕКТРОДИВЖУЩАЯ СИЛА РАВНА
1. Разности электродных потенциалов на выводах ГЭ.
2. Падению напряжения на внешнем участке цепи с гальваническим элементом.
3. Напряжению на выводах работающего элемента.
4. Произведению тока на сумму сопротивлений
5. Полусумме произведений квадратов зарядов частиц на концентрацию.
ТЗ 77.
ВЕЛИЧИНУ ЭДС ГАЛЬВАНИЧЕСКОГО ЭЛЕМЕНТА МОЖНО РАССЧИТАТЬ
1. С помощью уравнения Фарадея.
2. С помощью уравнения Фрумкина.
3. С помощью уравнения Нернста.
4. С помощью уравнения Гиббса-Дюгема.
5. Как разность условных электродных потенциалов.
ТЗ 78.
ДЛЯ РАСЧЕТА ЭДС С ПОМОЩЬЮ УРАВНЕНИЯ НЕРНСТА НЕОБХОДИМО ЗНАТЬ
1. Стандартную ЭДС элемента и температуру.
2. ЭДС нормального элемента Вестона.
3. Стехиометрическое уравнение реакции в элементе.
4. Электропроводность растворов, входящих в состав элемента.
5. Атмосферное давление.
ТЗ 79.
ЗНАЧЕНИЯ СРЕДНИХ ИОННЫХ КОЭФФИЦИЕНТОВ АКТИВНОСТИ ЭЛЕКТРОЛИТОВ
1. Берутся из справочника.
2. Рассчитываются по уравнению Нернста.
3. Рассчитываются по уравнению Клаузиуса-Моссотти.
4. Рассчитываются по уравнению Гиббса-Дюгема.
5. Рассчитываются по уравнению Дебая-Гюккеля.
ТЗ 80.
ЧИСЛО Z, ВХОДЯЩЕЕ В УРАВНЕНИЕ НЕРНСТА СООТВЕТСТВУЕТ
1. Числу электронов, участвующих в реакции.
2. Числу электродных реакций.
4. Зарядовому числу анионов в растворе.
5. Зарядовому числу ионов гидроксония.
6. Произведению зарядовых чисел катионов и анионов.
ТЗ 81.
ИСПОЛЬЗУЕМЫЙ В ХИНГИДРОННОМ ЭЛЕКТРОДЕ ХИНГИДРОН ПРЕДСТАВЛЯЕТ СОБОЙ
1. Эквимолекулярное соединение хинона и гидроксиламина.
2. Легко растворимая смесь хинона и гидроокиси хрома.
3. Малорастворимое соединение.
4. Малорастворимое соединение хинона со следами гидрохинона.
5. Эквимолекулярное соединение хинона и гидрохинона.
ТЗ 82.
ИОННЫМ ПРОИЗВЕДЕНИЕМ ВОДЫ НАЗЫВАЕТСЯ
1. Натуральный логарифм активности ионов гидроксония.
2. Произведение активностей всех ионов в растворе.
3. Произведение активностей ионов гидроксония и гидроксила.
4. Отрицательный логарифм активности ионов гидроксила.
5. Десятичный логарифм произведение активностей всех ионов.
ТЗ 83.
КАЛОМЕЛЬНЫЙ ЭЛЕКТРОД ОТНОСИТСЯ К
1. Окислительновосстановительным.
2. Электродам 1 рода.
3. Электродам 2 рода.
4. Электродам сравнения.
5. Ионообменным электродам.
ТЗ 84.
ОБРАЗОВАНИЕ ПОТЕНЦИАЛА СТЕКЛЯННОГО ЭЛЕКТРОДА ПРОИСХОДИТ ЗА СЧЕТ
1. Ионообменных процессов.
2. Окислительно-восстановительных процессов.
3. Процессов растворимости стекла.
4. Процессов адсорбции ионов на стекле.
5. Обмена между ионами в стекле и в растворе.
ТЗ 85.
ВОДОРОДНЫМ ПОКАЗАТЕЛЕМ СРЕДЫ НАЗЫВАЕТСЯ
1. Отрицательный десятичный логарифм концентрации ионов гидроксония.
2. Отрицательный натуральный логарифм концентрации ионов гидроксония.
3. Десятичный логарифм концентрации ионов гидроксония.
4. Натуральный логарифм концентрации ионов гидроксония.
5. Произведение концентраций ионов гидроксония и гидроксила.
ТЗ 86.
СООТВЕТСТВИЕ СХЕМАТИЧНОГО ИЗОБРАЖЕНИЯ ЭЛЕКТРОДА ЕГО ТИПУ
1. Cu2+|Cu. а) ионообменный
2. Cl,AgClТВ, Ag . б) электрод первого рода
3. H3O+|H2,Pt . в) газовый электрод
г) ионселективный
д) электрод второго рода
е) металлоокисный
ТЗ 87.
ЭЛЕКТРОЛИТИЧЕСКИЙ КЛЮЧ, СЛУЖАЩИЙ ДЛЯ ЭЛИМИНИРОВАНИЯ ДИФФУЗИОННОГО ПОТЕНЦИАЛА,
-
Заполнен дистиллированной водой.
-
Содержит ионы с одинаковой подвижностью.
-
Содержит ионы в аномальной подвижностью.
-
Заполнен исследуемым раствором.
-
Содержит раствор хлористого калия.
ТЗ 88.
МЕТАЛЛ, ИСПОЛЬЗУЕМЫЙ В ГАЗОВЫЙ ЭЛЕКТРОДАХ ДОЛЖЕН
-
Участвовать в электродной реакции.
-
Быть инертным к электродной реакции.
-
Хорошо сорбировать газы.
-
Полностью исключать сорбцию газов.
-
Иметь сильно развитую поверхность.
ТЗ 89.
ЗНАЧЕНИЕ КОНСТАНТ СКОРОСТИ РЕАКЦИИ ЗАВИСИТ
1. От температуры.
2. От концентрации реагентов.
3. От вида растворителя.
4. От концентрации продуктов.
5. От давления.
ТЗ 90.
КОНСТАНТА СКОРОСТИ РЕАКЦИИ ПРИ УВЕЛИЧЕНИИ ТЕМПЕРАТУРЫ
1. Возрастает по экспоненциальному закону.
2. Убывает по экспоненциальному закону.
3. Возрастает в соответствии с уравнением Аррениуса.
4. Убывает с ростом температуры.
5. Растет пропорционально квадрату температуры.
ТЗ 91.
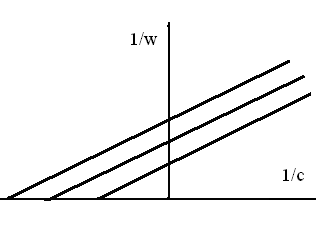
СПРАВЕДЛИВОСТЬ ПРЕДЛОЖЕННОГО КИНЕТИЧЕСКОГО УРАВНЕНИЯ
![]() ОПРЕДЕЛЯЮТ
ОПРЕДЕЛЯЮТ
1. По линейности графика "времялогарифм концентрации реагента".
2. По линейности графика "времяквадрат концентрации реагента".
3. По предельному значению концентрации реагента.
4. По линейности графика "времяобратная концентрация реагента".
5. По линейности графика "концентрация реагентавремя".
ТЗ 92.
РАЗМЕРНОСТЬ КОНСТАНТЫ СКОРОСТИ РЕАКЦИИ ПЕРВОГО ПОРЯДКА
1. м/с.
2. 1/с.
3. м3/(мольс).
4. м6/(моль2с).
5. с/м.
ТЗ 93.
ИНТЕГРАЛЬНОЕ КИНЕТИЧЕСКОЕ УРАВНЕНИЕ РЕАКЦИИ ПЕРВОГО ПОРЯДКА
1.
![]()
2.
![]()
3.
![]()
4.
![]()
5.
![]()
ТЗ 94.
ВРЕМЯ
ПОЛУПРЕВРАЩЕНИЯ В РЕАКЦИИ ВТОРОГО
ПОРЯДКА ВИДА
![]()
1.
![]()
2.
![]()
3.
![]()
4.
![]()
5.
![]()
ТЗ 95.
СООТВЕТСТВИЕ МЕЖДУ ПОРЯДКОМ РЕАКЦИИ И КООРДИНАТАМИ ГРАФИКА, В КОТОРОМ ОПЫТНЫЕ ДАННЫЕ ЭТОЙ РЕАКЦИИ ЛИНЕЙНЫ
1.
первый а)
![]()
2.
второй б)
![]()
3.
третий в)
![]()
г)
![]()
д)
![]()
ТЗ 96.
СООТВЕТСТВИЕ СТЕХИОМЕТРИЧЕСКОГО УРАВНЕНИЯ РЕАКИИ И КИНЕТИЧЕСКОГО ЗАКОНА ДЕЙСТВУЮЩИХ МАСС
1.
A = B а)
![]()
2.
A + B = C б)
![]()
3.
2A +B = C + D в)
![]()
г)
![]()
д)
![]()
е)
![]()
ТЗ 97.
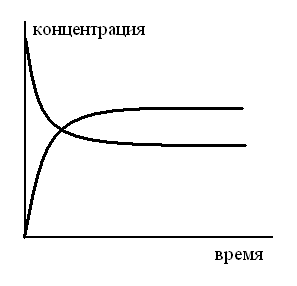
СООТВЕТСТВИЕ ВИДА СЛОЖНОЙ РЕАКЦИИ ПЕРВОГО ПОРЯДКА КИНЕТИЧЕСКОЙ СХЕМЕ
1.
Параллельная а)
A
![]() B
B
![]() C.
C.
2.
Последовательная б)
2A![]() C.
C.
3.
Двусторонняя в)
A![]() B;
B
B;
B![]() A.
A.
г)
A![]() B;
2B
B;
2B![]() C
C
д) A![]() B;
A
B;
A![]() C.
C.
е)
2A![]() B
B![]() C.
C.
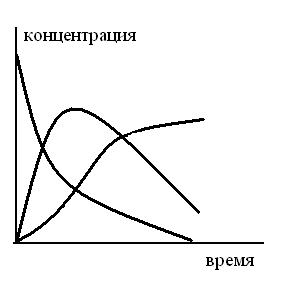
ТЗ 98.
КИНЕТИЧЕСКАЯ КРИВАЯ ПРОМЕЖУТОЧНОГО ПРОДУКТА МОНОМОЛЕКУЛЯРНОЙ ПОСЛЕДОВАТЕЛЬНОЙ РЕАКЦИИ ИМЕЕТ ВИД
1.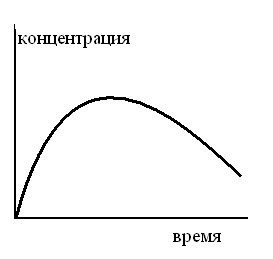
2.
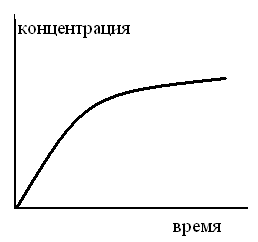
3.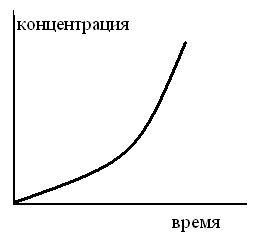
4.

5.

ТЗ 99.
СООТВЕТСТВИЕ КИНЕТИЧЕСКИХ КРИВЫХ МОНОМОЛЕКУЛЯРНОЙ РЕАКЦИИ ТИПУ СЛОЖНОЙ РЕАКЦИИ
|
1.
2.
3. |
|
а) параллельная б) конкурентная в) каталитическая г) последовательная д) обратимая
|
ТЗ 100.
СООТВЕТСТВИЕ РАСПОЛОЖЕНИЯ ОПЫТНЫХ ДАННЫХ В ДВОЙНЫХ ОБРАТНЫХ КООРДИНАТАХ ТИПУ ИНГИБИРОВАНИЯ
|
1.
2.
3. |
|
а) бесконкурентное б) конкурентное в) гомолитическое г) неконкурентное д) гетероциклическое е) негомолитическое
|
Библиографический список
-
Краснов К.С. Физическая химия: учеб. для вузов. в 2 кн. / К.С. Краснов и др./ под общ. ред. К.С. Краснова. 2-е изд., перераб. и доп. М. : Высш. шк., 2000. Кн. 1. 512 с.
-
Стромберг А.Г. Физическая химия / А.Г. Стромберг, Д.П.Семченко; под ред. А.Г.Стромберга. 5-е изд., исправленное. М. : Высш. шк., 2003. 527 с.
-
Основы физической химии. Теория и задачи: Учеб. Пособие для вузов / В.В.Еремин, С.И.Каргов, И.А.Успенская, Н.Е.Кузьменко, В.В.Лунин.М.: Издательство «Экзамен», 2005. -480 с.
-
Горшков В.И. Основы физической химии / В.И.Горшков, И.А.Кузнецов. М.: БИНОМ. Лаборатория знаний. 2006. – 407 с.
-
Байрамов В.М. Основы химической кинетики и катализа / В.М.Байрамов. под ред. В.В.Лунина. М.: изд. центр «Академия», 2003. – 256 с.
-
Романовский Б.В. Основы химической кинетики: учебник/ Б.В.Романовский М.: Издательство «Экзамен». 415 с.
ФИЗИЧЕСКАЯ ХИМИЯ: тестовые задания для самоконтроля
Составитель Степановских Елена Ивановна