
- •Министерство образования и науки российской федерации
- •Введение
- •Лекция 1
- •Раздел 1 Техническая термодинамика. Основные понятия и определения
- •Термодинамическая система
- •Термодинамические параметры состояния
- •Уравнение состояния
- •Термодинамический процесс
- •Теплоемкость газов
- •Лекция 2 Раздел 2 Первый закон термодинамики Смеси идеальных газов
- •Аналитическое выражение первого закона термодинамики
- •Лекция 3 Внутренняя энергия
- •Работа расширения
- •Теплота
- •Энтальпия
- •Энтропия
- •Лекция 4
- •Раздел 3. Второй закон термодинамики Общая формулировка второго закона термодинамики
- •Обратный цикл Карно
- •Изменение энтропии в неравновесных процессах
- •Лекция 5
- •Раздел 4. Термодинамические процессы Термодинамические процессы идеальных газов в закрытых системах
- •Так как для политропы в соответствии с (5.1)
- •Эксергия
- •Лекция 6 Термодинамические процессы реальных газов
- •Уравнение состояния реальных газов
- •Лекция 7
- •Раздел 5. Термодинамика потока. Истечение жидкостей, паров и газов Уравнение первого закона термодинамики для потока
- •Истечение из суживающегося сопла
- •Основные закономерности течения газа в соплах и диффузорах
- •Разделив уравнение на pv, найдем
- •Расчет процесса истечения с помощью h,s-диаграммы
- •Дросселирование газов и паров
- •Лекция 8 Раздел 6. Процессы и циклы энергетических установок Термодинамическая эффективность циклов теплосиловых установок
- •Лекция 9 Циклы поршневых двигателей внутреннего сгорания
- •Циклы газотурбинных установок
- •Циклы паротурбинных установок
- •Цикл Ренкина на перегретом паре
- •Термический кпд цикла
- •Общая характеристика холодильных установок
- •Цикл паровой компрессионной холодильной установки
- •Лекция 9
- •Раздел 7. Теория теплообмена
- •Основные понятия и определения
- •Лекция 10
- •Раздел 8. Теплопроводность Теория теплопроводности Закон Фурье
- •О tднослойная плоская стенка
- •Многослойная плоская стенка
- •Лекция 11 Теплопроводность при стационарном режиме в однослойной и многослойной стенках различной конфигурации. Однородная цилиндрическая стенка
- •Многослойная цилиндрическая стенка
- •ЛекцИя 12
- •Раздел 9. Теплопередача
- •Плоская стенка
- •Цилиндрическая стенка
- •Интенсификация теплопередачи
- •Тепловая изоляция
- •ЛекцИя 13
- •Расчетные уравнения
- •Лекция 14
- •Раздел 10. Конвективный теплообмен (кто) Конвективный теплообмен (теплоотдача) Основной закон конвективного теплообмена
- •Пограничный слой
- •Числа подобия
- •Лекция 14 Основы массообмена
- •Числа подобия конвективного массообмена
- •Частные случаи конвективного теплообмена Поперечное обтекание одиночной трубы и пучка труб
- •Лекция 16
- •Раздел 11. Теплообмен излучением Описание процесса излучения. Основные определения
- •Теплообмен излучением системы тел в прозрачной среде
- •Перенос лучистой энергии в поглощающей и излучающей среде
- •Лекция 14 лекция 15 Термодинамический анализ топливосжигающих устройств
- •Полезная тепловая нагрузка печи
- •Расчет процесса горения топлива в печи
- •Тепловой баланс печи. Коэффициент полезного действия. Расход топлива
- •Лекция 16 Котельные установки. Общие сведения
- •Устройство парового котла
- •Тепловой баланс парового котла. Коэффициент полезного действия
- •Лекция 17 Состав и основные характеристики жидкого топлива
- •Состав и основные характеристики газообразного топлива
- •Теплота сгорания топлива
- •Количество воздуха, необходимого для горения. Теплота “сгорания” воздуха
- •Объемы и состав продуктов сгорания
- •Лекция 18 Вторичные энергоресурсы Классификация вэр
- •Установки для внутреннего теплоиспользования
- •Котлы-утилизаторы
- •Список использованных источников
Уравнение состояния реальных газов
В реальных газах в отличие от идеальных существенны силы межмолекулярных взаимодействий (силы притяжения, когда молекулы находятся на значительном расстоянии, и силы отталкивания при достаточном сближении их друг с другом) и нельзя пренебречь собственным объемом молекул.
Наличие
межмолекулярных сил отталкивания
приводит к тому, что молекулы
могут сближаться между собой только
до некоторого минимального расстояния.
Поэтому можно считать, что свободный
для движения молекул объем будет равен
![]() ,
где
b
—
тот наименьший объем,
до которого можно сжать газ. В
соответствии с этим длина свободного
пробега
молекул уменьшается и число ударов
о стенку в единицу времени, а
следовательно, и давление увеличивается
по сравнению с идеальным газом в отношении
,
где
b
—
тот наименьший объем,
до которого можно сжать газ. В
соответствии с этим длина свободного
пробега
молекул уменьшается и число ударов
о стенку в единицу времени, а
следовательно, и давление увеличивается
по сравнению с идеальным газом в отношении
![]() ,
т. е.
,
т. е.
![]() .
.
Силы притяжения действуют в том же направлении, что и внешнее давление, и приводят к возникновению молекулярного (или внутреннего) давления. Сила молекулярного притяжения каких-либо двух малых частей газа пропорциональна произведению числа молекул в каждой из этих частей, т. е. квадрату плотности, поэтому молекулярное давление обратно пропорционально квадрату удельного объема газа: рмол = а/v2, где а — коэффициент пропорциональности, зависящий от природы газа.
Отсюда получаем уравнение Ван-дер-Ваальса (1873 г.):
![]() ,
,
 или
или
![]() .
.
При больших удельных объемах и сравнительно невысоких давлениях реального газа уравнение Ван-дер-Ваальса практически вырождается в уравнение состояния идеального газа Клапейрона, ибо величина a/v2
(по сравнению с p) и b (по сравнению с v) становятся пренебрежимо малыми.
Уравнение Ван-дер-Ваальса с качественной стороны достаточно хорошо описывает свойства реального газа, но результаты численных расчетов не всегда согласуются с экспериментальными данными. В ряде случаев эти отклонения объясняются склонностью молекул реального газа к ассоциации в отдельные группы, состоящие из двух, трех и более молекул. Ассоциация происходит вследствие несимметричности внешнего электрического поля молекул. Образовавшиеся комплексы ведут себя как самостоятельные нестабильные частицы. При столкновениях они распадаются, затем вновь объединяются уже с другими молекулами и т. д. По мере повышения температуры концентрация комплексов с большим числом молекул быстро уменьшается, а доля одиночных молекул растет. Большую склонность к ассоциации проявляют полярные молекулы водяного пара.
Лекция 7
Раздел 5. Термодинамика потока. Истечение жидкостей, паров и газов Уравнение первого закона термодинамики для потока
Под открытыми понимаются термодинамические системы, которые кроме обмена теплотой и работой с окружающей средой допускают также и обмен массой. В технике широко используются процессы преобразования энергии в потоке, когда рабочее тело перемещается из области с одними параметрами в область с другими. Это, например, расширение пара в турбинах, сжатие газов в компрессорах.
Будем рассматривать лишь одномерные стационарные потоки, в которых параметры зависят только от одной координаты, совпадающей с направлением вектора скорости, и не зависят от времени. Условие неразрывности течения в таких потоках заключается в одинаковости массового расхода m рабочего тела в любом сечении:
![]() ,
,
где F — площадь поперечного сечения канала; с — скорость рабочего тела.
Рассмотрим термодинамическую систему, представленную схематически на рисунке 7.1.

Рисунок 7.1 - Открытая термодинамическая система
По трубопроводу 1 рабочее тело с параметрами Т1 , p1, v1 подается со скоростью c1 в тепломеханический агрегат 2 (двигатель, паровой котел, компрессор и т. д.). Здесь каждый килограмм рабочего тела в общем случае может получать от внешнего источника теплоту q и совершать техническую работу lтех, например, приводя в движение ротор турбины, а затем удаляется через выхлопной патрубок со скоростью с2, имея параметры Т2 , p2, v2.
Если
в потоке мысленно выделить замкнутый
объем рабочего тела и наблюдать
за изменением его параметров в процессе
перемещения, то для описания
его поведения будут пригодны все
полученные выше термодинамические
соотношения
и, в частности, первый закон термодинамики
в обычной записи:
![]() .
.
Внутренняя энергия есть функция состояния рабочего тела, поэтому значение определяется параметрами рабочего тела при входе (сечение потока I), а значение — параметрами рабочего тела при выходе из агрегата (сечение II).
Работа расширения
l
совершается рабочим
телом на поверхностях, ограничивающих
выделенный движущийся объем, т. е. на
стенках агрегата и границах,
выделяющих этот объем в потоке. Часть
стенок агрегата неподвижна, и работа
расширения на них равна нулю. Другая
часть стенок специально делается
подвижной (рабочие лопатки в турбине
и компрессоре, поршень в поршневой
машине), и
рабочее тело совершает на них техническую
работу ![]()
При входе рабочее
тело вталкивается в агрегат. Для этого
нужно преодолеть давление p1.
Поскольку
p1=const,
то каждый килограмм рабочего тела может
занять объем
лишь при
затрате работы, равной
![]() .
.
Для того чтобы
выйти в трубопровод 3,
рабочее тело
должно вытолкнуть из него
такое же количество рабочего тела, ранее
находившегося в нем, преодолев давление
р2,
т. е. каждый килограмм, занимая
объем v2
должен
произвести определенную
работу выталкивания ![]() .
.
Сумма
![]() называется работой
вытеснения.
называется работой
вытеснения.
Если
скорость
на
выходе больше, чем
на
входе, то часть работы расширения
будет затрачена на увеличение кинетической
энергии рабочего тела в потоке,
равное
![]() .
.
Наконец, в неравновесном процессе некоторая работа может быть затрачена на преодоление сил трения. Окончательно
![]() .
.
Теплота,
сообщенная каждому килограмму
рабочего тела во время прохождения
его через агрегат, складывается из
теплоты ![]() ,
подведенной снаружи, и
теплоты
,
подведенной снаружи, и
теплоты ![]() ,
в которую переходит работа
трения внутри агрегата, т. е.
,
в которую переходит работа
трения внутри агрегата, т. е.
![]() .
.
Подставив полученные значения q и l в уравнение первого закона термодинамики, получим
![]() .
.
Поскольку теплота трения равна работе трения, окончательно запишем:
![]() .
.
Это и есть выражение первого закона термодинамики для потока, который можно сформулировать так: теплота, подведенная к потоку рабочего тела извне, расходуется на увеличение энтальпии рабочего тела, производство технической работы и увеличение кинетической энергии потока.
В дифференциальной форме уравнение записывается в виде
![]() .
(7.1)
.
(7.1)
Оно справедливо как для равновесных процессов, так и для течений, сопровождающихся трением.
Выше
было указано, что к замкнутому
объему рабочего тела, выделенному в
потоке, применимо выражение первого
закона
термодинамики для закрытой системы,
т.е.
![]() .
.
Сравнивая это выражение с уравнением *, получим:
![]() ,
или
,
или
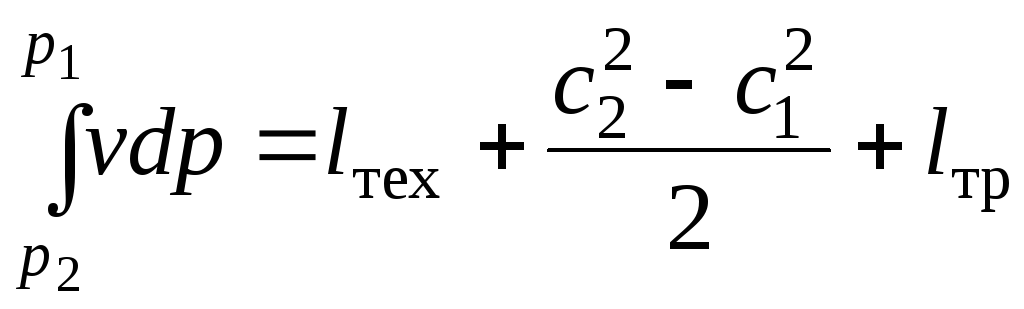 .
.
Величину ![]() называют располагаемой работой.
В p,
v-диаграмме
она изображается заштрихованной
площадью.
называют располагаемой работой.
В p,
v-диаграмме
она изображается заштрихованной
площадью.
Применим первый закон термодинамики к различным типам тепломеханического оборудования.
Теплообменный
аппарат (устройство,
в котором теплота от жидкой или
газообразной среды передается другой
среде). Для него ![]() =0,
a
=0,
a
![]() ,
поэтому
,
поэтому
![]() .
.
Следует подчеркнуть, что для теплообменника, установленного в потоке, это выражение справедливо не только в изобарном процессе, но и в процессе с трением, когда давление среды уменьшается из-за сопротивления.
Тепловой двигатель.
Обычно![]() ,
поэтому рабочее тело производит
техническую работу за счет уменьшения
энтальпии:
,
поэтому рабочее тело производит
техническую работу за счет уменьшения
энтальпии:
![]() .
(7.2)
.
(7.2)
Величину
![]() называют располагаемым
теплоперепадом.
называют располагаемым
теплоперепадом.
Интегрируя уравнение
![]() отp1
до p2
и от h1
до h2
для случая,
когда
отp1
до p2
и от h1
до h2
для случая,
когда ![]() =0,
получим
=0,
получим
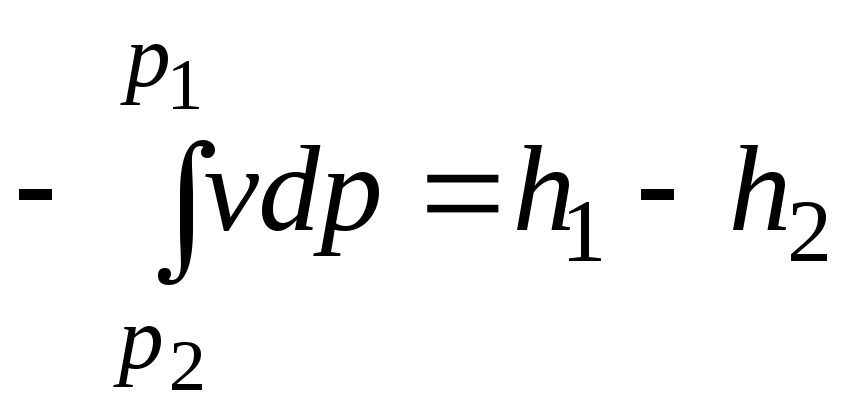 .
(7.3)
.
(7.3)
Сравнивая выражения (7.2) и (7.3), приходим к выводу, что
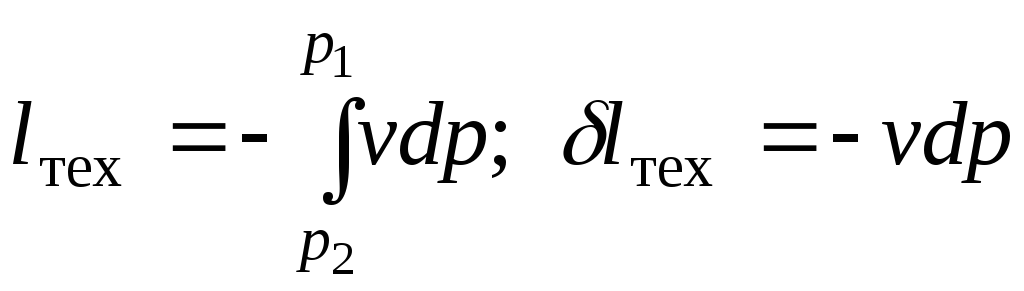 .
.
Таким образом, при
![]() ,
,
![]() и отсутствии потерь на трение получаемая
от двигателя техническая работа равна
располагаемой, т. е. тоже изображается
заштрихованной площадью на рисунке
7.2.
и отсутствии потерь на трение получаемая
от двигателя техническая работа равна
располагаемой, т. е. тоже изображается
заштрихованной площадью на рисунке
7.2.
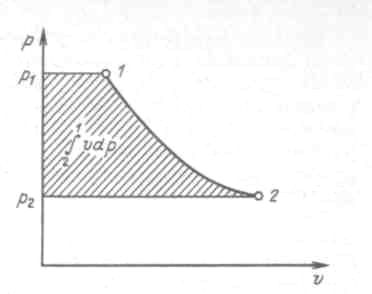
Рисунок 7.2 - Изображение располагаемой и технической работы в координатах p, v
Компрессор. Если
процесс сжатия газа в компрессоре
происходит без теплообмена с окружающей
средой (![]() )
и c1=c2,
что всегда можно обеспечить надлежащим
выбором сечений всасывающего и
нагнетательного воздухопроводов,
то
)
и c1=c2,
что всегда можно обеспечить надлежащим
выбором сечений всасывающего и
нагнетательного воздухопроводов,
то
![]()
В отличие от предыдущего случая здесь h1<h2, т.е. техническая работа в адиабатном компрессоре затрачивается на увеличение энтальпии газа.
Сопла и диффузоры.
Специально
спрофилированные каналы для разгона
рабочей среды и придания потоку
определенного направления называются
соплами.
Каналы,
предназначенные для торможения потока
и повышения давления, называются
диффузорами.
Техническая
работа в них не совершается, поэтому
уравнение ![]() приводится к виду
приводится к виду
![]() .
.
С другой стороны,
для объема рабочего тела, движущегося
в потоке без трения, применимо выражение
первого закона термодинамики для
закрытой системы ![]() .
.
Приравняв правые части двух последних уравнений, получим
![]() .
(7.4)
.
(7.4)
Видно,
что dc
и dp
всегда имеют
противоположные знаки. Следовательно,
увеличение скорости течения в канале
(dc>0)
возможно
лишь при уменьшении давления в нем
(dp<0).
Наоборот,
торможение потока (dc<0)
сопровождается увеличением давления
(dp>0),
Так
как длина сопла и диффузора невелика,
а скорость течения среды в них достаточно
высока, то теплообмен между стенками
канала и средой при малом времени
их контакта настолько незначителен,
что в большинстве случаев им можно
пренебречь и считать процесс истечения
адиабатным (![]() ).
При этом
уравнение
).
При этом
уравнение ![]() принимает вид
принимает вид
![]() .
(7.5)
.
(7.5)
Следовательно, ускорение адиабатного потока происходит за счет уменьшения энтальпии, а торможение потока вызывает ее увеличение.
Проинтегрировав соотношение (7.4) и сравнив его с уравнением (7.5), получим, что для равновесного адиабатного потока
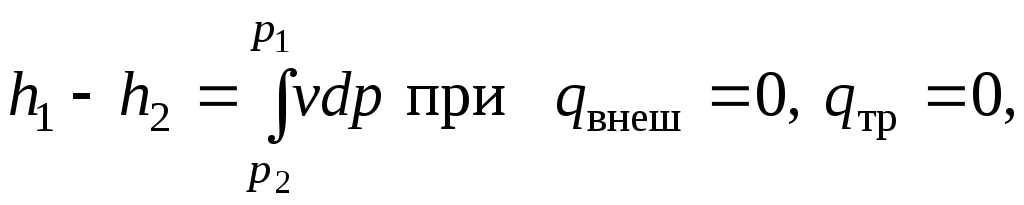
т. е. располагаемая работа при адиабатном расширении равна располагаемому теплоперепаду.
