
- •1. Поняття хімічної термодинаміки
- •2. Термодинамічні системи
- •3. Інтенсивні та екстенсивні параметри системи
- •4. Повна енергія системи. Внутрішня енергія системи
- •5. Перший закон термодинаміки
- •6. Ентальпія системи
- •Тому зручно ввести функцію:
- •7. Теплові ефекти
- •8. Закон Гесса
- •9. Ентропія системи
- •10. Мікро- і макростан системи. Рівняння Больцмана
- •11. Стандартні ентропії
- •Так, зміна ентропії в реакції
- •12. Критерій самовільного перебігу реакцій
- •13. Поняття про біохімічну термодинаміку
- •14. Лабораторна робота
- •15. Контрольні запитання
14. Лабораторна робота
Визначення теплоти нейтралізації
Згідно з теорією електролітичної дисоціації реакція між розведеними розчинами сильної кислоти і сильної основи зводиться до утворення води із Н+ і ОН-іонів незалежно від того, які сильні кислоти або сильні основи були взяті. Тому тепловий ефект утворення води завжди буде однаковий:
Н+(р) + ОН (р) Н2О (р), Нутв. = -56,9 кДж/моль.
Тепловий ефект зворотної реакції дисоціації води на Н+ і ОН-іони дорівнює теплоті нейтралізації, взятої із зворотним знаком, тобто Ндис. = 56,9 кДж/моль. Однак при змішуванні розчинів сильної кислоти і слабкої основи, або навпаки, слабкої кислоти і сильної основи тепловий ефект нейтралізації супроводжується тепловим ефектом гідратації іонів. У таких випадках сумарний тепловий ефект може бути меншим чи більшим 56,9 кДж/моль.
Обладнання та реактиви: калориметрична установка; мірний циліндр; конічні колби; хлоридна кислота, 1н.; нітратна кислота, 1н; сульфатна кислота, 1н.; ацетатна кислота, 1н.; натрій гідроксид, 1н; амоній гідроксид, 1н.
Визначити теплові ефекти 6 реакцій нейтралізації, взявши 1н. розчини кислот НСl, НNО3, Н2SО4, СН3СООН і основ NаОН і NH4ОН. Як калори-метр використовувати суху склянку з теплозахисною оболонкою.
Зібрати калориметричну установку, як показано на рис. 27.
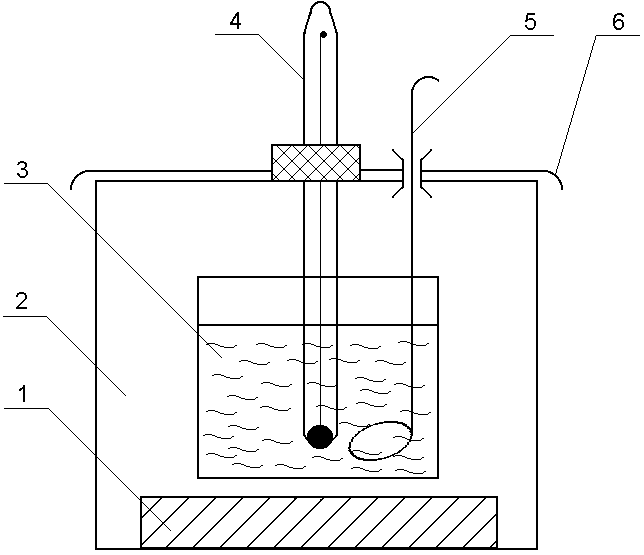
Рис. 27. Калориметрична установка: 1 ебонітова підставка; 2 зовнішня склянка; 3 внутрішня склянка (кало-риметр); 4 точний термометр; 5 мішалка; 6 кришка
Мірними циліндрами відміряти 100 мл розчину кислоти і 100 мл розчину лугу, вилити їх у конічні колби на 250 мл. Через 5-7 хвилин точним термометром виміряти температуру кожного розчину з точністю до 0,1С. Якщо температура не змінюється, записати показники термометра до табл. 9.
Таблиця 9. Дослідні дані, отримані при визначенні теплового
ефекту реакції нейтралізації
Кислота, мл |
НСl |
100 |
Основа, мл |
КОН |
100 |
Температура, °С: |
|
|
кислоти |
t1 |
23 |
основи |
t2 |
24 |
початкова суміші, tп |
|
23,5 |
кінцева суміші, tк |
|
30 |
Різниця температур t, С |
|
6,5 |
Об’єм розчину, м3 |
|
2 10-4 |
Теплота, виділена при реакції, Дж |
|
5439 |
Кількість утвореної Н2О, моль |
|
0,1 |
Ннейтр., Дж/моль |
|
54390 |
Термометр помістити в калориметр, одночасно швидко вилити розчини кислоти і лугу й, помішуючи мішалкою безперервно, стежити за показаннями термометра. Зазначити, підвищується чи знижується температура. Максимальне значення температури занести до таблиці (tк). На цьому дослід закінчується. Розрахунки вести у такій послідовності.
1. Обчислити величину зміни температури t = tк - tп.
2. Обчислити кількість теплоти Q за формулою
Q = С m (tк - tп), (57)
зауваживши, що густина реакційної суміші дорівнює 103 кг/м3 (1 г/см3), а С питома теплоємність 4,184 103 Дж/(кг град) (1 кал/г град).; m маса реакційної суміші, кг.
3. Обчислити кількість молів води, що утворилася в результаті нейтра-лізації, і перерахувати тепловий ефект нейтралізації на 1 моль.
4. Внести до таблиці дані вимірювань і розрахунків теплових ефектів шести виконаних реакцій.
Порівняти всі результати і зробити висновки.
