
- •Уральский федеральный университет титриметрический анализ
- •Титриметрический анализ
- •1. Эквивалент. Закон эквивалентов. Молярная концентрация эквивалента
- •2. Протолитометрия
- •2.1. Расчеты, связанные с приготовлением растворов
- •2.2. Кривые титрования. Выбор индикатора
- •2.3. Расчет результатов анализа
- •3. Редоксиметрия
- •3.1. Расчеты, связанные с приготовлением растворов
- •3.2. Кривые титрования. Расчет погрешности титрования
- •3.3. Расчет результатов анализа
- •4. Комплексонометрия
- •4.1. Расчет результатов анализа
- •Варианты индивидуальных заданий
- •Ответы к задачам
- •Раздел 2.1.
- •Раздел 2.3.
- •Раздел 3.2.
- •Раздел 3.3.
- •Раздел 4.1.
- •Библиографический список
3. Редоксиметрия
Методы редоксиметрии основаны на процессах переноса электронов, т.е. окислительно-восстановительных реакциях. Поскольку в процессе титрования изменяется редоксипотенциал системы, то точку эквивалентности можно определить по резкому изменению окраски специально вводимых в раствор веществ (редокс-индикаторов).
3.1. Расчеты, связанные с приготовлением растворов
Растворы в редоксиметрии обычно готовят из навесок твердых веществ.
Задача 3.I.1. Рассчитать массу навески дихромата калия, необходимую для приготовления 500 см3 0,01 н. раствора.
Решение. Масса навески соли m = VСЭMЭ. Дихромат калия в любой окислительно-восстановительной реакции может быть только окислителем:
Сr2O72- + 6е + 14Н+ = 2Сг3+ + 7Н2О.
Каждый моль соли участвует в реакции шестью электронами, поэтому молярная масса эквивалента соли равна 1/6 ее молярной массы.
m = 0,50,0149,031=0,2452 г.
Ответ: m(K2Cr2O7)=0,2452 г.
В табл. 3.1 даны формулы веществ и предполагаемые продукты окислительно-восстановительных полуреакций. Требуется рассчитать, какую навеску вещества надо взять для приготовления 1 л 0,1 н. раствора.
Таблица 3.1
Перечень веществ для приготовления растворов
Номер задачи |
Формула вещества и предполагаемый продукт |
Номер задачи |
Формула вещества и предполагаемый продукт |
1 |
2 |
3 |
4 |
92 |
|
106 |
|
93 |
|
107 |
|
94 |
|
108 |
UO2SO43H2O |
95 |
|
109 |
FeCl36H2O |
96 |
|
110 |
|
97 |
|
111 |
UO2(Ac)22H2O |
98 |
|
112 |
|
99 |
|
113 |
H2C2O42H2O |
100 |
|
114 |
K2SnCl42H2O |
101 |
|
115 |
|
102 |
|
116 |
|
103 |
|
117 |
|
104 |
NaVO34H2O |
118 |
|
105 |
|
119 |
|
3.2. Кривые титрования. Расчет погрешности титрования
Для построения теоретической кривой титрования и выбора индикатора в редоксиметрии необходимо найти зависимость изменения окислительно—восстановительного потенциала системы от количества добавляемого титранта.
Задача 3.2.1. Рассчитать область скачка редокси-потенциала и его значение в точке эквивалентности при титровании 100 см3 0,1 н. раствора U(SO4)2 раствором титранта Ce(SO4)2 той же концентрации. Разбавлением раствора в процессе титрования пренебречь. Концентрацию ионов водорода принять равной 1 моль/дм3. Рассчитать константу равновесия реакция. Вычислить погрешность титрования, если титрование заканчивается при редокспотенциале, равном 1,06 В (индикатор – 1,10-фенантролин).
Решение: Взаимодействие компонентов протекает по реакции:
![]() .
.
До наступления точки эквивалентности рассчитываем окислительно-восстановительный потенциал системы по формуле Нернста для редокспары:
UO2+2 + 2e + 4H+ = U+4 + 2H2O
![]()
Если окислено 99,9 % U(SO4)2 (раствор недотитрован на 0,1 %), то
![]()
В точке эквивалентности, т.е. при добавлении стехиометрически необходимого по реакции раствора титранта:
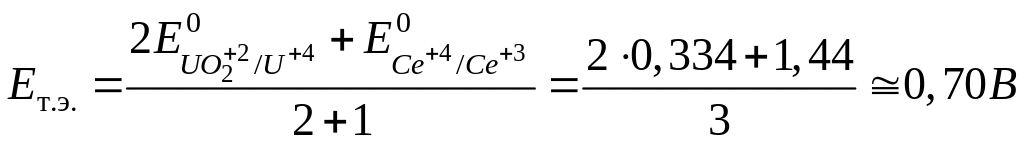
После точки эквивалентности потенциал рассчитывается по формуле Нернста для редокспары Се4+/ Се3+:
Ce+4 + e = Ce+3, E0 = +1,44 B (в сернокислой среде).
Если раствор перетитрован на 0,1 %, то:
![]()
Скачок редоксипотенциала на кривой титрования в эквивалентной области составляет: 1,26-0,42 = 0,84 В.
Константу равновесия реакции вычисляем по формуле:
![]()
K0равн = 3,161037.
E02 и E01 - стандартные редиоксипотенциалы для окислителя и восстановителя, соответственно; n1 и n2 – число электронов, участвующих в равновесии редокспар.
Большая величина Кравн говорит о том, что процесс идет практически необратимо.
Для титрования может быть выбран редокс-индикатор, потенциал перехода окраски которого Е°Ind лежит в пределах 0,42-1,26 В. При этом индикаторная погрешность титрования будет меньше 0,1 %.
При использовании 1,10-фенантролина титрование закончится при потенциале 1,06 В после наступления точки эквивалентности (0,70 В). Раствор будет перетитрован. Для расчета ошибки титрования обозначим процент избыточно добавленного Ce4+ через X %, а содержание Ce3+ – 100 %. Найдем X по формуле Нернста:
1,06=1,44+0,059lg(X/100), отсюда Х=310-5 %.
В задачах (табл.3.2) необходимо вычислить область скачка редоксипотенциала и его значение в точке эквивалентности при титровании 100,0 см3 0,1 н. раствора исходного вещества (графа 2) раствором титранта (графа 3) той же концентрации. При расчете можно не учитывать разбавление раствора в процессе титрования. Концентрацию ионов водорода принять равной 1 моль/дм3. Рассчитать константу равновесия реакции. Вычислить погрешность определения, если титрование закончено при потенциале, указанном в графе 4 таблицы (индикатор изменил окраску).
Таблица 3.2
Данные для расчета кривых титрования
Номера задач |
Растворы |
Потен- циал, В |
Номера задач |
Растворы |
Потен- циал, В |
||
Исходное вещество |
Титрант |
Исходное вещество
|
Титрант |
||||
1 |
2 |
3 |
4 |
1 |
2 |
3 |
4 |
120 |
|
|
0,56 |
133 |
|
|
1,33 |
121 |
|
|
1,25 |
134 |
|
|
1,25 |
122 |
|
|
0,53 |
135 |
|
|
0,76 |
123 |
|
|
0,97 |
136 |
|
|
1,00 |
124 |
|
|
0,97 |
137 |
|
|
0,84 |
125 |
|
|
0,76 |
138 |
|
|
0,97 |
126 |
|
|
0,24 |
139 |
|
|
0,53 |
127 |
|
|
0,53 |
140 |
|
|
0,85 |
128 |
|
|
1,06 |
141 |
|
|
1,08 |
129 |
|
|
1,06 |
142 |
|
|
1,33 |
130 |
|
|
1,08 |
143 |
|
|
0,56 |
131 |
|
|
1,25 |
144 |
|
|
0,37 |
132 |
|
|
1,00 |
145 |
|
|
1,06 |
