
- •Уральский федеральный университет титриметрический анализ
- •Титриметрический анализ
- •1. Эквивалент. Закон эквивалентов. Молярная концентрация эквивалента
- •2. Протолитометрия
- •2.1. Расчеты, связанные с приготовлением растворов
- •2.2. Кривые титрования. Выбор индикатора
- •2.3. Расчет результатов анализа
- •3. Редоксиметрия
- •3.1. Расчеты, связанные с приготовлением растворов
- •3.2. Кривые титрования. Расчет погрешности титрования
- •3.3. Расчет результатов анализа
- •4. Комплексонометрия
- •4.1. Расчет результатов анализа
- •Варианты индивидуальных заданий
- •Ответы к задачам
- •Раздел 2.1.
- •Раздел 2.3.
- •Раздел 3.2.
- •Раздел 3.3.
- •Раздел 4.1.
- •Библиографический список
2.2. Кривые титрования. Выбор индикатора
В
процессе кислотно-основного титрования
изменяется рН раствора, особенно резко
в окрестности точки эквивалентности.
Для правильного выбора индикатора
необходимо, чтобы его окраска изменялась
в точке эквивалентности (рНт.э.). Поскольку
выбор индикаторов ограничен, достаточно,
чтобы рТ индикатора (рН изменения
окраски) лежал в области скачка титрования,
т.е. области резкого изменения рН раствора
при заданной погрешности определения
(обычно
![]() или
или
![]() ).
).
Задача 2.2.1. Рассчитать кривую титрования 100 см3 0,1 М раствора гидрата гидразина (N2H2∙2H2O) 0,1 М раствором HCI при погрешности определения ± 0,1 %. Выбрать индикатор. Разбавлением раствора при титровании пренебречь.
Решение. Водный раствор гидрата гидразина – слабое основание.
К
=
![]() (рК = 6,03),
(рК = 6,03),
С = 0,1 моль/л,
V = 100 мл Const.
Рассчитаем рН исходного раствора:
![]() ;
;
![]() .
.
До наступления точки эквивалентности в растворе находится смесь слабого основания и его соли, образующейся в процессе титрования. При добавлении 99,9 см3 0,1 М HCI в растворе образовалось соли
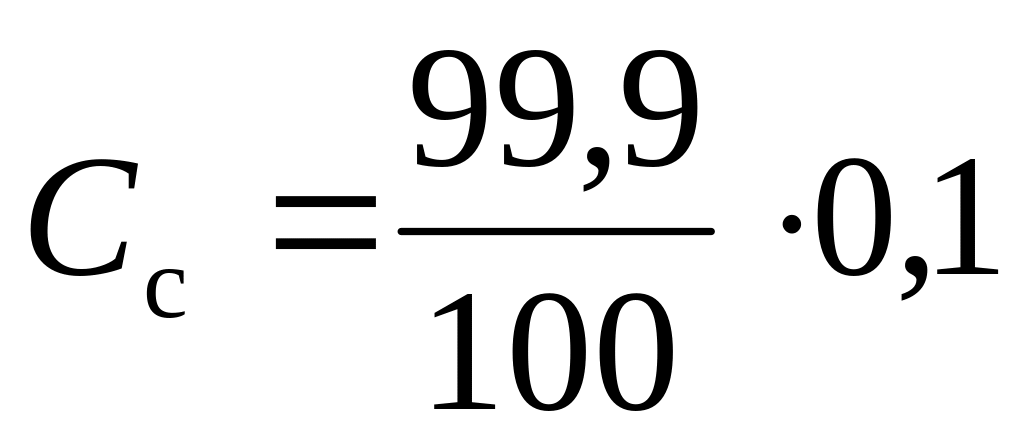 и осталось основания
и осталось основания
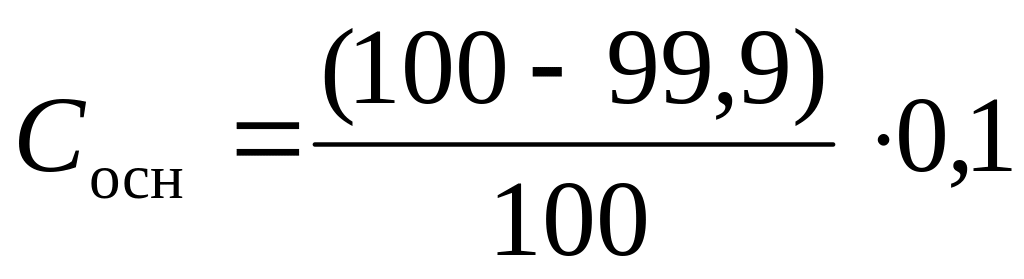 (без учета разбавления раствора при
титровании), тогда
(без учета разбавления раствора при
титровании), тогда
![]()
В точке эквивалентности величина рН определяется процессом гидролиза образующейся соли слабого основания и сильной кислоты:
![]() .
.
После точки эквивалентности рН раствора обусловлен избытком сильной кислоты, при этом изменением рН за счет гидролиза соли можно пренебречь. Если после точки эквивалентности введено 0,1 см3 0,1 М HCI в раствор, объемом 100 см3, то концентрация кислоты будет равна:
![]() моль/л,
моль/л, ![]() .
.
Итак, скачок на кривой титрования рН = 54. Для титрования можно выбрать один из наиболее известных индикаторов, например, метиловый красный, у которого переход окраски наблюдается при рТ = 5, или метиловый оранжевый – рТ = 4. При использовании первого индикатора раствор будет несколько недотитрован, при втором – перетитрован.
В задачах (табл.2.2) надо рассчитать кривую титрования, т.е. найти рН исходного раствора, область скачка для погрешности ± 0,1 % и значения рН в точке эквивалентности. Выбрать индикатор. Растворы исходных веществ приведены в графе 2, растворы титрантов в графе 3. Концентрации обоих растворов даны в графе 4.
Таблица 2.2
Данные для расчета кривой титрования
Номер задачи |
Раствор исходного вещества V=100 мл |
Раствор титранта |
Молярная концентрация, моль/дм3 |
1 |
2 |
3 |
4 |
43 |
Бензойная кислота |
KOH |
0,15 |
44 |
Хлороводородная кислота |
NaOH |
0,25 |
45 |
Гидроксид калия |
HCl |
0,15 |
46 |
Фтороводородная кислота |
KOH |
0,04 |
47 |
Муравьиная кислота |
KOH |
0,04 |
48 |
Пропионовая кислота |
NaOH |
0,01 |
49 |
Азотная кислота |
NaOH |
0,01 |
50 |
Гидрат ацетамида |
HCl |
0,10 |
51 |
Гидрат бензиламина |
HCl |
0,10 |
52 |
Гидрат этаноламина |
HCl |
0,01 |
53 |
Гидрат гидразина |
HCl |
0,20 |
54 |
Гидрат метиламина |
HCl |
0,03 |
55 |
Гидрат этиламина |
HCl |
0,05 |
56 |
Гидроксид натрия |
HCl |
0,04 |
57 |
Хлороводородная кислота |
NaOH |
0,05 |
58 |
Азотная кислота |
KOH |
0,001 |
59 |
Серная кислота |
KOH |
0,01 |
60 |
Серная кислота |
NaOH |
0,005 |
61 |
Муравьиная кислота |
NaOH |
0,1 |
62 |
Бензойная кислота |
KOH |
0,1 |
63 |
Уксусная кислота |
KOH |
0,025 |
64 |
Гидроксид натрия |
HCl |
0,002 |
65 |
Водный раствор аммиака |
HCl |
0,1 |
66 |
Азотистая кислота |
KOH |
0,1 |
67 |
Анилидоуксусная кислота |
NaOH |
0,1 |
