
- •Уральский федеральный университет титриметрический анализ
- •Титриметрический анализ
- •1. Эквивалент. Закон эквивалентов. Молярная концентрация эквивалента
- •2. Протолитометрия
- •2.1. Расчеты, связанные с приготовлением растворов
- •2.2. Кривые титрования. Выбор индикатора
- •2.3. Расчет результатов анализа
- •3. Редоксиметрия
- •3.1. Расчеты, связанные с приготовлением растворов
- •3.2. Кривые титрования. Расчет погрешности титрования
- •3.3. Расчет результатов анализа
- •4. Комплексонометрия
- •4.1. Расчет результатов анализа
- •Варианты индивидуальных заданий
- •Ответы к задачам
- •Раздел 2.1.
- •Раздел 2.3.
- •Раздел 3.2.
- •Раздел 3.3.
- •Раздел 4.1.
- •Библиографический список
Уральский федеральный университет титриметрический анализ
Методические указания к лабораторному практикуму
Екатеринбург
УрФУ
2011
УДК 543 (076.1)
Составители Д.А. Данилова, С.Ю. Пальчикова
Научный редактор к.х.н. С.Ю. Пальчикова
ТИТРИМЕТРИЧЕСКИЙ АНАЛИЗ: Методические указания для самостоятельной работы по курсу «Аналитическая химия и ФХМА» / Д.А. Данилова, С.Ю. Пальчикова. – Екатеринбург : УрФУ, 2011. – 41 с.
Методические указания включают 196 задач с ответами, на основе которых составлено 50 индивидуальных заданий. Приведены решения типовых задач с краткими теоретическими пояснениями.
Библиогр.: 8 назв.
Методические указания одобрены на заседании кафедры физико-химических методов анализа
“_____”______________2011 г. протокол №
Методические указания одобрены на заседании Учебно-методического совета физико-технологического института УрФУ и рекомендованы к изданию
“_____”______________2011 г. протокол №
© Уральский федеральный университет, 2011
Титриметрический анализ
Титриметрические методы анализа основаны на постепенном добавлении реагента-титранта (раствора с точно известной концентрацией) к анализируемому раствору. Процесс титрования продолжают до тех пор, пока количество добавляемого вещества не будет эквивалентно (равноценно) количеству определяемого компонента в анализируемом растворе.
Момент стехиометричности (точку эквивалентности) определяют визуально по изменению окраски раствора (появлению осадка, возникновению люминесценции) или инструментально по изменению физических свойств растворов (потенциала, электропроводности и т.д.).
Титриметрические методы разделяют по типу используемых химических реакций: обмен протонами (протолитометрия или кислотно-основное титрование); обмен электронами (редоксиметрия или окислительно-восстановительное титрование); образование малодиссоциированных комплексных соединений (комплексометрия); образование осадков (седиметрия или осадительное титрование).
В титриметрии используют следующие способы выражения концентраций растворов: молярная – С (моль/дм3; M), массовая – с (г/дм3, мг/см3, мкг/см3), а также массовая доля – (%). В практике массовых анализов широко применяют выражение титр раствора-титранта по определяемому веществу – ТR/A, который показывает массу определяемого вещества A в граммах, эквивалентную одному миллилитру титранта R.
Например, ТHCI/СаО = 0,002 (г/см3) означает, что один миллилитр титранта - раствора НСl соответствует (эквивалентен) 0,002 граммам СаО в анализируемом растворе.
Кроме того, часто применяют молярную концентрацию эквивалента или нормальную концентрацию – Сэ (моль/дм3; н.).
1. Эквивалент. Закон эквивалентов. Молярная концентрация эквивалента
Эквивалентом называется реальная или условная частица (молекула, ион, формульная единица или их часть), которая эквивалентна (равноценна) в химическом отношении одному иону водорода в обменных реакциях или одному электрону в окислительно-восстановительных реакциях.
При использовании термина "эквивалент" необходимо указать, к какой конкретно реакций он относится, например:
1.
![]()
![]()
![]()
2.![]()
![]()
3.
![]()
![]()
![]()
Количество
эквивалентов измеряется в молях. Масса
моля эквивалентов (![]() частиц,
условных или реальных) называется
молярной
массой
эквивалента
(МЭ).
Очевидно, что молярная масса эквивалента
для одного и того же соединения (элемента)
может быть различной в зависимости от
реакции. Так, для реакции (3) МЭ(Fе)=М(Fе)=55,85
г/моль, а для реакции (2) МЭ(Fе)=М(Fе)/3=
18,62 г/моль.
частиц,
условных или реальных) называется
молярной
массой
эквивалента
(МЭ).
Очевидно, что молярная масса эквивалента
для одного и того же соединения (элемента)
может быть различной в зависимости от
реакции. Так, для реакции (3) МЭ(Fе)=М(Fе)=55,85
г/моль, а для реакции (2) МЭ(Fе)=М(Fе)/3=
18,62 г/моль.
По закону эквивалентов массы веществ, взаимодействующих друг с другом без остатка, пропорциональны молярным массам их эквивалентов.
Если взаимодействуют вещества А и В, то
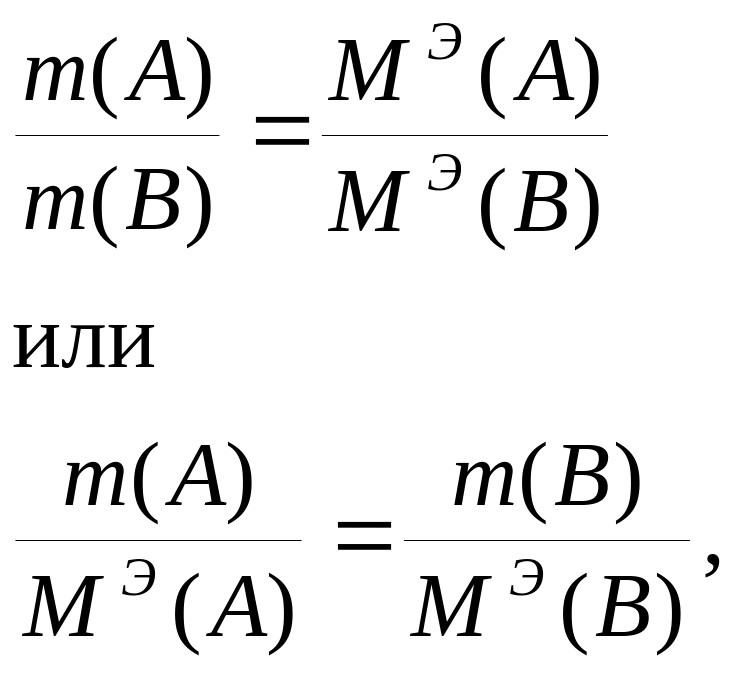
![]() –
число
молей эквивалентов.
–
число
молей эквивалентов.
Значит Э(А) = Э(В).
Закон эквивалентов: если два вещества реагируют без остатка (соединяются, вытесняют, замещают, окисляют или восстанавливают друг друга), то число молей эквивалентов одного равно числу молей эквивалентов другого.
В этом удобство использования закона эквивалентов для расчетов. Так, в реакции (1) массы серной кислоты и щелочи (98 г и 80 г) не равны, число молей (1 и 2) не равно, но число молей эквивалентов равно.
В задачах (табл.1) требуется рассчитать молярную массу эквивалента (г/моль) веществ, указанных в графах 2 и 3 для реакции, схема которой представлена в графе 4. Уравнение реакции записать полностью.
Таблица 1
Данные для расчета молярной массы эквивалента
Номер задачи |
Вещество |
Реакция |
|
1 |
2 |
3 |
4 |
1 |
|
|
|
2 |
|
|
|
3 |
|
|
|
4 |
|
|
|
5 |
|
|
|
6 |
|
|
|
7 |
|
|
|
8 |
|
|
|
9 |
|
|
|
10 |
|
|
|
11 |
|
|
|
12 |
|
|
|
13 |
|
|
|
14 |
|
|
|
15 |
|
|
|
16 |
|
|
|
Концентрация, выраженная числом молей эквивалентов вещества в одном литре раствора, называется молярной концентрацией эквивалента или нормальной концентрацией. При этом, например, для серной кислоты применяют такую форму записи:
![]() моль/л
или
моль/л
или
![]() н.
(однонормальный раствор).
н.
(однонормальный раствор).
Последняя форма записи не дает указаний на реакцию, в которой предполагается использовать серную кислоту.
Так
как молярная масса эквивалента равна
или меньше молярной массы вещества, то
нормальная концентрация равна или
больше
молярной концентрации данного раствора.
Например, если молярная концентрация
раствора серной кислоты
![]() моль/л,
то
нормальная
концентрация данного раствора
моль/л,
то
нормальная
концентрация данного раствора
![]() моль/л.
Для раствора NaOH
нормальная концентрация совпадает с
молярной.
моль/л.
Для раствора NaOH
нормальная концентрация совпадает с
молярной.
Если
известны нормальная концентрация
раствора некоторого вещества - Сэ, моль/л,
и его объем - V, л,
то можно рассчитать число эквивалентов
этого вещества
![]() .
.
При взаимодействии раствора вещества А с раствором вещества B согласно закону эквивалентов получим:
![]() .
.
Например, для реакции
H2SO4 + 2NaOH = 2H2O + Na2SO4
![]()
