
- •Газы, состав, физические и химические свойства.
- •1.1 Угарный газ (со)
- •1.2 Дымовые газы
- •1.3 Промышленные газы
- •Основные свойства и физико-химические величины со2
- •2.1 Физические свойства.
- •2.2 Химические свойства.
- •2.3 Распространенность в природе и получение.
- •2.4 Строение и константы молекулы со2
- •3. Исследование спектов поглощения со2 методом инфракрасной фурье-спектроскопии
- •3.1 Основные принципы инфракрасной фурье-спектроскопии и описание фурье-спектрометра фсм 1202
- •Цель лабораторной работы
- •4.1 Краткое изложение методики:
- •3Этап: Проведение записи спектров газа с неизвестной концентрацией.
- •4 Этап: Определение неизвестной концентрации
- •Этап: Оценка погрешности результатов анализа.
- •4.2. Исходные данные:
- •4.3. Обработка результатов измерений
- •4.4. Анализ полученных данных
- •4.5 Определение межъядерного расстояния для молекулы со2 и h2o.
- •Выводы и конечные результаты
- •Приложение
2.2 Химические свойства.
СО2 – малоактивное соединение. При растворении в воде образует слабую угольную кислоту, окрашивающую лакмусовую бумажку в красный цвет. Угольная кислота улучшает вкусовые качества газированных напитков и предотвращает рост бактерий. Реагируя со щелочными и щелочноземельными металлами, а также с аммиаком, СО2 образует карбонаты и бикарбонаты.
2.3 Распространенность в природе и получение.
СО2 образуется при сжигании углеродсодержащих веществ, спиртовом брожении, гниении растительных и животных остатков; он высвобождается при дыхании животных, его выделяют растения в темноте.
На свету, напротив, растения поглощают СО2 и выделяют кислород, что поддерживает природный баланс кислорода и углекислого газа в воздухе, которым мы дышим. Содержание СО2 в нем не превышает 0,03% (по объему).
Известно пять основных способов получения СО2: сжигание углеродсодержащих веществ (кокса, природного газа, жидкого топлива); образование в качестве побочного продукта при синтезе аммиака; прокаливание известняка; брожение; откачка из скважин.
В последних двух случаях получается практически чистый диоксид углерода, а при сжигании углеродсодержащих веществ или прокаливании известняка образуется смесь СО2 с азотом и следами других газов. Эту смесь пропускают через раствор, поглощающий только СО2. Затем раствор нагревают и получают практически чистый СО2, который отделяют от оставшихся примесей. От паров воды избавляются вымораживанием и химической сушкой.
Получение:
1. Термическим разложением солей угольной кислоты (карбонатов). Обжиг известняка – в промышленности:
CaCO3 t=1200˚C→ CaO + CO2
2. Действием сильных кислот на карбонаты и гидрокарбонаты –
в лаборатории:
CaCO3 (мрамор) + 2HCl → CaCl2 + H2O + CO2
NaHCO3 + HCl → NaCl + H2O + CO2
3. Сгорание углеродсодержащих веществ:
СН4 + 2О2 → 2H2O + CO2
4. При медленном окислении в биохимических процессах (дыхание, гниение, брожение)
2.4 Строение и константы молекулы со2
Молекула |
Форма |
Межъядерное Расстояние, А |
Направление колебаний |
Ст.вырождения |
Обозн. |
Волн. Число, см-1 |
Характер. Температура, К |
СО2 |
Линейная симметричная О=С=О |
1,13 |
|
2 |
ᶹ(s) ᶹ(as) ᶞ(as) |
1351,2 2349,16 667,4 |
1994 3448 968 |
3. Исследование спектов поглощения со2 методом инфракрасной фурье-спектроскопии
3.1 Основные принципы инфракрасной фурье-спектроскопии и описание фурье-спектрометра фсм 1202
Спектроскопия — разделы физики и аналитической химии, посвящённые изучению спектров взаимодействия излучения (в том числе, электромагнитного излучения, акустических волн и др.) с веществом. В аналитической химии — для обнаружения и определения веществ при помощи измерения их характеристических спектров, то есть методами спектрометрии. К существенным преимуществам спектроскопии можно отнести возможность диагностики in situ, то есть непосредственно в «среде обитания» объекта, бесконтактно, дистанционно, без какой-либо специальной подготовки объекта.
Каждый атом и молекула имеют уникальное строение, которому соответствует свой уникальный спектр. Структура спектра атома, молекулы или образованной ими макросистемы определяется их энергетическими уровнями. Согласно законам квантовой механики, каждый энергетический уровень соответствует определенному квантовому состоянию. Электроны и ядра в таком состоянии совершают характерные периодические движения, для которых энергия, орбитальный момент количества движения и другие физические величины строго определены и квантованы, т.е. принимают лишь разрешенные дискретные значения, соответствующие целым и полуцелым значениям квантовых чисел. Если известны силы, связывающие электроны и ядра в единую систему, то по законам квантовой механики можно рассчитать ее уровни энергии и квантовые числа, а также предсказать интенсивности и частоты спектральных линий. С другой стороны, анализируя спектр конкретной системы, можно определить энергии и квантовые числа состояний, а также сделать выводы относительно действующих в ней сил. Таким образом, спектроскопия является основным источником сведений о квантово-механических величинах и о строении атомов и молекул [2].
Инфракрасная спектроскопия (ИКС) — раздел спектроскопии, охватывающий длинноволновую область спектра (>730 нм за красной границей видимого света и продолжается до 2,5 мм - граница микроволновой области).
Инфракрасные спектры возникают в результате колебательного (отчасти вращательного) движения молекул, а именно — в результате переходов между колебательными уровнями основного электронного состояния молекул. ИК излучение поглощают многие газы, за исключением таких как О2, N2, H2, Cl2 и одноатомных газов. Поглощение происходит на длине волны, характерной для каждого определенного газа, для СО2, например, таковой является длина волны 2,7-2,8 мкм.
В координатах интенсивность поглощенного излучения - длина волны (или волновое число) ИК спектр представляет собой сложную кривую с большим числом максимумов и минимумов. Полосы поглощения появляются в результате переходов между колебательными уровнями основного электронного состояния изучаемой системы.
Спектральные характеристики (положения максимумов полос, их полуширина, интенсивность) индивидуальной молекулы зависят от масс составляющих ее атомов, геометрического строения, особенностей межатомных сил, распределения заряда и др. Поэтому ИК спектры отличаются большой индивидуальностью, что и определяет их ценность при идентификации и изучении строения соединений. Для регистрации спектров используют классические спектрофотометры и фурье-спектрометры.
Основные части классического спектрофотометра - источник непрерывного теплового излучения, монохроматор, неселективный приемник излучения. Кювета с веществом (в любом агрегатном состоянии) помещается перед входной (иногда за выходной) щелью. В качестве диспергирующего устройства монохроматора применяют призмы из различных материалов (LiF, NaCl, KCl, CsF и др.) и дифракционной решетки. Последовательное выведение излучения различных длин волн на выходную щель и приемник излучения (сканирование) осуществляется поворотом призмы или решетки.
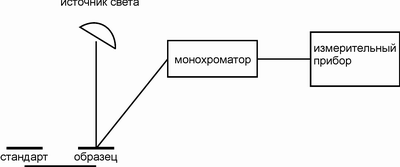
Рисунок 3.1.1- Конструкция спектрофотометра
Источники излучения - накаливаемые электрическим током стержни из различных материалов. Приемники: чувствительные термопары, металлические и полупроводниковые термосопротивления (болометры) и газовые термопреобразователи, нагрев стенки сосуда которых приводит к нагреву газа и изменению его давления, которое фиксируется. Выходной сигнал имеет вид обычной спектральной кривой.
Достоинства приборов классической схемы: простота конструкции, относит. дешевизна. Недостатки: невозможность регистрации слабых сигналов из-за малого отношения сигнал: шум, что сильно затрудняет работу в далекой ИК области; сравнительно невысокая разрешающая способность (до 0,1 см-1), длительная (в течение минут) регистрация спектров.
В фурье-спектрометрах отсутствуют входная и выходная щели, а основной элемент - интерферометр. Поток излучения от источника делится на два луча, которые проходят через образец и интерферируют. Разность хода лучей варьируется подвижным зеркалом, отражающим один из пучков. Первоначальный сигнал зависит от энергии источника излучения и от поглощения образца и имеет вид суммы большого числа гармонич. составляющих. Для получения спектра в обычной форме производится соответствующее фурье-преобразование с помощью встроенной ЭВМ. Достоинства фурье-спектрометра: высокое отношение сигнал: шум, возможность работы в широком диапазоне длин волн без смены диспергирующего элемента, быстрая (за секунды и доли секунд) регистрация спектра, высокая разрешающая способность (до 0,001 см-1). Недостатки: сложность изготовления и высокая стоимость.
Все спектрофотометры снабжаются ЭВМ, которые производят первичную обработку спектров: накопление сигналов, отделение их от шумов, вычитание фона и спектра сравнения, изменение масштаба записи, вычисление экспериментальных спектральных параметров, сравнение спектров с заданными, дифференцирование спектров и др.
Кюветы для ИК спектрофотометров изготовляют из прозрачных в ИК области материалов. В качестве растворителей используют обычно ССl4, СНСl3, тетрахлорэтилен, вазелиновое масло. Твердые образцы часто измельчают, смешивают с порошком КВr и прессуют таблетки. Для работы с агрессивными жидкостями и газами применяют спец. защитные напыления (Ge, Si) на окна кювет. Мешающее влияние воздуха устраняют вакуумированием прибора или продувкой его азотом. В случае слабо поглощающих веществ (разреженные газы и др.) применяют многоходовые кюветы, в которых длина оптического пути достигает сотен метров благодаря многократным отражениям от системы параллельных зеркал [3] .
ИК Фурье-спектрометр ФСМ-1202 – лабораторный спектрометр для средней и ближней ИК-областей, выпускаемый внедренческим предприятием ООО «Мониторинг» ФГУП «ВНИИМ им. Д.И. Менделеева». Фурье-спектрометр ФСМ-1202 предназначен для качественного и количественного анализа твердых, жидких и газообразных образцов и контроля качества продукции по ИК спектрам [4].
Рисунок 3.1.2 - ИК Фурье спектрометр ФСМ 1202

