
- •Глава 5. Полимерные компаунды
- •Глава 6. Полимерные герметики
- •Глава7. Полимерные клеи
- •Глава 8. Лакокрасочные материалы и покрытия на их основе
- •Глава 9. Неорганические материалы
- •9.1. Техническая керамика
- •9.2. Неорганические стекла
- •9.2.1. Стеклообразное состояние и строение стекла
- •9.2.2. Электротехнические стекла
- •9.2.3. Оптические стекла
- •9.3. Ситаллы
- •9.4. Слюда и слюдяные материалы
- •9.5. Асбест и материалы на его основе
9.2. Неорганические стекла
9.2.1. Стеклообразное состояние и строение стекла
Стеклообразное состояние вещества представляет собой аморфную разновидность твердого состояния. Если вещества, находящиеся в расплавленном жидком состоянии охлаждать, то они затвердевают и могут кристаллизоваться или перейти в стеклообразное состояние (рис 9.1.)
По кривой 1 видно, что расплав переохлаждается, выделяется скрытая теплота кристаллизации и при Тпл за некоторый промежуток времени вещество кристаллизуется, а затем охлаждается в твердом состоянии.
Кривая 2 не имеет изломов, что свидетельствует о плавном и постоянном изменении свойств вещества при застывании в твердое стеклообразное состояние. При этом нет определенной температуры плавления жидкости, частицы вещества не располагаются в определенную пространственную решетку. Стекловидное вещество становится твердым аморфным и изотропным.

Рис. 9.1. Кривые охлаждения: 1 – кристаллическое вещество; 2 – аморфное вещество
Температура Тf соответствует вязкости 104 Пас, в стекле начинают появляться пластические свойства.
Температура Тg соответствует вязкости 1010 Пас, в стекле начинает появляться хрупкость.
Выше Тf – расплав, ниже Тg – твердое стеклообразное состояние.
Интервал Тg – Tf называют интервалом размягчения. Значение температур Tg, Tf, а также интервал стеклования (Tg – Tf ) зависят от состава стекла.
Значения Тg, Tf, (Тg – Tf), С для различных стекол
-
Тип стекла
Тg
Tf
(Тg – Tf)
Листовое
550
700
150
Оптическое
430
570
140
Кварцевое
250
1500
250
К настоящему времени нет завершенной теории строения стекла. Существуют несколько теоретических направлений решения проблемы строения стекла, среди которых наиболее широкое распространение получили кристаллохимическое и валентно-химическое.
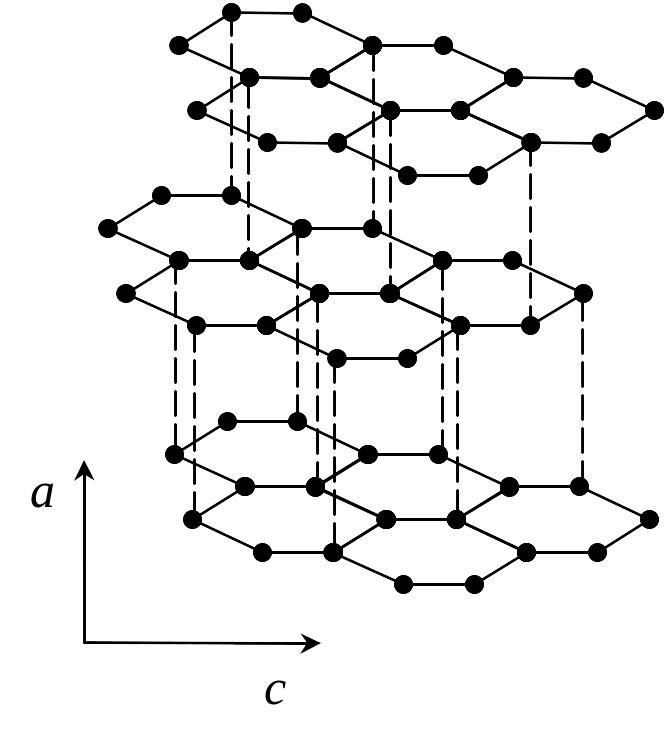
В основе кристаллохимического описания строения стекла лежат понятия ближнего и дальнего порядка в структуре вещества. Ближний порядок означает правильное расположение отдельных атомов относительно некоторого фиксированного атома. Для оксидных стекол ближний порядок характеризует расположение атомов кислорода относительно катионов. Например, атомы кремния всегда окружены четырьмя атомами кислорода. Координационные группировки [SiO4]4- сохраняются в расплавленном, кристаллическом или стеклообразных состояниях диоксида кремния (SiO2). Это означает, что в структуре стекла сохраняется ближний порядок в расположении анионов относительно катионов кремния.
а
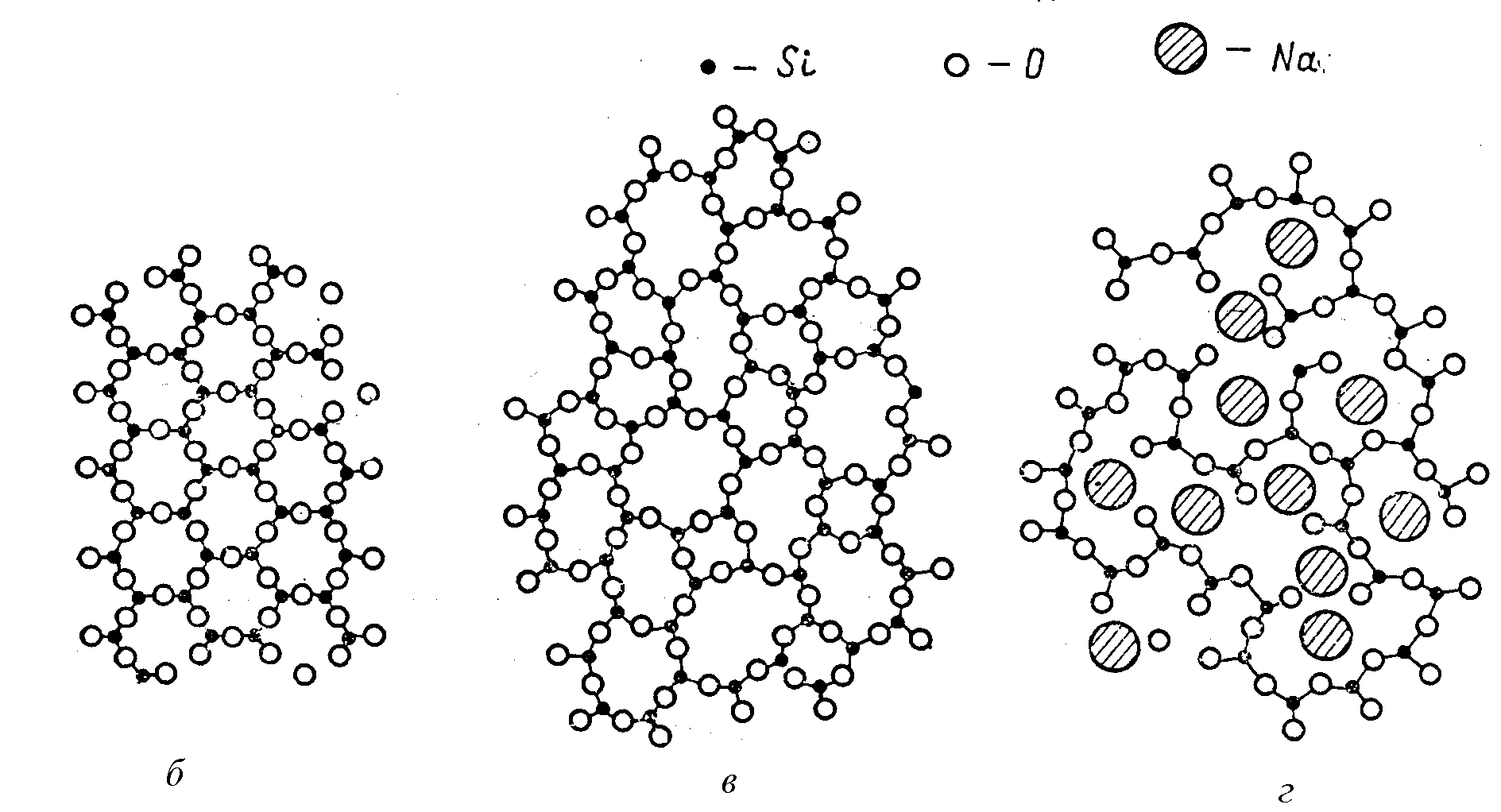
Рис. 9.2. Тетраэдрическая группировка [SiO4]4- (а) и схематическое изображение на плоскости сочленения тетраэдров в структуре кристаллического (б) и стеклообразных (в, г) веществ (показаны только три из четырех атомов кислорода)
Основными элементами структуры силикатных стекол являются тетраэдры [SiO]4-, которые, соединясь друг с другом вершинами, способны образовывать непрерывную в одном, двух или трех измерениях непрерывный пространственный каркас (рис. 9.2). Тетраэдры SiO4 не образует в пространстве геометрически правильных сочленений в виде шестичленных колец, характерных для структуры кристаллического тела (рис. 9.2, б). Структурная сетка стекла выглядит как искаженная кристаллическая решетка (рис. 9.2, в). Искажение заключается в произвольном варьировании значений угла связи Si-O-Si между соседними тетраэдрами в структуре стекла.
Рис. 9.2. Тетраэдрическая группировка [SiO4]4- (а) и схематическое изображение на плоскости сочленения тетраэдров в структуре кристаллического (б) и стеклообразных (в, г) веществ (показаны только три из четырех атомов кислорода).
Катионы модификаторов располагаются в свободных полостях структурной сетки, компенсируя избыточный отрицательный заряд сложного аниона (рис. 9.2, г) кислородное окружение катионов модификаторов формируется в соответствии с их требованиями.
В валентно-химическом описании строения стекол основное внимание уделяется вопросам электронного строения атомов, участвующих в образовании стекла, и природы химической связи между его компонентами.
Стекла – это аморфные изотропные материалы, представляющие собой сложные системы, получаемые при быстром охлаждении расплавленных исходных компонентов.
Процесс постепенного перехода переохлажденной жидкости в стеклообразное состояние называется стеклованием. Стеклообразное состояние неустойчиво, т.е. при определенных условиях вещество может перейти в кристаллическое состояние.
По типу неорганических соединений различают следующие классы стекол: элементарные, галогенидные, халькогенидные, оксидные, металлические, сульфатные, нитратные, карбонатные и др.
Элементарные стекла способны образовывать небольшое число элементов – сера, селен, мышьяк, фосфор, углерод.
Галогенидные стекла получают на основе стеклообразующего компонента BeF2. Многокомпонентные составы фторборилатных стекол содержат также фториды алюминия, кальция, магния, стронция, бария.
Халькогенидные стекла представляют собой бескислородные системы типа As-X (где X - S, Se, Te), Ge-As-X, Ge-P-X и др., которые обладают электронной проводимостью, обнаруживают внутренний фотоэффект и применяются в телевизионных высокочувствительных камерах и ЭВМ в качестве переключателей или элементов запоминающих устройств.
Оксидные стекла представляют собой обширный класс соединений на основе чистых или смесей основных и кислотных окислов.
По своей роли в процессе стеклообразования и по своему положению в структуре стекла окислы всех катионов подразделяются на три основные группы:
Стеклообразующие окислы – то есть такие, которые сами могут образовывать стекла без добавок других окислов. К ним относятся SiO2, B2O3, P2O5, GeO2, As2O3.
Модифицирующие окислы: CaO, BaO, Na2O, K2O и др., способные изменять характеристики стекол. Так, щелочные окислы вводят для снижения температуры варки стекол.
Промежуточные окислы (ТеО2, TiO2, Al2O3, WO3 и др.), которые образуют стекла при сплавлении с другими оксидами или смесями оксидов.
Стекла получают названия по виду стеклообразующего окисла: силикатные, боратные, фосфатные, германатные и т.д.
Промышленные стекла являются многокомпонентными системами и содержат, как правило, не менее 5 компонентов, а специальные и оптические стекла могут содержать до 10 и более компонентов.
Плотность стекол изменяется от 2,2 до 8,1 Мг/м3, для обычных промышленных стекол она близка к 2500–2700 кг/м3.
Механическая прочность стекла зависит не столько от химического состава, сколько от состояния поверхности. Прочность технических стекол при растяжении чрезвычайно низка и составляет 20–50 МПа, что обусловлено наличием на его поверхности большого количества микродефектов, являющихся концентраторами напряжений.
Прочность стекла при сжатии значительно выше, чем при растяжении (200–500 МПа).
Температура размягчения (Тр) для стекол различного состава изменяется в пределах 350–1250С. Наиболее тугоплавким является кварцевое стекло.
Температурный коэффициент линейного расширения стекол меняется от 5,8.10–7 (кварцевое стекло) до 150.10–7С. Химическая и гидролитическая стойкость стекол в кислых средах (кроме фосфорной H2PO3 и плавиковой HF кислот, полностью растворяющих стекол) довольно высока (растворимость составляет 0,01–0,1%), а в щелочных средах стойкость снижается (растворимость достигает 0,5–2,0%). Силикатные стекла с содержанием 20–30% Na2O или K2O растворимы в горячей воде и образуют "жидкие стекла".
Химическая стойкость электротехнических стекол имеет существенное значение как при эксплуатации (воздействие влаги, воздуха и т.д.), так и при изготовлении приборов. Некоторые виды электровакуумных и электротехнических стекол должны обладать повышенной стойкостью к парам щелочных металлов и также ртути.
Стекла обладают прозрачностью в видимой области спектра. Введение в их состава специальных веществ (глушителей) приводит к образованию глушенных стекол, полностью непрозрачных или рассеивающих свет.
Технические стекла практически непроницаемые для всех газов, за исключением гелия.
Свойства стекол зависят от состава и могут меняться в широких пределах.
Существенное влияние на электроизоляционные характеристики стекол оказывает введение в их состав окислов щелочных металлов (Na2O, K2O).
Так, удельное объемное сопротивление уменьшается на 5–6 порядков при увеличении процентного содержания K2O и Na2O. Наилучшими электрическими свойствами обладает кварцевое стекло, которое содержит только SiO2. Электропроводность стекла ионная и зависит от радиуса иона K, то стекол, содержащих Na+, растет сильнее, чем у стекол, содержащих К+.
При наличии в стекле ионов переменной валентности (Pb, V, Fe) может иметь место и электронная электропроводность. Стекла такого состава могут быть полупроводниками (например, халькогенидные стекла).
Введение в состав стекла окислов тяжелых металлов (Ba, Ti, Pb) нейтрализуют действие K2O, Na2O и уменьшает проводимость стекол.
При низких температурах v технических стекол составляет 109–1017 Ом.м. Электропроводность стекла осуществляется ионами щелочных (Li+, Na+, K+), а в некоторых случаях щелочноземельных (Mg++) металлов, а также анионов (F–, OH–).
Диэлектрическая проницаемость Е стекол меняется от 3,75 (для кварцевого стекла) до 8–16.
Для различных стекол tg находится в пределах (2–300).10–4.
Электрическая прочность Епр стекол зависит как от их состава, так и от наличия внутри материала газовых пузырьков. Наибольшей электрической прочностью обладают боросиликатные стекла, наименьшей – щелочные. Прибивная напряженность большинства стекол составляет 35–40 МВ/м.
